ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.07.2024
Просмотров: 409
Скачиваний: 0
СОДЕРЖАНИЕ
Федеральное агентство по образованию
Глава 1. Металлические материалы 7
Глава 1. Металлические материалы
1.1. Основные сведения о производстве металлов и сплавов
1.2. Основные свойства металлов и сплавов
1.3. Механические свойства металлов и сплавов
Глава 2. Физические основы Спектрального анализа
2.1. Общее представление о строении вещества
2.2. Строение атома и атомные спектры
3.1. Возбуждение вещества и интенсивность спектральных линий
3.3. Схемы питания газовых разрядов
Глава 4. Оптика спектральных аппаратов
4.3. Оптическая схема спектрального аппарата
4.4. Основные характеристики и параметры спектральных аппаратов
3. Увеличение спектрального аппарата
4.5. Типы приборов спектрального анализа
Оптическая схема стилоскопа сл-13
Оптическая схема стилоскопа слу
6.1. Подготовка изделий и стандартных электродов к анализу
Группы аналитических спектральных линий с условными обозначениями
Линия "v4" надежно выявляется при концентрации V свыше 0,1%
6.3. Меры безопасности при работе со стилоскопом
6.4. Организация и оформление работ по спектральному анализу
Сварной стык; задвижка;тройник;расходомерная шайба; 65-77 - сварные стыки
Атомные спектры элементов состоят из отдельных линий (линейчатый спектр). Наличие линейчатого спектра означает, что вещество излучает свет только вполне определенных длин волн (точнее, в определенных очень узких спектральных интервалах). Каждая линия имеет конечную ширину. Линейчатые спектры дают все вещества в газообразном атомарном (но не молекулярном) состоянии. В этом случае свет излучают атомы, которые практически не взаимодействуют друг с другом. Это самый фундаментальный, основной тип спектров. Изолированные атомы излучают строго определенные длины волн. Обычно для наблюдения линейчатых спектров используют свечение паров вещества в пламени или свечение газового разряда в трубке, наполненной исследуемым газом.
При увеличении плотности атомарного газа отдельные спектральные линии расширяются, и, наконец, при очень большом сжатии газа, когда взаимодействие атомов становится существенным, эти линии перекрывают друг друга, образуя непрерывный спектр.
Непрерывные (или сплошные) спектры, как показывает опыт, дают тела, находящиеся в твердом или жидком состоянии, а также сильно сжатые газы. Для получения непрерывного спектра нужно нагреть тело до высокой температуры.
Характер непрерывного спектра и сам факт его существования определяются не только свойствами отдельных излучающих атомов, но и в сильной степени зависят от взаимодействия атомов друг с другом.
Непрерывный спектр дает также высокотемпературная плазма. Электромагнитные волны излучаются плазмой в основном при столкновении электронов с ионами.
Полосатые спектры. Полосатый спектр состоит из отдельных полос, разделенных темными промежутками. С помощью очень хорошего спектрального аппарата можно обнаружить, что каждая полоса представляет собой совокупность большого числа очень тесно расположенных линий. В отличие от линейчатых спектров полосатые спектры создаются не атомами, а молекулами, не связанными или слабо связанными друг с другом. Для наблюдения молекулярных спектров так же, как и для наблюдения линейчатых спектров, обычно используют свечение паров в пламени или свечение газового разряда.
Свет, разложенный в спектр, можно рассматривать визуально, зарегистрировать с помощью фотографии или фотоэлектрическими приборами. Конструкция спектрального аппарата зависит от способа регистрации спектра.
Для разложения света на спектр можно пропустить его через оптический клин или призму, как это впервые сделал Ньютон (рис. 1).
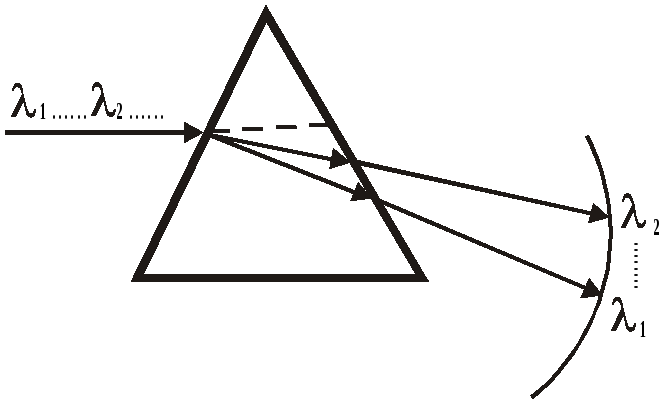
Рис. 1. Разложение света в спектр при помощи призмы
Для визуального наблюдения спектра используются приборы:
Спектроскопы – спектр наблюдается визуально (стилоскопы, стилометры);
Спектрографы – спектр фотографируется на фотопленку.
Монохроматоры - выделяется свет одной длины волны и его интенсивность может быть зарегистрирована с помощью фотоэлемента или другого электрического приемника света.
При качественном анализе необходимо определить, к излучению какого элемента относится та или иная линия в спектре анализируемой пробы. Для этого нужно найти длину волны линии по ее положению в спектре, а затем с помощью таблиц определить ее принадлежность тому или иному элементу. Для рассмотрения увеличенного изображения спектра на фотографической пластинке и определения длины волны служат измерительные микроскопы, спектропроекторы и другие вспомогательные приборы.
Интенсивность спектральных линий растет с увеличением концентрации элемента в пробе. Для проведения количественного анализа нужно найти интенсивность одной спектральной линии определяемого элемента. Интенсивность линии измеряют или по ее почернению на фотографии спектра (спектрограмме) или сразу по величине светового потока, выходящего из спектрального аппарата. Величину почернения линий на спектрограмме определяют на микрофотометрах.
Связь между интенсивностью линий в спектре и концентрацией элемента устанавливают с помощью эталонов – образцов, подобных анализируемым, с точно известным химическим составом. Эту связь обычно выражают в виде градуировочных графиков.
При проведении абсорбционного анализа источником света служит нагретое твердое тело или другой источник сплошного излучения. Анализируемую пробу помещают между источником света и спектральным аппаратом. Спектр, характеризующий вещество, составляют те длины волн, интенсивность которых уменьшилась. Спектры поглощения получают с помощью спектральных аппаратов – спектрофотометров, в состав которых входят источник сплошного света, монохроматор и регистрирующее устройство. В остальном схемы проведении абсорбционного и эмиссионного анализа совпадают.
Таким образом спектральный анализ по спектрам испускания или поглощения включает:
Получение спектра анализируемой пробы;
Определение длины волны спектральных линий или полос (после этого с помощью таблиц или атласов устанавливают их принадлежность к определенным элементам или соединениям, т.е. находят качественный состав пробы);
Измерение интенсивности спектральных линий или полос, принадлежащих определенным элементам или соединениям, что позволяет найти их концентрацию в анализируемой пробе по предварительно построенным с помощью эталонов градуировочным графикам, т.е., найти количественный состав пробы.
С помощью спектрального анализа можно определять как атомный, так и молекулярный состав вещества. Спектральный анализ позволяет проводить качественное открытие отдельных компонентов анализируемой пробы и количественное определение их концентраций.
Вещества с очень близкими химическими свойствами, которые трудно или даже невозможно анализировать химическими методами, легко определяются спектрально. Например, относительно просто выполняется анализ смеси редкоземельных элементов или смеси инертных газов. С помощью спектрального анализа можно определять изомерные органические соединения с очень близкими химическими свойствами.
Методы атомного спектрального анализа, качественного и количественного, в настоящее время разработаны значительно лучше, чем молекулярного, и имеют более широкое практическое применение. Атомный спектральный анализ используют для анализа самых разнообразных объектов. Область его применения очень широка: черная и цветная металлургия, машиностроение, геология, химия, биология, астрофизика и многие другие отрасли науки и промышленности.
Область использования молекулярной спектроскопии в основном охватывает анализ органических веществ, хотя применима и для анализа неорганических соединений. Молекулярный спектральный анализ внедряется, главным образом, в химической, нефтеперерабатывающей и химико-фармацевтической промышленности.
Чувствительность спектрального анализа высока. Минимальная концентрация определяемого вещества, которая может быть обнаружена спектральными методами, колеблется в широких пределах в зависимости от свойств этого вещества и состава анализируемой пробы. Прямым анализом при определении большинства металлов и ряда других элементов легко достигается чувствительность 10-3 – 10-4% или даже 10-5 – 10-6%. В особо неблагоприятных случаях чувствительность уменьшается до 10-1 – 10-2%. Применение предварительно отделения примесей от основы пробы позволяет сильно (часто в тысячи раз) повысить чувствительность анализа.
Благодаря высокой чувствительности атомный спектральный анализ широко применяется для анализа чистых и особо чистых металлов, в геохимии и почвоведении для определения микроконцентраций различных элементов, в том числе редких и рассеянных, в промышленности атомных и полупроводниковых материалов.
Чувствительность молекулярного спектрального анализа для различных веществ изменяется в еще больших пределах. В ряде случаев с трудом удается определять вещества, содержание которых в анализируемом образце составляет проценты и десятые доли процента, но можно привести примеры и очень высокой чувствительности молекулярного анализа 10-7 – 10-8%.
Точность атомного спектрального анализа зависит, главным образом, от состава и структуры анализируемых объектов. При анализе образцов, близких по своей структуре и составу, можно достигнуть погрешности 1 – 3% по отношению к определяемой величине. В металлургии и машиностроении спектральный анализ стал в настоящее время основным методом неразрушающего контроля. Значительно ниже точность анализа веществ, состав и структура которых сильно меняется от пробы к пробе, но в последнее время и в этой области положение заметно улучшилось. Стал возможным количественный спектральный анализ руд, минералов, горных пород, шлаков и тому подобных объектов. Количественный анализ неметаллических проб сейчас широко применяется во многих отраслях промышленности: в металлургии, геологии, при производстве огнеупоров, стекол и других видов продукции. Относительная ошибка определения при атомном спектральном анализе мало зависит от концентрации. Она остается почти постоянной как при анализе малых примесей и добавок, так и при определении основных компонентов образца. Точность химических методов анализа существенно снижается при переходе к определению примесей. Поэтому атомный спектральный анализ точнее химического в области малых концентраций. При средних концентрациях (0,1 – 1%) определяемых веществ точность обоих методов примерно одинакова, но в области высоких концентраций точность химического анализа, как правило, выше. Молекулярный спектральный анализ дает обычно более высокую точность определения, чем атомный, и не уступает в точности химическому даже при больших концентрациях.
2.1. Общее представление о строении вещества
Анализ физических и химических явлений в свое время убедил ученых, что все тела состоят из мельчайших частиц – молекул, которые находятся в непрестанном хаотическом тепловом движении. Свойства веществ в целом и зависимость свойств вещества от движения молекул рассматриваются в молекулярной теории вещества. Нас же интересуют не молекулы, а составляющие их части – атомы. Физика занимается этим вопросом с ХVIII века. Сейчас существуют такие понятия:
Масса атомов и молекул измеряется в специальных единицах: за единицу массы принята масса 1/12 массы атома изотопа атома углерода С12. Эта единица так и называется – единица массы (1е). Международная единица – 1 u.e. (условная единица массы, т.е. это есть масса атома изотопа атома углерода С12). Часто в физике измеряют массу атомов и молекул в единицах 1/16 атомного веса массы самого легкого и распространенного изотопа О16 (Это 1 а.е.м). Единица измерения по углеродной шкале связана с единицей измерения по кислородной шкале 1е=1,000318 а.е.м., 1а.е.м.=1,66010-27кг=1,6610-24г.
Молекулярный вес – вес всех атомов, входящих в молекулу (например Н2О – 18=2+16)
Грамм-молекула – это вес в граммах 61023 молекул вещества. Количество молекул в 1 грамм-молекуле одинаково для всех веществ и равно числу Авогадро N=61023 1/моль. Если известен молекулярный вес вещества и число молекул в грамм-молекуле (число Авогадро), то легко определить массу молекулы в граммах. Например: Молекулярный вес воды Н2О равен 18. Это значит, что грамм-молекула воды имеет массу 18г. Следовательно, масса 1 молекулы воды в граммах будет равна
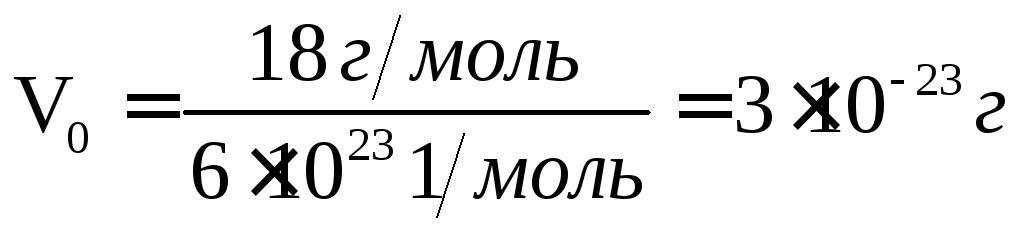 .
.Плотность вещества – масса единицы объема вещества. Если известна плотность вещества в твердом или жидком состоянии, то можно найти средние размеры молекул, считая, что они расположены вплотную друг к другу.
Вода:
=1г/см3,
вес 1 грамм-молекулы=18 г/моль, т.е. одна
грамм молекула воды занимает 18 см3/моль.
Количество молекул в ней - 61023
1/моль. Следовательно, одна молекула
занимает объем
![]() .
Если молекулу считать кубиком, то он
будет иметь размер грани
.
Если молекулу считать кубиком, то он
будет иметь размер грани![]() .
Эту величину можно считать примерным
размером молекулы воды.
.
Эту величину можно считать примерным
размером молекулы воды.