ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.07.2024
Просмотров: 384
Скачиваний: 0
СОДЕРЖАНИЕ
Федеральное агентство по образованию
Глава 1. Металлические материалы 7
Глава 1. Металлические материалы
1.1. Основные сведения о производстве металлов и сплавов
1.2. Основные свойства металлов и сплавов
1.3. Механические свойства металлов и сплавов
Глава 2. Физические основы Спектрального анализа
2.1. Общее представление о строении вещества
2.2. Строение атома и атомные спектры
3.1. Возбуждение вещества и интенсивность спектральных линий
3.3. Схемы питания газовых разрядов
Глава 4. Оптика спектральных аппаратов
4.3. Оптическая схема спектрального аппарата
4.4. Основные характеристики и параметры спектральных аппаратов
3. Увеличение спектрального аппарата
4.5. Типы приборов спектрального анализа
Оптическая схема стилоскопа сл-13
Оптическая схема стилоскопа слу
6.1. Подготовка изделий и стандартных электродов к анализу
Группы аналитических спектральных линий с условными обозначениями
Линия "v4" надежно выявляется при концентрации V свыше 0,1%
6.3. Меры безопасности при работе со стилоскопом
6.4. Организация и оформление работ по спектральному анализу
Сварной стык; задвижка;тройник;расходомерная шайба; 65-77 - сварные стыки
Размеры молекул, как правило, увеличиваются с увеличением молекул веса. Молекулы органических соединений (особенно биологических веществ), содержащие много атомов могут иметь размеры в десятки и сотни раз большие размеры. Можно также отметить, что при нормальных условиях плотность газов примерно в 1000 раз меньше соответствующих им жидкостей (пар – вода) или твердых тел.
Таким образом, если в твердых и жидких телах молекулы расположены вплотную друг к другу, то в газах среднее расстояние между молекулами увеличивается примерно в 10 раз, т.е. расстояние между молекулами в 10 раз больше самих молекул.
Молекулы – это сложные соединения, состоящие из более мелких частиц – раньше их называли атомами, т.е. неделимыми частицами. Атомы являются составными частями молекул.
Совокупность атомов, имеющих одни и те же химические свойства, называются химическим элементом. В настоящее время известно 104 химических элемента. Из них 88 встречаются в природе, а 16 получены искусственным путем. Другая определяющая характеристика, описывающая свойства элементов – это порядковый номер Z в таблице Менделеева.
Более точно измерение массы атомов производится по отклонению пучка ионизированных атомов в электрическом или магнитном полях.
Совокупность атомов некоторого химического элемента, имеющих одну и ту же массу, называются изотопом этого элемента («изотоп» - имеющий одно и то же место в таблице Менделеева).
Ближайшее к массе атома целое число называют массовым числом и обозначают буквой А.
Несмотря на большое различие между атомными весами элементов в начале и в конце таблицы Менделеева, размеры их мало отличаются друг от друга. Размеры атомов можно определить зная атомный вес и плотность вещества.
Атом
урана:
=19г/см3,
А=238, размер атома 4,310-8см,
![]()
Атом
натрия:
=0,97г/см3,
А=23, размер атома 6,310-8см,
![]()
При нагревании все вещества светятся. Это свечение можно разложить в спектр. При этом каждый атом дает свой спектр. Согласно теории Максвелла свет представляет собой электромагнитные волны. Каждому цвету соответствует своя длина волны или частота. Излучение атомных спектров показало, что свет излучается при колебаниях заряженных частиц в атоме – электронов. Заряд электрона е=4,810-10ед CGSE, масса mе=9,110-28г.
Дальнейшие опыты показали, что атом состоит из ядра, размеры которого составляют 10-13 - 10-12см и электронов, движущихся по замкнутым траекториям в области пространства, имеющем размеры порядка 10-8см. Недостаток такой планетарной модели состоит в том, что движущийся по круговой или эллиптической орбите электрон должен непрерывно излучать. Следовательно, его энергия должна уменьшаться непрерывно и он через некоторое время должен упасть на ядро. Т.е. спектр должен быть непрерывным и атом должен быстро закончить свое существование. На самом деле атомы существуют сколь угодно длительное время, а спектры атомов являются линейчатыми. Эти противоречия устраняются квантовой механикой атома.
2.2. Строение атома и атомные спектры
Все современное учение о спектрах электромагнитного излучения базируется на квантовой теории, согласно которой атомная система является устойчивой лишь в определенных стационарных состояниях, соответствующих некоторой дискретной или непрерывной последовательности значений энергии (Е).
Устойчивость атома в каждом конкретном энергетическом состоянии обосновывается волновой механикой.
При
рассмотрении с корпускулярной точки
зрения движение электрона выглядит как
движение "шарика" массой
![]() по круговой орбите радиусаr.
Так как
по круговой орбите радиусаr.
Так как
Сложное движение электрона можно представить как сумму трех простых: вращение электрона вокруг ядра по орбите, вращение плоскости орбиты и вращение электрона вокруг своей оси. Каждое из этих трех вращательных движений характеризуется собственным квантовым числом. Внутренняя энергия атома зависит от всех трех движений, поэтому каждый уровень определяется тремя квантовыми числами.
Вращение электрона по орбите определяется главным квантовым числом n, который может принимать значения 1, 2, 3… При n=1 на орбите укладывается одна волна поэтому ее длина минимальна и, следовательно, минимально расстояние этой орбиты от ядра. С увеличением n расстояние до орбиты увеличивается. Однако разность энергии между соседними уровнями все время уменьшается , так как сила притяжения электрона к ядру с ростом расстояния между ними быстро ослабевает. Электроны с одним и тем же квантовым числом n находятся примерно на одинаковом расстоянии от ядра и образуют электронную оболочку. Оболочки обозначаются латинскими буквами.
1 оболочка (n=1) – К-оболочка;
2 оболочка (n=2) – L-оболочка;
3 оболочка (n=3) – M-оболочка;
4 оболочка (n=4) – N-оболочка;
5 оболочка (n=5) – O-оболочка;
6 оболочка (n=6) – P-оболочка.
Чем ближе оболочка, тем больше энергия связи электрона с ядром. Для n-й оболочки энергия
![]() (3)
(3)
а ее радиус равен
![]() (4)
(4)
Форма
орбиты и характер ее движения определяется
орбитальным
квантовым числом l,
которое может принимать значения от 0
до n-1при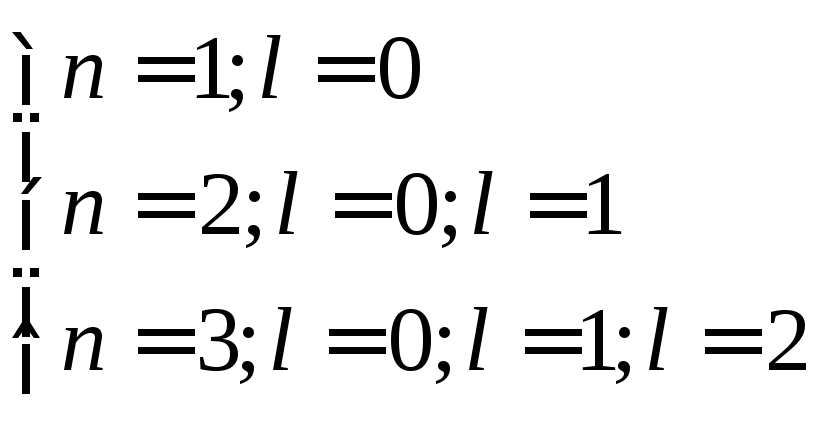 и т.д.
и т.д.
Энергии электронов с разными значениями l немного различаются. Следовательно, каждая оболочка разделяется на подуровни, каждый подуровень также обозначается латинскими буквами.
l=0 – s-подуровень;
l=1 –p-подуровень;
l=2 – d-подуровень;
l=3 – f-подуровень и т.д.
Так например уровень с n=3 и l=1 имеет обозначение 3р.
Система уровней атома имеет вид, представленный на рис. 2. Уровни с разными значениями орбитального квантового числа l для удобства несколько сдвигают на схеме.
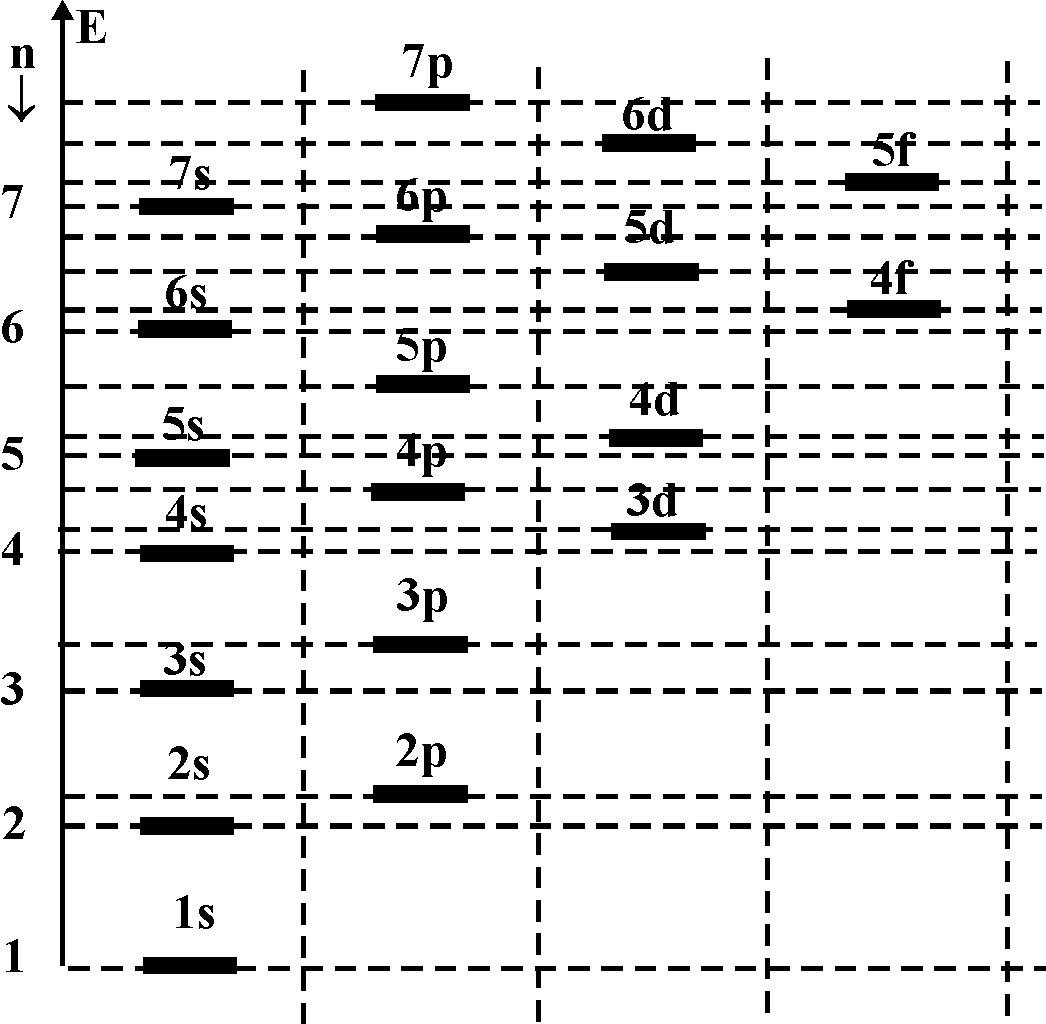
Рис. 2. Система уровней атома
Более глубокими являются те линии, для которых сумма n+l имеет наименьшее значение. Если для двух уровней эти суммы равны, то более глубоким является уровень с меньшим значением главного квантового числа n.
Пример: 4s(n+l=4+0=4) – ниже, чем
3d(n+l=3+2=5) – ниже, чем
4р(n+l=4+1=5) – выше чем 3d, т.к. n=3.
Вращение
электрона вокруг своей оси называется
спином.
Возможны всего два направления вращения:
совпадающее с направлением вращения
электрона по орбите и противоположное.
Каждое из этих состояний описывается
спиновым
квантовым числом s,
которое может принимать только два
значения
![]() и
и![]() .
Разность энергий для этих состояний
составляет один квант. Следовательно,
каждый уровеньnl
расщепляется на два мало отличающихся
уровня с разными спинами.
.
Разность энергий для этих состояний
составляет один квант. Следовательно,
каждый уровеньnl
расщепляется на два мало отличающихся
уровня с разными спинами.
Три квантовых числа n, l, s определяют энергию любого уровня. При движении электрона по орбите создается собственное магнитное поле электрона, которое зависит от формы и движения орбиты, т.е. от орбитального числа l. Следовательно, если атом поместить в сильное магнитное поле, то оно будет взаимодействовать с магнитным полем электрона и изменять его энергию.
Магнитное поле атома может иметь только определенные направления относительно внешнего поля. Каждому положению соответствует свое магнитное квантовое число m, которое может изменяться от +l до –l. Так при l=2, m=+2;+1;0;-1;-2. При отсутствии внешнего поля, расщепления l подуровней не происходит.
При заполнении электронных слоев выполняется принцип Паули, согласно которому в атоме не может быть 2-х электронов с одинаковым значением всех квантовых чисел. Из этого следует, что на каждой орбитали, характеризующейся определенными значениями главного (n), орбитального (l) и магнитного (m) квантовых чисел, может находиться не более 2-х электронов, спины которых имеют противоположные знаки.
Рассмотрим несколько примеров.
Атом
водорода:
z=1.
Следовательно всего 1 электрон, n=1
– первая (К-оболочка). Для нее орбитальное
квантовое число имеет только одно
значение l=0,
т.е. расщепления К-оболочки не происходит,
m=0
– тоже расщепления нет. Спиновое
квантовое число s
всегда имеет два значения
![]() и
и![]() .
Следовательно, на К-оболочке могут
находиться 2 электрона с разными спинами.
Следовательно, единственный электрон
будет находиться на К-оболочке.
.
Следовательно, на К-оболочке могут
находиться 2 электрона с разными спинами.
Следовательно, единственный электрон
будет находиться на К-оболочке.
Для всех других атомов на К-оболочке может находиться не более двух электронов. Распределение электронов в атоме алюминия показано на рис. 3.
Атом алюминия: z=13
К-оболочка – 2 электрона
L-оболочка – 8 электронов
n=2
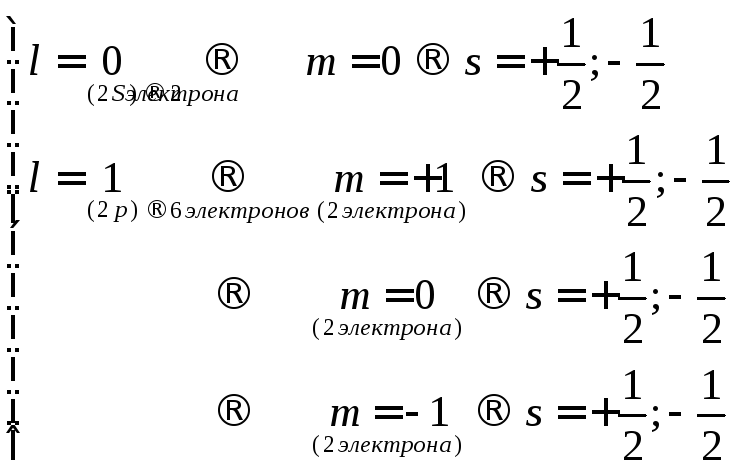
М-оболочка
n=3
 -
всего 18 электронов.
-
всего 18 электронов.
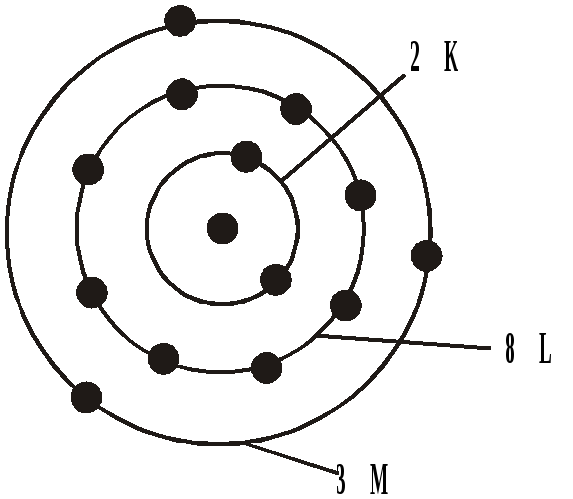
Рис. 3. Распределение электронов в атоме алюминия
Взаимодействие электронов сложных атомов между собой приводит к тому, что магнитные поля, образованные вращением отдельных электронов и их орбит, полностью компенсируют друг друга и общий магнитный момент атома (спин атома) равен нулю.
Энергия связи электрона с ядром максимальна для внутренних орбит и, следовательно, нужно затратить большую энергию для ионизации внутренних электронов. Так, например, энергия связи К-электронов в свинце равна 82кэВ. Энергии, выделяющейся в источниках света (несколько десятков кэВ) недостаточно для ионизации К-оболочки. Для этого необходимо использовать -излучение с энергией большей 82кэВ (или рентгеновское излучение от трубки с напряжением более 82кэВ).
Поэтому видимые спектры соответствуют ионизации верхних оболочек с малыми энергиями связи.
Например, при возбуждении Al можно не учитывать все электроны, кроме расположенного на уровне 3р. При возбуждении он может перейти на любой более высокий уровень. Такой электрон называют оптическим. В возбужденном состоянии атом находится в течение 10-8сек. Затем он отдает избыточную энергию и возвращается в исходное состояние, испуская квант света, энергия которого равна разности энергий уровня возбуждения и уровня 3р.