ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.07.2024
Просмотров: 405
Скачиваний: 0
СОДЕРЖАНИЕ
Федеральное агентство по образованию
Глава 1. Металлические материалы 7
Глава 1. Металлические материалы
1.1. Основные сведения о производстве металлов и сплавов
1.2. Основные свойства металлов и сплавов
1.3. Механические свойства металлов и сплавов
Глава 2. Физические основы Спектрального анализа
2.1. Общее представление о строении вещества
2.2. Строение атома и атомные спектры
3.1. Возбуждение вещества и интенсивность спектральных линий
3.3. Схемы питания газовых разрядов
Глава 4. Оптика спектральных аппаратов
4.3. Оптическая схема спектрального аппарата
4.4. Основные характеристики и параметры спектральных аппаратов
3. Увеличение спектрального аппарата
4.5. Типы приборов спектрального анализа
Оптическая схема стилоскопа сл-13
Оптическая схема стилоскопа слу
6.1. Подготовка изделий и стандартных электродов к анализу
Группы аналитических спектральных линий с условными обозначениями
Линия "v4" надежно выявляется при концентрации V свыше 0,1%
6.3. Меры безопасности при работе со стилоскопом
6.4. Организация и оформление работ по спектральному анализу
Сварной стык; задвижка;тройник;расходомерная шайба; 65-77 - сварные стыки
Полная энергия атома определяется количеством и расположением электронов в электронной оболочке. В исходном состоянии атом является устойчивым. Изменение энергии атомной системы связано со скачкообразным переходом системы из одного стационарного состояния в другое. В этом случае может происходить испускание либо поглощение кванта электромагнитной энергии. Наряду с этим существуют переходы без испускания или поглощения квантов электромагнитной энергии (безызлучательные переходы). Последние имеют место при соударениях рассматриваемой атомной системы с окружающими ее атомами, молекулами и т.п. Поскольку состояние системы обладает определенной энергией, то принято говорить об уровнях энергии и переходах между уровнями энергии (рис. 4).
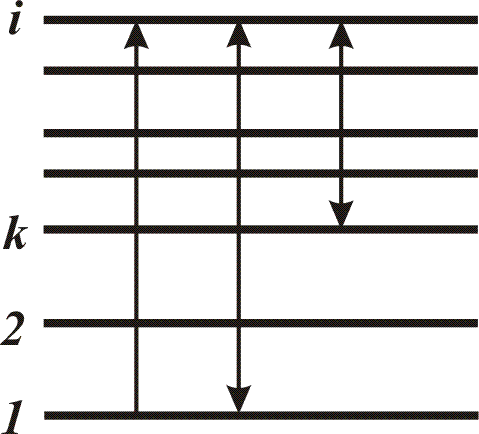
Рис. 4. Графическое изображение уровней энергии и переходов между ними
Начало отсчета выбирается произвольно; за нуль, как правило, принимается состояние с наименьшей из всех известных состояний энергией, которое называют основным, или нормальным состоянием (уровнем), а все другие – возбужденными. Переходы между уровнями энергии показывают вертикальными линиями, а стрелками – их направления. Совокупность переходов из состояний с меньшими энергиями (нижние уровни) в состояния с большими энергиями относительно начальных (верхние уровни) дает спектр поглощения, с верхних на нижние – спектр испускания. В справочных изданиях часто приводятся диаграммы уровней энергии для атомных систем с указанием для наиболее используемых на практике переходов. Переходу между дискретными уровнями энергии соответствует определенная спектральная линия, характеризуемая в спектре значением длины волны. Каждый переход характеризуется вероятностью, которая может быть определена, если рассматривать элементарные процессы изменения энергии атомных систем как мгновенные и считать, что каждый переход может произойти в любой момент времени, независимо от остальных переходов.
При возбуждении атомов переход совершает обычно один из внешних электронов. Электроны, находящиеся на внутренних заполненных уровнях, можно не рассматривать. Наименьшую энергию атом имеет, когда он не возбужден. Для перевода электрона на более высокий уровень необходимо передать атому определенную энергию, которая измеряется в эВ и называется потенциалом возбуждения. В возбужденном состоянии атом находится недолго, около 10-8сек. Он стремится отдать избыточную энергию и возвратиться в невозбужденное состояние. Переход происходит или сразу на нулевой уровень, или постепенно с одного уровня на другой, более низкий. При переходе атом излучает фотон с определенной энергией, поэтому каждая спектральная линия имеет определенный потенциал возбуждения, равный энергии ее верхнего уровня.
Рассмотрим
происхождение спектра алюминия,
представленную на рис. 5. На данном
рисунке не показаны внутренние заполненные
уровни, которые не участвуют в образовании
оптических спектров. Ближайшим
возбужденным уровнем является 4s.
Для того, чтобы перевести туда электрон,
нужна энергия в 3,1эВ. С этого уровня
электрон возвращается на нижний
расщепленный уровень 3р. Это соответствует
излучению линий с длиной волны 3944,1![]() или линии 3961,5
или линии 3961,5![]() .
Потенциал возбуждения этих линий один
и тот же, 3,1эВ, так как они имеют общий
верхний уровень. Если всем атомам
сообщить такую энергию, то в спектре
испускания появятся только эти две
линии. Все другие линии в спектре алюминия
имеют более высокие потенциалы
возбуждения. Так, например, линии с=2652,5
.
Потенциал возбуждения этих линий один
и тот же, 3,1эВ, так как они имеют общий
верхний уровень. Если всем атомам
сообщить такую энергию, то в спектре
испускания появятся только эти две
линии. Все другие линии в спектре алюминия
имеют более высокие потенциалы
возбуждения. Так, например, линии с=2652,5![]() и 2660,4
и 2660,4![]() ,
которые образуются при переходе с уровня
5s
на нулевой, имеют потенциал возбуждения
4,7эВ.
,
которые образуются при переходе с уровня
5s
на нулевой, имеют потенциал возбуждения
4,7эВ.
Наиболее легко возбуждаются линии с низким потенциалом возбуждения. Они обычно имеют наибольшую интенсивность, так как соответствующие им переходы электрона будут совершаться наиболее часто. Однако, несмотря на низкий потенциал возбуждения, некоторые линии в спектрах отсутствуют или имеют очень маленькую интенсивность. Такие линии являются запрещенными.
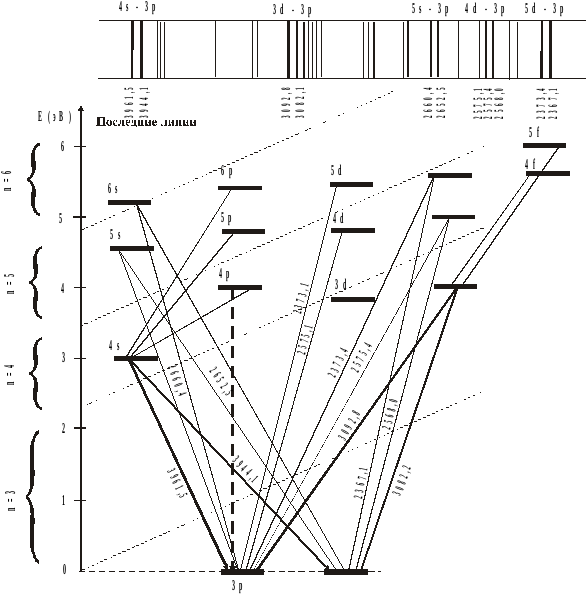 Рис.
5. Схема переходов в атоме алюминия
Рис.
5. Схема переходов в атоме алюминия
Установлены специальные правила отбора, которые позволяют найти запрещенные и разрешенные переходы электрона. Разрешенными оказываются те переходы, при которых квантовое число l меняется на единицу. Например переход с s–уровней на р, с р-уровней на s или в и т.д. Правила отбора объясняют отсутствие в спектре алюминия линии, соответствующей переходу с 4р на 3р и др.
Таким
образом, наибольшую интенсивность имеют
линии, имеющие низкий потенциал
возбуждения и соответствующие разрешенным
переходам. При уменьшении концентрации
вещества в анализируемой пробе они
исчезают из спектра после всех других
линий данного элемента. Поэтому их
называют последними.
Для алюминия последними будут четыре
линии: 3961,5![]() ,
3944,1
,
3944,1![]() (переход 4s3р),
3092,7
(переход 4s3р),
3092,7![]() и 3082,2
и 3082,2![]() (переход 3d3р).
(переход 3d3р).
Спектральные линии, которые соответствуют переходу на нулевой уровень, называют резонансными. Они появляются и в спектрах поглощения. Большинство последних линий являются резонансными.
При увеличении энергии возбужденного атома электрон переходит на более высокие уровни. Его связь с ядром ослабевает. Если сообщить атому достаточно большую энергию, то можно полностью удалить электрон. Наименьшая энергия, необходимая для ионизации невозбужденного атома, называется потенциалом ионизации и измеряется в эВ. Потенциал ионизации больше, чем потенциал возбуждения любой спектральной линии в нейтральном атоме. Величина потенциала ионизации зависит от силы притяжения электрона к ядру. В каждом периоде таблицы Д.И.Менделеева при переходе к более тяжелым элементам потенциал ионизации увеличивается, а в каждой группе уменьшается. Поэтому самый низкий потенциал ионизации – 3,9эВ у цезия, расположенного в левом нижнем углу периодической системы, а самый высокой – 24,6эВ у гелия, который находится в правом верхнем углу.
В настоящее время измерены длины волн многих спектральных линий всех доступных элементов. В таблицах обычно приводят только часть известных линий. Теоретически число линий в спектре любого элемента бесконечно велико. Однако практически возбуждается только ограниченное число линий. Число наблюдаемых линий в спектре зависит от расщепления сложных уровней на простые. При расщеплении одной линии появляется две (дуплет), три (триплет) или еще большее число линий. Чем сильнее расщепление, тем сложнее спектр.
Практически полностью отсутствует расщепление у водорода. Единственный электрон в его атоме вращается строго симметрично в электрическом поле ядра. Положение уровней зависит только от главного числа n. Даже уровни с разными значениями квантового числа l, например 3s, 3p и 3d, имеют одинаковую энергию и сливаются в один. Поэтому в спектре водорода наблюдается всего 21 линия.
В атомах других элементов электрическое поле ядра искажено движением внутренних электронов. Особенно сильно искажено поле ядра и сильно расщеплены уровни в атомах, где имеется недостроенный d- или f-уровень. Такие элементы имеют самые сложные спектры. К ним относятся металлы всех побочных подгрупп, кроме трех первых: атомы металлов первой и второй подгруппы имеют нижний s-уровень, а в атомах третьей подгруппы при возбуждении одного электрона также нет недостроенных d- и f-уровней. Все элементы главных групп периодической системы имеют достаточно простой спектр.
2.3. Природа и свойства света
При спектральном анализе о качественном и количественном составе вещества мы судим по излучению анализируемой пробы. В источнике света одновременно излучает большое количество атомов и ионов. Для того, чтобы понять природу спектра, надо рассмотреть, как излучает отдельный атом или ион. Свободные (не взаимодействующие друг с другом и с другими частицами) атомы и ионы имеют строго определенное строение и излучают определенные порции света. Для понимания природы эмиссионных спектров необходимо знать строение свободных атомов и ионов, а также «строение» самого света.
Способность света распространяться прямолинейно в однородной прозрачной среде (или в пустоте) была известна еще в древности. При построении изображения предметов в оптических приборах широко пользуются представлением о световом луче. Оно является основным в геометрической оптике.
При падении луча на границу раздела двух сред происходит отражение и преломление света. Отражение подчиняется закону: падающий и отраженный луч лежат в одной плоскости и угол падения равен углу отражения. Преломленный луч также лежит в одной плоскости с падающим, но величина угла преломления зависит от угла падения следующим образом: отношение синусов углов для данных сред является постоянной величиной, называемой показателем преломления.
![]() (5)
(5)
Физика (теоретическая и экспериментальная) однозначно определяет, что свет состоит из мельчайших частиц – корпускул (корпускулярная теория). Прямолинейное распространение света соответствует движению частиц в отсутствии внешних сил, а отражение происходит также как соударение упругих шариков с плоской поверхностью. Преломление по данной теории происходит, если предположить, что среда с большим показателем преломления притягивает корпускулы света. Различные цвета по теории объяснялись различием в величине корпускул. Данная теория была предложена Ньютоном, но впоследствии от нее отказались, так как были открыты явления, которые не возможно было объяснить с помощью корпускул.
Если два луча от одного и того же источника света встречаются в одной точке пространства, то происходит интерференция света, т.е. взаимное усиление или ослабление интенсивности лучей. При прохождении света через небольшое отверстие наблюдается его дифракция, т.е. отклонение света от первоначального направления в одной и той же среде, например в воздухе. Данные явления типичны для волновых процессов. Также была установлена связь с электрическими и магнитными явлениями. Таким образом, утвердилась волновая теория, согласно которой свет – это электромагнитные волны. Они непрерывно излучаются нагретым телом и распространяются в вакууме или в прозрачной среде. Точки пространства, до которых дошли колебания, сами становятся источниками вторичных волн. В каждой такой точке возникает электромагнитное поле, напряженность которого периодически меняется. Интенсивность светового пучка определяется амплитудой электромагнитных колебаний. Время, в течении которого происходит полный цикл изменения напряженности поля в одной точке пространства, называется периодом колебания (Т), после окончания которого весь процесс в точности повторяется в течение каждого следующего периода. Величина, обратная периоду, называется частотой ().