Файл: Методические рекомендации по суммативному оцениванию Химия 8 класс.docx
Добавлен: 26.10.2023
Просмотров: 755
Скачиваний: 34
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
(а) Способ 1
Способ 2
(b) Способ 1
Способ 2
-
Даны химические формулы солей: Mg(OH)Cl, NaNO3, KHSO4. Впишите формулы солей в соответствующие графы таблицы.
| Соли | ||
| Средние | Кислые | Основные |
| | | |
-
Запишите уравнения возможных реакций. (а) Zn + CuCl2 →
-
Ag + ZnCl2 →
-
SO3 + NaCl →
-
KOH + CuSO4 →
-
Al + Cl2 →
-
Zn (OH)2 + CuCl2 →
-
Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
хлорид железа (II) → гидроксид железа (II) → оксид железа (II)→ сульфат железа (II)
5(а) Из перечня веществ выпишите растворимые и нерастворимые в воде основания:
HNO3, Ba(OH)2, CaO, NaOH, Cu(OH)2, H2O, NaHCO3, Zn(OH)2, KOH, Al(OH)3
| Растворимые в воде основания | Нерастворимые в воде основания |
| | |
(b) Запишите уравнение реакции нейтрализации для любого из растворимых оснований (в задании 5(а))
(с) Запишите уравнение реакции разложения для любого из нерастворимых оснований (в задании 5(а))
| Критерий оценивания | № | Дескриптор | Балл |
| Обучающийся | |||
| Записывает два метода получения растворимых и нерастворимых солей и составляет уравнения реакций. | 1 | записывает первый способ получения растворимой соли; | 1 |
| записывает второй способ получения растворимой соли; | 1 | ||
| записывает первый способ получения нерастворимой соли; | 1 | ||
| записывает второй способ получения нерастворимой соли; | 1 | ||
| Классифицирует соли по составу. | 2 | выписывает формулы растворимых солей; | 1 |
| выписывает формулы нерастворимых солей; | 1 | ||
| Составляет уравнения возможных реакций, зная химические свойства солей | 3 | составляет уравнение реакции (а); | 1 |
| составляет уравнение реакции (d); | 1 | ||
| составляет уравнение реакции (e); | 1 | ||
| Записывает уравнения химических реакций, показывая связь между солями и нерастворимыми основаниями. | 4 | записывает уравнение химической реакции: хлорид железа (II) → гидроксид железа (II); | 1 |
| записывает уравнение химической реакции: гидроксид железа (II) → оксид железа (II) | 1 | ||
| записывает уравнение химической реакции: оксид железа (II)→ сульфат железа (II); | 1 | ||
| Классифицирует основания по растворимости в воде, записывает уравнения химических реакций | 5 | классифицирует основания на растворимые и нерастворимые; | 1 |
| записывает уравнение реакции нейтрализации для растворимого основания; | 1 | ||
| записывает уравнение реакции разложения для нерастворимого основания. | 1 | ||
| Всего баллов | 15 | ||














 Рубрика для предоставления информации родителям по итогам суммативного оценивания за раздел 8.4 «Основные классы неорганических соединений. Генетическая связь»
Рубрика для предоставления информации родителям по итогам суммативного оценивания за раздел 8.4 «Основные классы неорганических соединений. Генетическая связь» ФИО обучающегося _
| Критерий оценивания | Низкий | Средний | Высокий |
| Записывает два метода получения растворимых и нерастворимых солей и составляет уравнения реакций | Затрудняется записать два метода получения растворимых и нерастворимых солей, и составляет уравнения реакций | Допускает ошибки при записи первого /второго способа получения растворимой соли/ первого / второго способа получения нерастворимой соли | Записывает два метода получения растворимых и нерастворимых солей и составляет уравнения реакций. |
| Классифицирует соли по составу. | Затрудняется классифицировать соли по составу. | Допускает ошибки в классификации солей по составу. | Классифицирует соли по составу. |
| Составляет уравнения возможных реакций, зная химические свойства солей | Затрудняется составить уравнения возможных реакций | Допускает ошибки при составлении уравнения реакции (а) / (d)/ (e) | Составляет уравнения возможных реакций солей |
| Записывает уравнения химических реакций, показывая связь между солями и нерастворимыми основаниями | Затрудняется составить уравнения химических реакций, показывая связь между солями и нерастворимыми основаниями | Допускает ошибки при записи первого/ второго /третьего уравнения химической реакции | Записывает уравнения химических реакций, показывая связь между солями и нерастворимыми основаниями |
| Классифицирует основания по растворимости в воде, записывает уравнения химических реакций | Затрудняется классифицировать основания по растворимости в воде и записывать уравнения химических реакций | Допускает ошибки при классификации оснований / при записи уравнения реакции для растворимого / нерастворимого основания | Классифицирует основания по растворимости в воде, записывает уравнения химических реакций |
| Суммативное оценивание за раздел 8.4В «Углерод и его соединения» | |
| Цель обучения | 8.4.3.2 Описывать распространение углерода и его соединений в природе
8.4.3.8 Составлять и объяснять круговорот углерода в природе |
| Критерий оценивания | Обучающийся
|
| Уровень мыслительных навыков | Знание и понимание Применение |
| Время выполнения | 20 минут |
| Задания | |
| 1(а) Среди жизненно важных химических элементов – углерод один из важнейших: жизнь на нашей планете построена на углеродной основе. Объясните почему. (b) При нагревании угля в отсутствии воздуха образуется кокс и угольный газ. Кокс содержит 96,3 – 98,1% чистого углерода. Запишите одно применение кокса в промышленности. 2(a) Аллотропными видоизменениями углерода являются алмаз и графит. Объясните, почему графит является хорошей смазкой, используйте знания о структуре алмаза и графита. (b) Объясните, почему алмаз является твёрдым веществом. Запишите одно применение алмаза, основанное на его твёрдости. | |
-
Составьте уравнения реакций взаимодействия углерода с элементами (простыми веществами) и соединениями.
(а) углерод + кислород в недостатке (О2)
+→
-
углерод + кислород в избытке (О2)
+→
-
углерод + оксид меди (II) (CuO)
+→+
-
На диаграмме показана часть углеродного цикла, где представлены некоторые процессы, которые определяют процентное содержание углекислого газа в атмосфере.
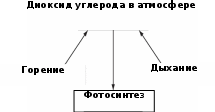
(а) Объясните термин «дыхание» и как этот процесс увеличивает процентное содержание диоксида углерода в атмосфере.
(b) В 1960 году доля диоксида углерода в атмосфере составляла 0,032%, а в 2018 год – 0,041%. Объясните причину увеличения доли диоксида углерода.
| Критерий оценивания | № задания | Дескриптор Обучающийся | Балл | |
| Описывает значение углерода и его соединений в природе. | 1 | объясняет, почему жизнь на планете построена на углеродной основе; | 1 | |
| приводит пример одного применения кокса в промышленности; | 1 | |||
| Предсказывает области применения аллотропных видоизменений углерода. | 2 | объясняет применение графита в качестве смазки; | 1 | |
| объясняет твёрдость алмаза прочностью связей в кристаллической решетке гигантской ковалентной структуры алмаза; | 1 | |||
| записывает применение алмаза для резки стекла/ производства свёрл; | 1 | |||
| Составляет сбалансированные уравнения реакций взаимодействия углерода с элементами (простыми веществами) и соединениями. | 3 | составляет уравнение реакции горения углерода в недостатке кислорода; | 1 | |
| составляет уравнение реакции горения углерода в избытке кислорода; | 1 | |||
| составляет уравнение реакции между углеродом и оксидом меди (II), доказывая восстановительные свойства углерода; | 1 | |||
| Объясняет изменение содержания углекислого газа в природе, применяя знания о круговороте углерода | 4 | объясняет термин «дыхание»; | 1 | |
| объясняет влияние процесса дыхания на увеличение процентного содержания диоксида углерода в атмосфере; | 1 | |||
| даёт объяснение причины увеличения доли диоксида углерода в атмосфере. | 1 | |||
| Всего баллов | 11 | |||








 Рубрика для предоставления информации родителям по итогам суммативного оценивания за раздел 8.4В «Углерод и его соединения»
Рубрика для предоставления информации родителям по итогам суммативного оценивания за раздел 8.4В «Углерод и его соединения» 

 ФИО обучающегося _
ФИО обучающегося _| Критерий оценивания | Низкий | Средний | Высокий |
| Описывает значение углерода и его соединений в природе. | Затрудняется описать значение углерода и его соединений в природе. | Допускает ошибки при описании значения углерода и его соединений в природе. | Описывает значение углерода и его соединений в природе. |
| Предсказывает области применения аллотропных видоизменений углерода. | Затрудняется предсказать области применения аллотропных видоизменений углерода. | Допускает ошибки в предсказании области применения аллотропных видоизменений углерода / кокса / графита / алмаза. | Предсказывает области применения аллотропных видоизменений углерода. |
| Составляет сбалансированные уравнения реакций взаимодействия углерода с элементами (простыми веществами) и соединениями. | Затрудняется составить сбалансированные уравнения реакций взаимодействия углерода с элементами (простыми веществами) и соединениями. | Допускает ошибки в составлении уравнения реакции горения углерода в недостатке кислорода/ в избытке кислорода/ между углеродом и оксидом меди (II) | Составляет сбалансированные уравнения реакций взаимодействия углерода с элементами (простыми веществами) и соединениями. |
| Объясняет изменение содержания углекислого газа в природе, применяя знания о круговороте углерода | Затрудняется объяснить изменение содержания углекислого газа в природе, применяя знания о круговороте углерода | Допускает ошибки при объяснении термина «дыхание» / влияния процесса дыхания на увеличение процентного содержания диоксида углерода в атмосфере/ причины увеличения доли диоксида углерода в атмосфере | Объясняет изменение содержания углекислого газа в природе, применяя знания о круговороте углерода |