ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 319
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
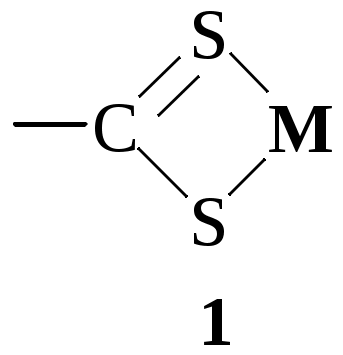
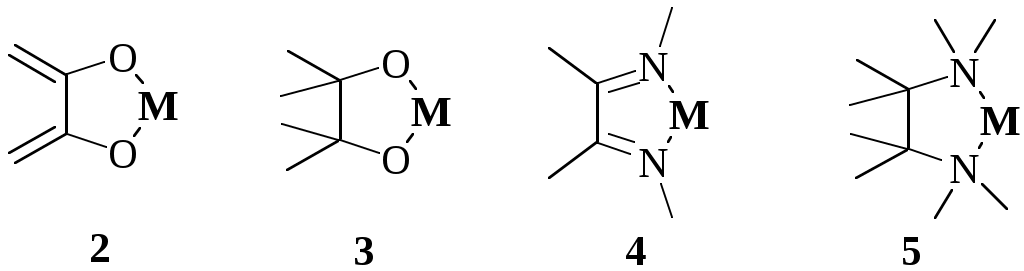
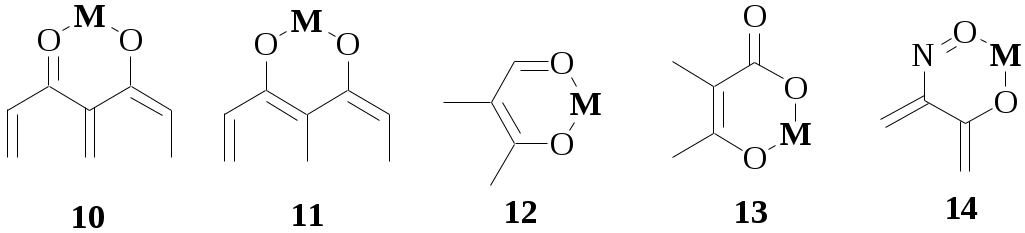
Ниже показаны некоторые из видов хелатных циклов, образующихся при взаимодействии органических реагентов с ионами металлов. Цикл (1) образуют производные дитиокарбаминовой кислоты, (2) - о-дифенолы, (3) - вещества, содержащие -диольную группировку, (4) - диоксимы, (5) - 1,2-диамины, (6) - дитизон и аналогичные соединения, (7) - 8-гидроксихинолин и его производные, (8) - аминокарбоновые кислоты, (9) - карбазиды, (10) - гидроксихиноны, (11) - хромотроповая кислота и её производные, (12) - -дикетоны, (13) - салициловая кислота и её производные, (14) - о-нитрозофенолы.
четырёхчленные циклы
пятичленные циклы
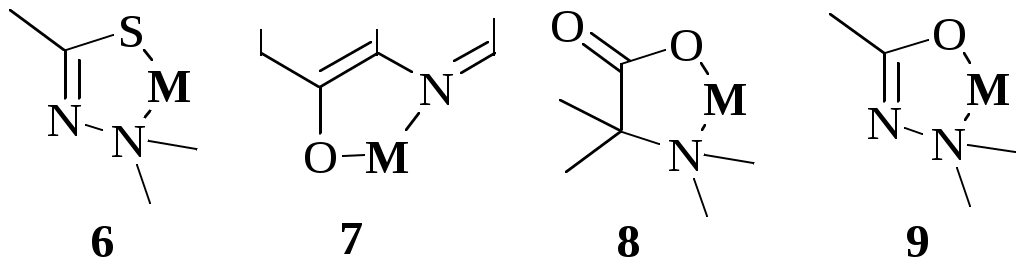
шестичленные циклы
В табл. 5.2. показаны некоторые примеры использования хелатообразующих органических реагентов в аналитической химии.
Табл. 5.2.
Некоторые примеры использования хелатообразующих
органических реагентов в аналитической химии
| Область применения | Примеры реагентов |
| реакции обнаружения и идентификации | диметилглиоксим (Ni2+), дифенилкарбазид (Hg2+) |
| маскирование | ЭДТА, тартраты, цитраты |
| экстрагенты | дитизон, 8-гидроксихинолин |
| хроматография | -дикетоны, 8-гидроксихинолин |
| осадители | 8-гидроксихинолин, диметилглиоксим |
| титранты | ЭДТА |
| индикаторы | мурексид, пирокатехиновый фиолетовый |
| фотометрия | тиомочевина, 1,10-фенантролин |
| флуориметрия | морин, 8-гидроксихинолин |
| компоненты ионоселективных электродов | краун-эфиры |
К химико-аналитическим свойствам органические реагентов в зависимости от целей их использования предъявляются различные требования. Например
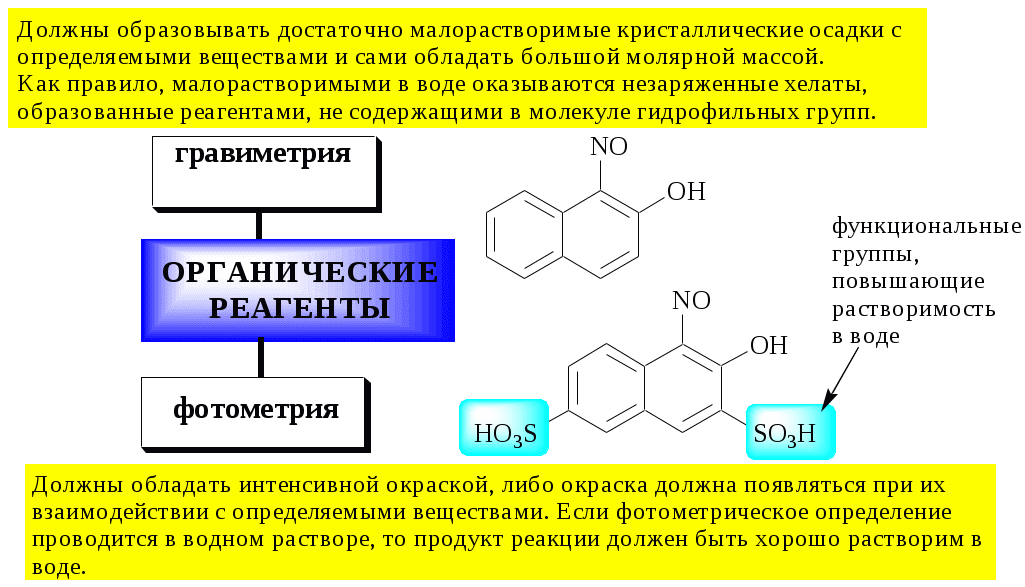
Применение органических реагентов в аналитической химии не ограничивается реакциями комплексообразования. Некоторые реагенты образуют с определяемыми ионами простые соли, например
K+ + [(C6H5)4B]- K[(C6H5)4B]
тетрафенилборат
Известны органические реагенты, принимающие участие в окислительно-восстановительных реакциях, например, дифениламин, дифенилкарбазид, аскорбиновая кислота. Такие реагенты используются в качественном анализе, для маскирования мешающих ионов, как окислительно-восстановительные индикаторы и др. Иногда при взаимодействии органического реагента с определяемыми ионами образуются новые органические вещества с характерными химико-аналитическими свойствами, например
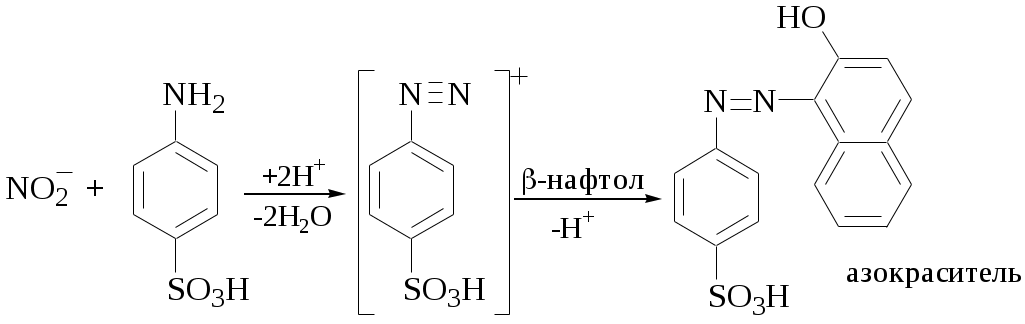
Некоторые органические реагенты участвуют в каталитических реакциях. Например, при окислении люминола (гидразида 3-аминофталевой кислоты) пероксидом водорода при рН> 8,5 возникает хемилюминесценция. Этот процесс катализируется микроколичествами некоторых металлов, например, Cu2+. Люминол используется для хемилюминесцентного определения катионов металлов.
ГЛАВА 6
6.1. Произведение растворимости малорастворимого электролита
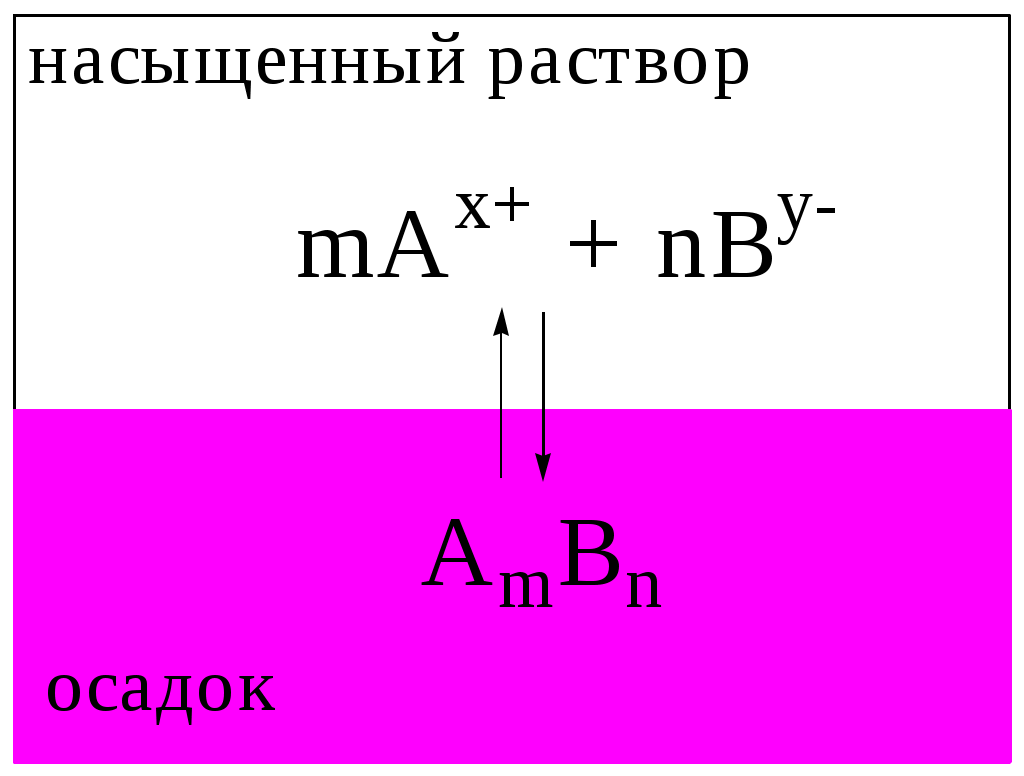
Рис. 6.1. Равновесие в системе «осадок - насыщенный раствор малорастворимого сильного электролита»
Рассмотрим гетерогенную систему, состоящую из малорастворимого соединения AmBn, находящегося в осадке, и насыщенного раствора этого вещества (рис. 6.1). Будем считать, что AmBn имеет ионную кристаллическую решётку, является сильным электролитом и переходит в раствор только в виде сольватированных ионов Ax+ и By-:
AmBn mAx+ + nBy
Как и любое равновесие данный процесс можно описать константой химического равновесия
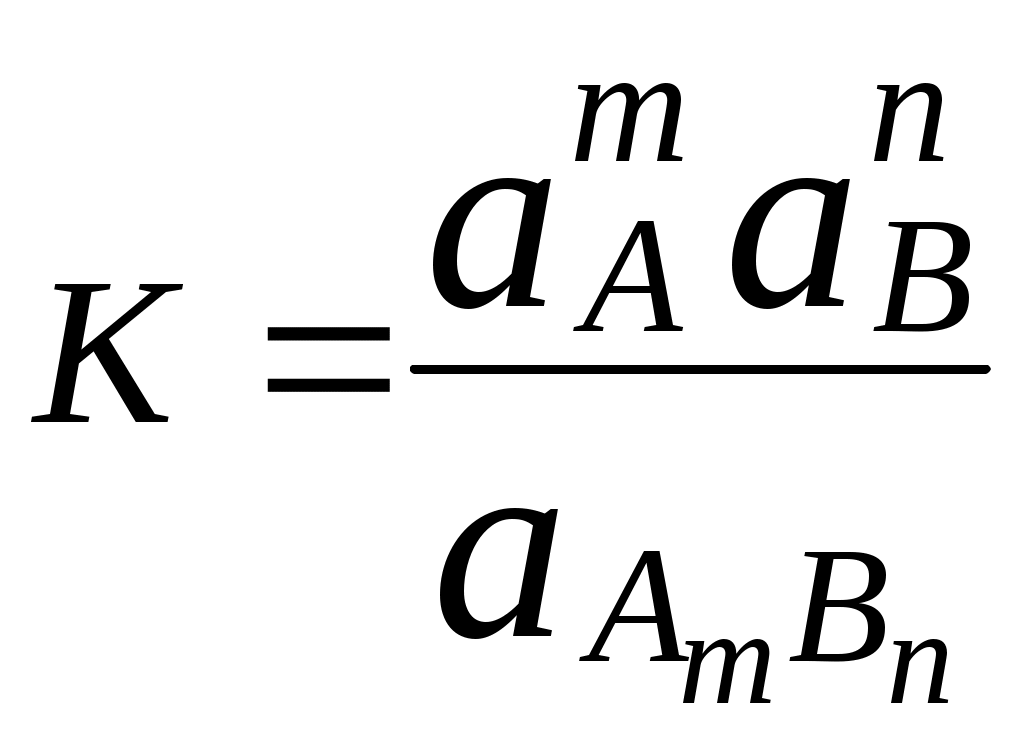
Активность осадка равна 1, поэтому
При постоянной температуре произведение активностей ионов малорастворимого электролита (в степенях равных соответствующим стехиометрическим коэффициентам) в насыщенном растворе есть для данного растворителя величина постоянная и называется термодинамическим произведением растворимости.
Термодинамическое произведение растворимости подходит для описания идеальных систем либо систем близких к идеальным (нулевая или очень малая ионная сила, отсутствие побочных реакций). На практике чаще используют концентрационное произведение растворимости, которое может быть реальным или условным. Реальное концентрационное произведение растворимости (KS) выражается через равновесные концентрации ионов, образующихся при растворении осадка
Условным концентрационным произведением растворимости (
Условное произведение растворимости удобно использовать в тех случаях, когда ионы, образовавшиеся при растворении малорастворимого электролита, вступают в побочные реакции (протолитические реакции, образование комплексных соединений и т.д.).
Различные виды произведения растворимости связаны между собой следующим образом
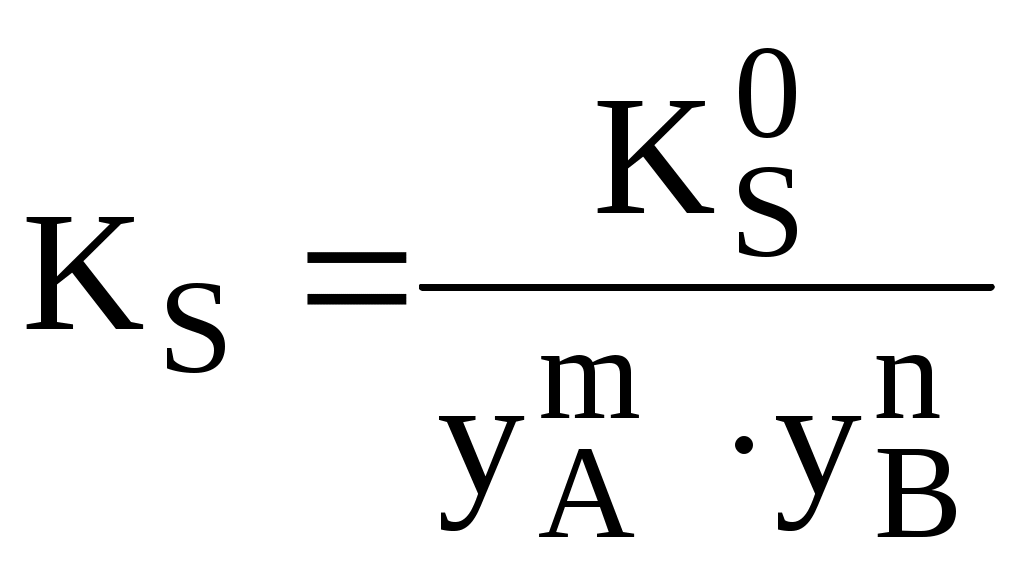
По величине произведения растворимости, как и по величине любой константы равновесия, можно определить, достигла система состояния равновесия или нет.

Пример 6.1. Определить, выпадет ли осадок иодата бария при смешивании 10 мл 1,010-3 М BaCl2 и 10 мл 2,010-3 М KIO3, если
В конечном растворе: С(Ba2+) = 5,010-4 моль/л,
5,010-4 (1,010-3)2 = 5,010-10 <
Осадок иодата бария в данных условиях не образуется.
6.2. Растворимость
Растворимостью называют общую концентрацию вещества в его насыщенном растворе при данной температуре.

Рассмотрим вначале случай, когда малорастворимый электролит присутствует в насыщенном растворе только в виде ионов, образовавшихся при его диссоциации. Обозначим молярную концентрацию малорастворимого электролита в его насыщенном растворе S (моль/л), тогда [A] = mS, [B] = nS.
Для бинарного электролита
Пример 6.2. Рассчитать растворимость (моль/л) Ba(IO3)2 в воде при 25 С.
Иодат бария является сильным электролитом и переходит в раствор только в виде ионов.
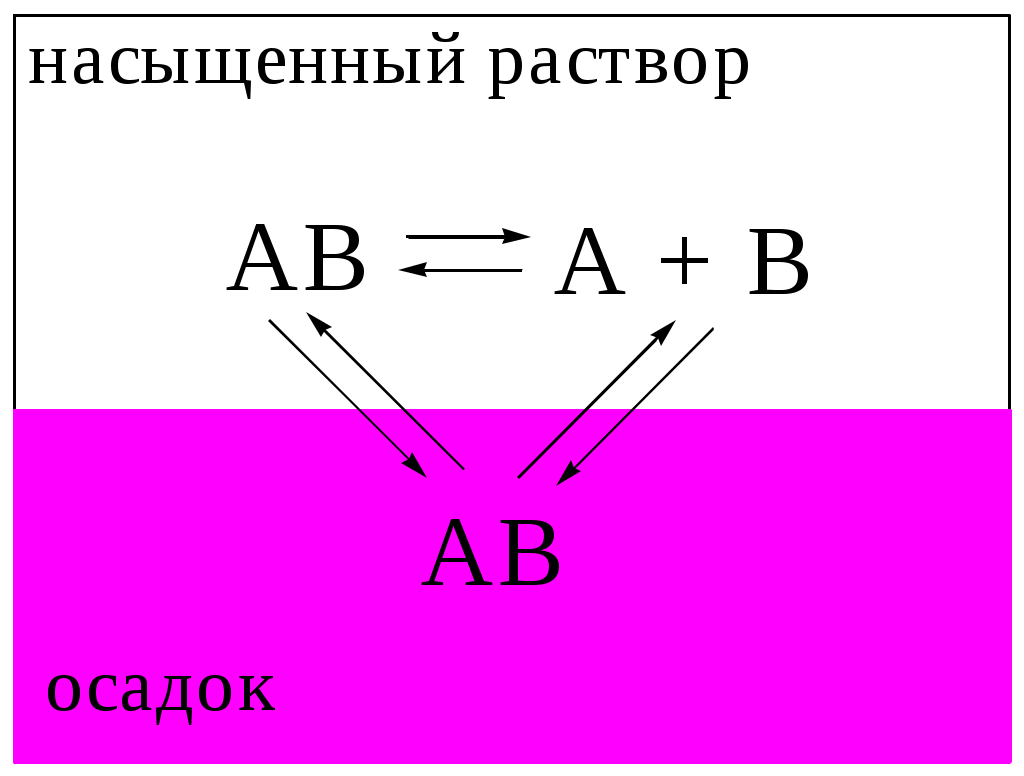
Рис. 6.2. Равновесия в системе «осадок малорастворимого слабого электролита - насыщенный раствор»
Многие из малорастворимых электролитов могут находиться в растворе не только в виде ионов, но и в виде молекул (рис. 6.2). Концентрация молекул вещества в его насыщенном растворе называется молекулярной растворимостью(S0). Растворимость таких веществ равна сумме ионной и молекулярной растворимости
Sобщ = [A] + [AB]
Рассмотрим случай, когда вещество может находиться в растворе в виде незаряженного комплекса.
Например, для AgSCN KS = 1,110-12, = 5,6104
Формулу для расчёта S0 слабых кислот можно получить из выражения константы кислотности
Например, для бензойной кислоты KS = 1,410-6, Ka = 6,310-5.
6.3. Влияние различных факторов на растворимость
Природа растворяемого вещества и растворителя
В настоящее время не существует точных правил или каких-то количественных закономерностей, позволяющих предсказать растворимость любого соединения в любом растворителе или хотя бы объяснить возможные случаи растворимости. Поэтому зависимость между химическим строением соединения и его растворимостью в различных растворителях приходится описывать с помощью эмпирических правил, которые обычно носят статистический характер (например, “подобное растворяется в подобном”). На растворимость влияют такие факторы как способность вещества к сольватации данным растворителем, способность растворённого вещества изменять структуру растворителя, кристаллическая модификация осадка, размер частиц осадка и т.д.