ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 322
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
В аналитической химии используются

Для равновесия aA + bB cC + dD
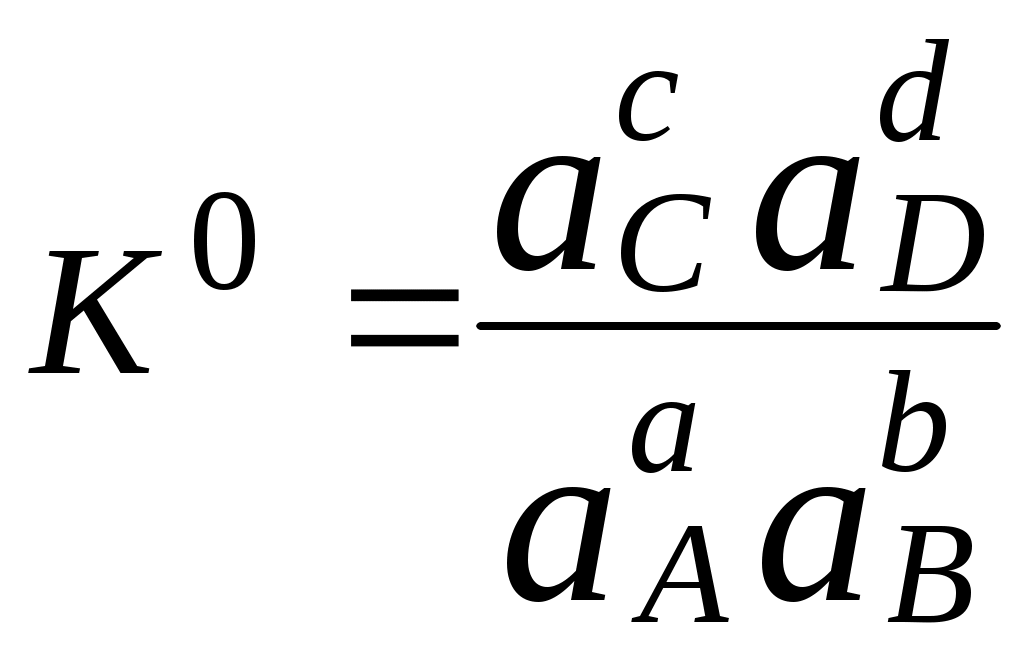
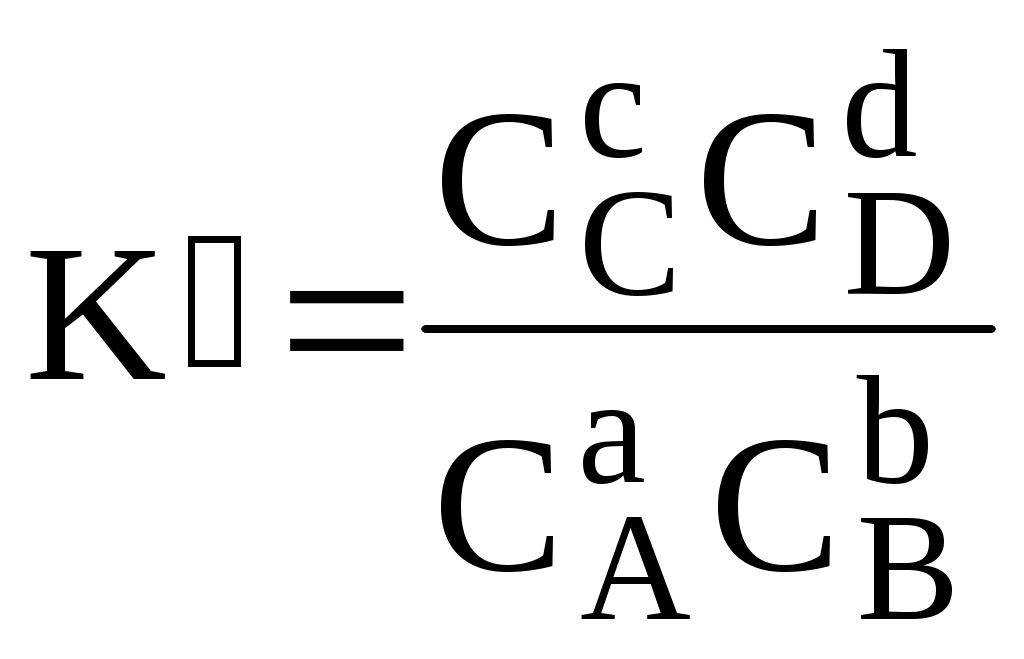
Подравновесной концентрацией (обозначают - [ ]) понимают концентрацию определённой формы вещества, участвующего в равновесии. Сумма равновесных концентраций всех форм существования данного вещества называется его общей концентрацией (С), например, для аммиака -
Отношение равновесной концентрации определённой формы вещества к общей концентрации этого вещества называется молярной долей данной формы вещества, например:
Различные виды констант равновесия связаны между собой следующим образом:
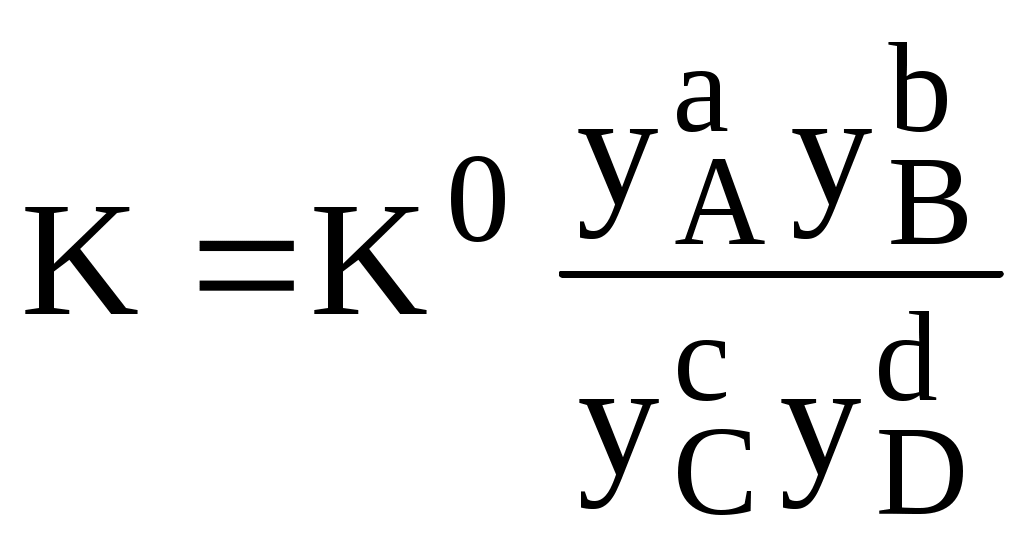
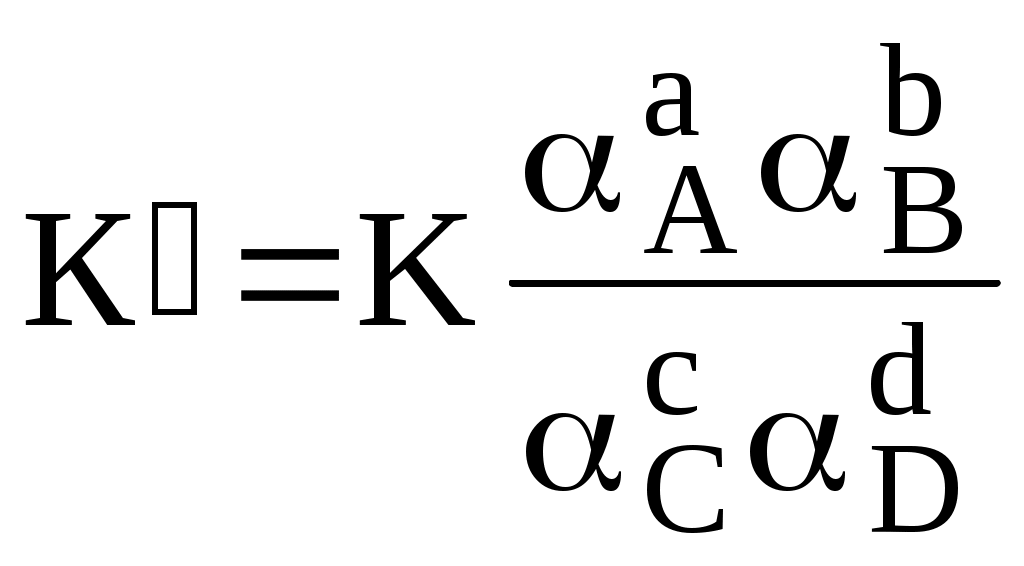
Для удобства многие константы равновесия разных типов имеют свои обозначения, например, Ka - константа кислотности, KSH - константа автопротолиза растворителя, KS - произведение растворимости.
Некоторые из равновесий, используемые в аналитической химии (протолитические равновесия с участием многоосновных кислот и многокислотных оснований, процессы комплексообразования), протекают ступенчато. Константы равновесия, характеризующие каждую ступень, называются ступенчатыми. Произведение ступенчатых констант называется общей константой равновесия. Общая константа не описывает реально существующего равновесия, но более удобна для расчётов. Например:
1 ступень Ag+ + NH3
[Ag(NH3)]+
2 ступень [Ag(NH3)]+ + NH3 [Ag(NH3)2]+
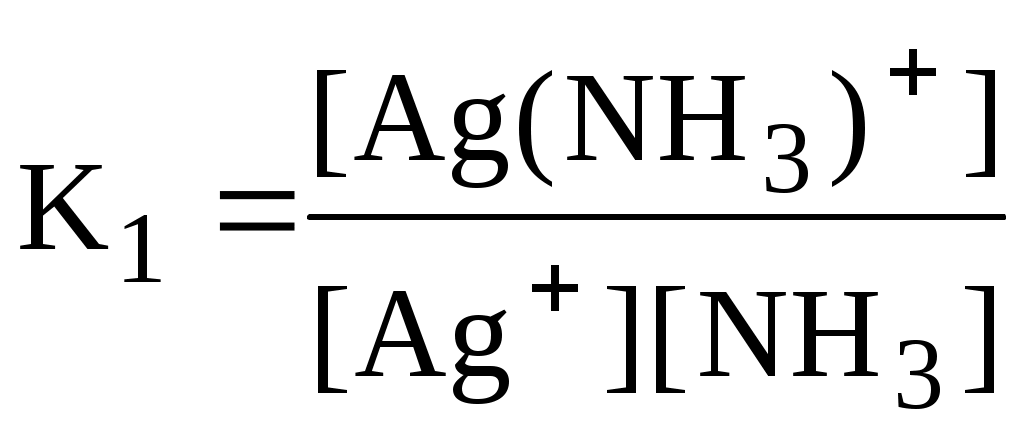
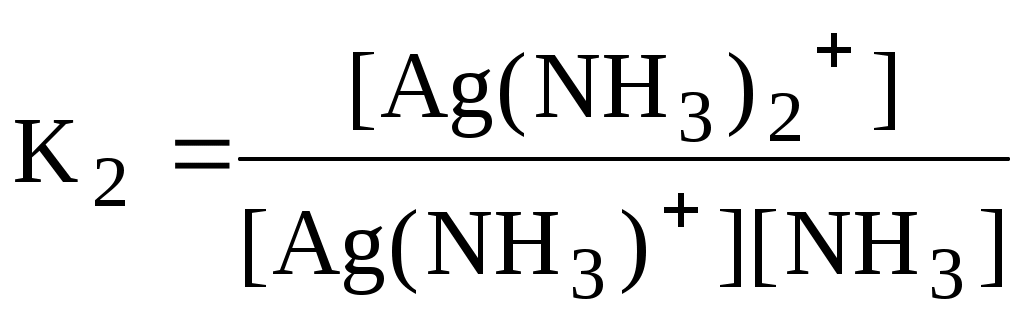
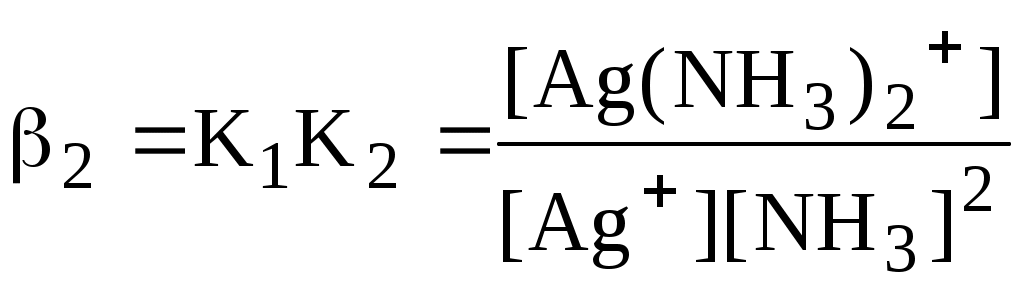
Часто вместо значений констант равновесия используют их десятичные логарифмы (если константа очень большая) или отрицательные десятичные логарифмы (если она, наоборот, значительно меньше единицы). Отрицательный десятичный логарифм константы равновесия называется показателем данной константы (рК).
3.5. Общие принципы расчёта состава равновесных систем
Для определения состава равновесной смеси при определённых условиях используют концентрационные константы равновесия, а также уравнения материального баланса и электронейтральности.
Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
Например, для раствора, содержащего частицы Ag+, NH3, NH4+, Ag(NH3)+ и Ag(NH3)2+:
Уравнение электронейтральности основано на том, что в закрытой системе суммарное число отрицательных зарядов должно быть равно числу положительных.
Например, для водного раствора Na2S
Уравнения материального баланса и электронейтральности выполнимы для равновесных концентраций частиц, но не для активностей. Для расчётов следует использовать концентрационные константы равновесия, а не термодинамические. При малых ионных силах значения концентрационных и термодинамических констант незначительно отличаются друг от друга, поэтому для характеристики равновесий в разбавленных растворах допустимо использование термодинамических констант, значения которых приведены в справочниках.
Равновесия можно описывать графически. Графики, представляющие собой зависимость молярных долей компонентов системы от параметра,
влияющего на состояние системы, называются распределительными диаграммами. Графики, представляющие собой зависимость логарифмов равновесных концентраций компонентов системы от фактора, влияющего на равновесие, называются концентрационно-логарифмическими диаграммами (рис 3.2).
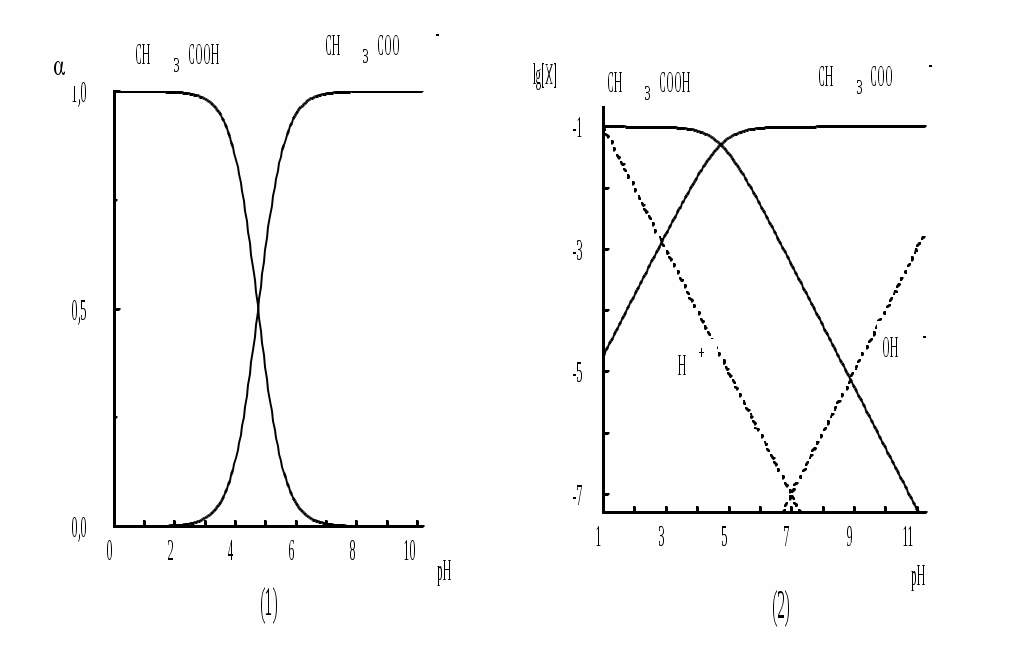
Рис. 3.2. Распределительная(1) и концентрационно-логарифмическая (2) диаграммы для уксусной кислоты
ГЛАВА 4
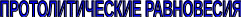
4.1. Важнейшие теории кислот и оснований
Первая научная теория кислотности была предложена в 1780-х годах А. Лавуазье. Согласно данной теории все кислоты должны были обязательно содержать атом кислорода, что и было отражено в названии этого элемента.

В 1816 году Г. Дэви высказал предположение, что в состав кислот должен обязательно входить атом водорода. В 1833 году Ю. Либих уточнил это определение - кислота - вещество, в состав которого входят атомы водорода, способные замещаться атомами металла.
В 1880-х годах С. Аррениус и В. Оствальд предложили ионную теорию кислот и оснований, согласно которой
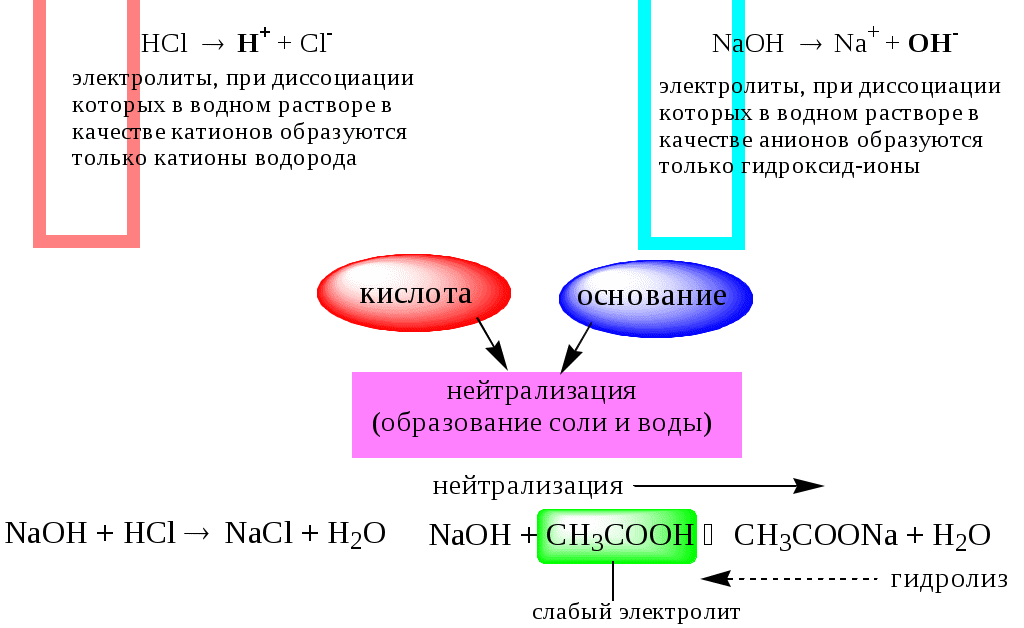
В 1923 году почти одновременно появились ещё 2 теории кислот и оснований. Автором первой были датский химик И.Н. Брёнстед и английский химик Т.М. Лоури, а второй – американский физикохимик Г.H. Льюис. Согласно теории Брёнстеда - Лоури, названной протолитической теорией кислот и оснований:
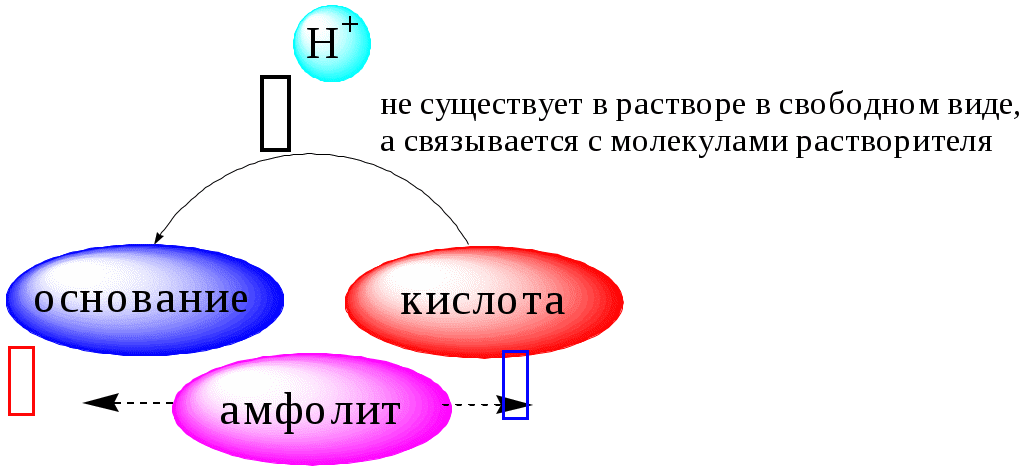
Кислоты, основания и амфолиты могут быть как электронейтральными, так и иметь заряд.

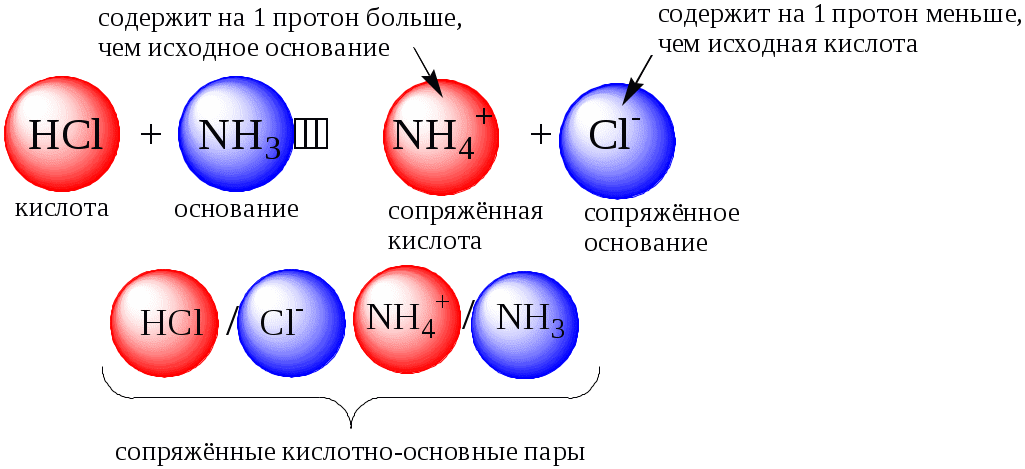
Кислотно-основное взаимодействие заключается в обратимом переносе протона от кислоты к основанию. Кислоты и основания существуют как сопряжённые пары. В процессе взаимодействия друг с другом кислота и основание не исчезают, например, образуя соль, а превращаются в новое основание и новую кислоту.
Понятие «соль» в протолитической теории вообще не используется и, тем более, отсутствует понятие «гидролиз соли». Так, например, тот факт, что раствор NH4Cl имеет слабокислую среду, объясняется не гидролизом данной соли с образованием слабого электролита NH4OH и сильного электролита HCl, а тем, что катион аммония является слабой кислотой. Более того, никакого «слабого электролита» NH4OH на самом деле не существует (связь между атомами кислорода и азота не может быть ковалентной, так как азот не бывает пятивалентным).
Согласно теории Льюиса, названной электронной теорией кислот и оснований
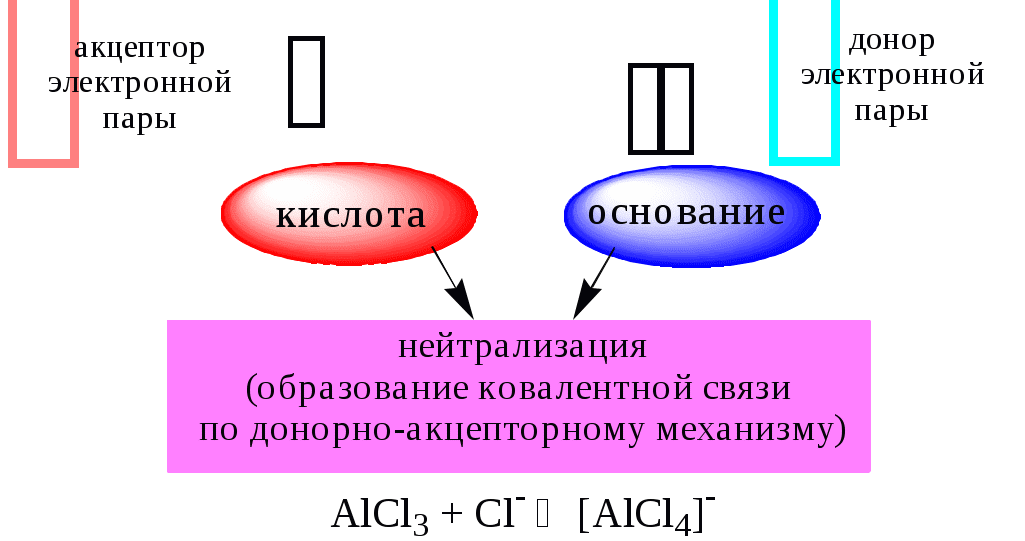
Основания Брёнстеда и основания Льюиса представляют собой одни и те же соединения, понятие «кислота» согласно протолитической и электронной теориям отличается.
В аналитической химии преимущественно используется протолитическая теория. Это связано с тем, что теория Льюиса имеет слишком общий характер и её трудно применить для количественных расчётов.
4.2. Количественное описание силы кислот и оснований
Для количественной характеристики силы кислот, находящихся в растворе, используют константу, характеризующую способность кислоты отдавать протон молекуле растворителя, выступающей в качестве основания. Такая константа называется константой кислотности (Ka).
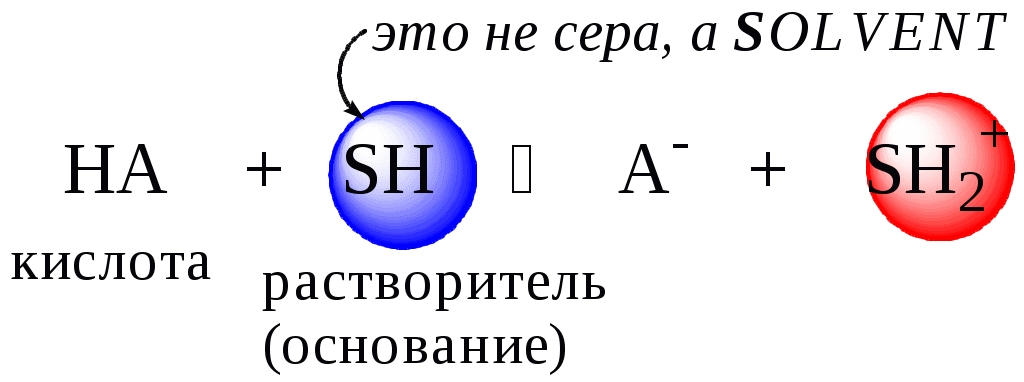
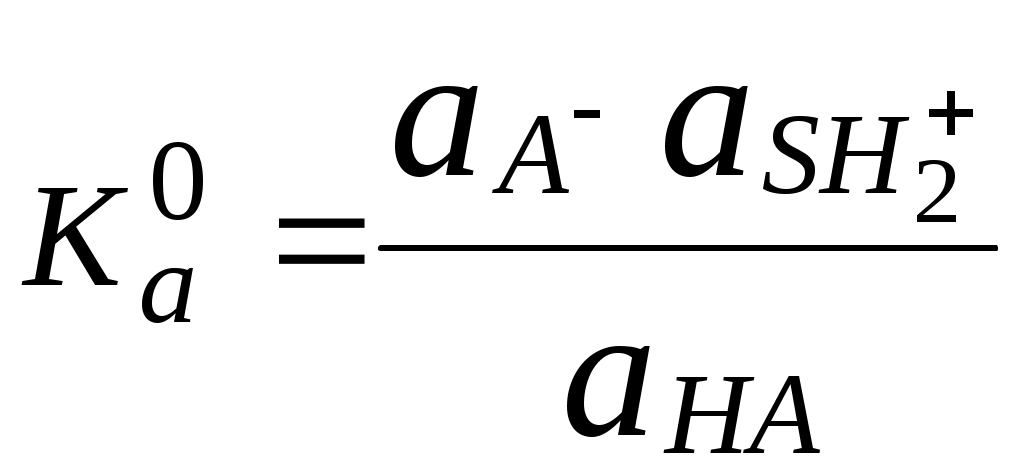
Активность растворителя не входит в выражение константы, так как считается равной 1.
Для водных растворов
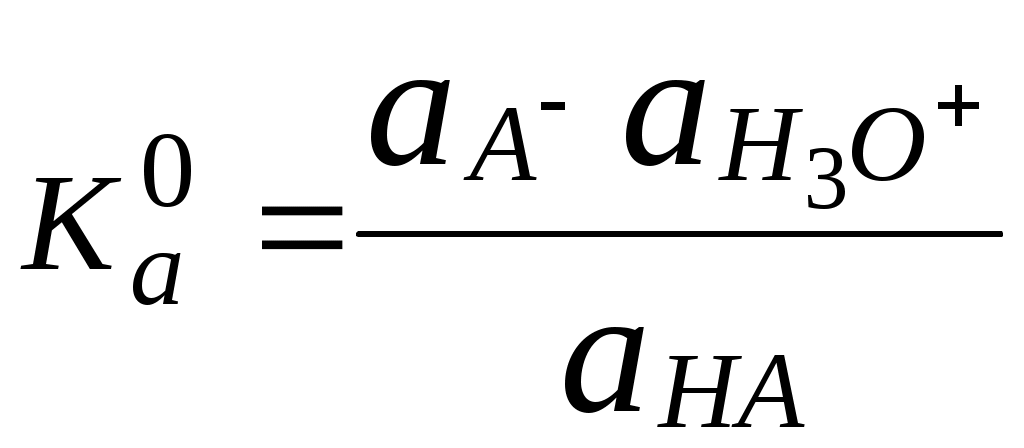

Силу оснований можно описывать двояко: с помощью константы основности (Kb) либо с помощью константы кислотности сопряженной кислоты (KBH+ или Ka). В случае водных растворов данные константы описывают следующие равновесия:
B + H2O BH+ + OH- BH+ + H2O B + H3O+
Константа основности в современной аналитической химии практически не применяется. Это связано с тем, что при использовании данной константы, приходится работать с активностью (или концентрацией) гидроксид-ионов, в то время как среду раствора принято описывать с помощью концентрации ионов водорода. Кроме того, при использовании константы кислотности сопряжённой кислоты все протолиты (и кислоты и основания) можно объединить в одну таблицу. Константа основности не несёт никакой новой информации, так как её легко рассчитать, зная величину константы кислотности сопряжённой кислоты.