Файл: Курс лекций, нгу 2000. Лекция Что такое молекулярная биология. Доказательства роли нуклеиновых кислот.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 11.01.2024
Просмотров: 149
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Фермент способен гидролизовать спаренный 5'-конец, расчищая себе дорогу и продолжая полимеризацию.
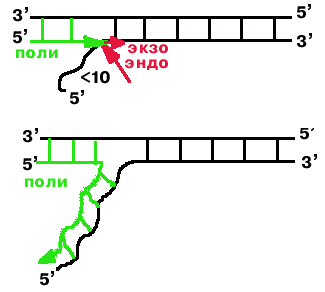
Если на пути фермента встречается короткий (меньше 10 нуклеотидов) неспаренный 5'-конец, то полимераза сначала проявляет эндонуклеазную активность и откусывает весь свисающий конец, а затем проявляет экзонуклеазную 5' 3' активность т.е. откусывает по одному нуклеотиду.
Если неспаренный 5'-конец длинный, то фермент использует его как матрицу.
При мягком расщеплении ДНК-полимеразы трипсином можно получить два активных фрагмента:
один обладает полимеразной и 3' 5' гидролитической активностью (фрагмент Кленова),
другой - 5' 3' гидролитической активностью.
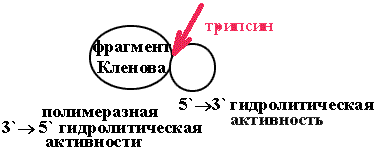
Схема непрерывной антипараллельной репликации in vivo по Корнбергу
1960г. Гипотетическая модель.
Суть предположения: неизвестный фактор денатурирует концы линейной молекулы, 3'-ОН-концы загибаются и служат затравками для работы ДНК-полимеразы. Фермент осуществляет денатурацию матричной ДНК по мере продвижения и синтеза дочерних цепей. На выходе - дочерние молекулы, которые короче на загнутый конец, т.к. эндонуклеаза вносит разрыв в материнскую цепь.
Схема непрерывной параллельной репликации Джона Кэрнса
1963г. Авторадиография

Бактерии выращивались на среде с радиоактивным H3-тимидином в течение 5-и, 10-и, 15-и мин., после чего проводили авторадиографию.
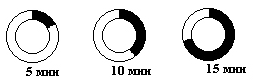
Ширина полос засветки соответствовала двум меченым нитям ДНК (если помечена одна цепь, то полоса будет получаться уже).
В модели допускалось наличие фермента, способного вести синтез в направлении 3' 5'. Такой фермент не найден и сегодня.

Модель неверна, однако, она побудила искать новые ДНК-полимеразы и в Е. coli были найдены еще две: II и III.
Сравнительные характеристики ДНК-полимераз E. сoli
Функция
ДНК-полимераза I
ДНК-полимераза II
ДНК-полимераза III
Полимеризация в 5' 3' направлении
+
+
+
Гидролитическая активность 3' 5'
+
+
+
Гидролитическая активность 5' 3'
+
-
-
Потребность в матрице-затравке:
Нативная двуцепочечная ДНК
-
-
-
Одноцепочечная ДНК с олигонуклеотидной затравкой
+
-
-
2-х цепочечная ДНК с ником
+
-
-
или с пробелом меньше 100 нуклеотидов
+
+
+
или с пробелом больше 100 нуклеотидов
+
-
-
Оптимальная концентрация KCl
Активность
20мМ
60%
60%
100%
50мМ
80%
100%
50%
100мМ
100%
70%
10%
150мМ
80%
50%
0%
Влияние 10% этанола
40%
45%
200%
Молекулярный вес (кДа)
109
120
субъединич.состав
Число оборотов, принимая за единицу 667 нукл/мин.
1
0.05
15
Число молекул на клетку
250
100
20
К репликации имеют отношение полимеразы I и III.
Причем именно полимераза III является репликазой, т.е. она синтезирует in vivo новые цепи ДНК.
Участие ДНК-полимеразы I необходимо. У нее вспомогательная, репаративная функция.
ДНК-полимераза II имеет отношение лишь к репарации.
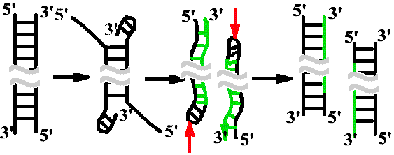
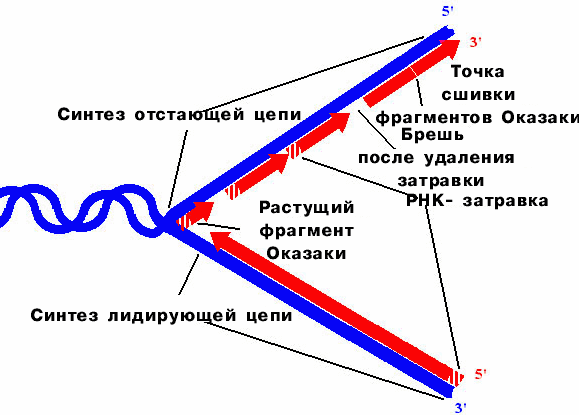
Схема прерывистой антипараллельной репликации Рейджи Оказаки
1968 г.
Исходные посылки: все данные Корнберга, полученные в ферментативной системе in vitro, и "картинки" Кэрнса верны ( но картинки неправильно интерпретированы).
Оказаки специально разработал два новых метода исследования.
1. Метод импульсного мечения.
До Оказаки метку давали в культуральную среду и быстро начинали отмывать клетки, но минимальное время подачи метки было 5 мин. Оказаки через нужный момент времени после добавления меченого тимидина давал 1000-кратный избыток холодного (немеченого) тимидина. Таким образом, метка включается только в течение очень короткого времени.
Оказаки считал, что время Кэрнса (5 мин.) очень велико для получения истинной картины происходящего при репликации.
2. Центрифугирование в щелочном градиенте сахарозы.
Сахароза разводится на щелочи. В щелочной среде происходит денатурация ДНК. В этом случае короткие фрагменты ДНК, если они есть, отделяются от длинных. После этого их можно выявить при центрифугировании в градиенте плотности сахарозы, разделяющем молекулы по молекулярному весу.
Оказаки предположил, что синтез ДНК идет короткими фрагментами и что короткие фрагменты должны сшиваться.
Сшиваются они лигазой. ДНК-лигаза была обнаружена как у прокариот, так и у эукариот. У E. сoli были найдены мутанты по лигазе.
Оказаки провел эксперимент на бактериях, зараженных фагом Т4, у которого есть своя термочувствительная лигаза, которая работает при 20 С и не работает при 43 С. Если в клетку попадает фаговая ДНК, то клетка переключается на репликацию ДНК фага.
Клетки заражали фагом Т4, давали импульсную метку Н3-тимидин и выращивали при двух температурах: 20 С и 43 С. Потом проводили центрифугирование в щелочном градиенте сахарозы.
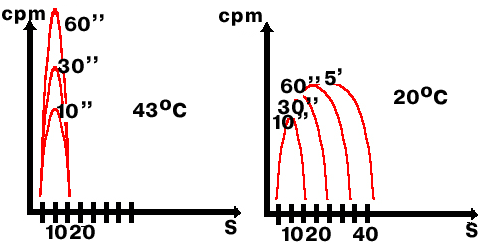
Лигаза E. coli нуждается в коферменте НАД, а лигаза фага - в АТФ. Если E.coli не давать никотиновую кислоту (предшественник НАД), бактериальная ДНК реплицируется, но не сшивается.
Прерывистость репликации показана для всех объектов, кроме фагов, содержащих одноцепочечную ДНК.
У некоторых фагов и вирусов прерывистый синтез идет по обеим цепям. У бактерий и высших организмов одна цепь образуется непрерывно, а другая - прерывисто (лидирующая и запаздывающая цепи).
Размер фрагментов Оказаки видоспецифичен и составляет для фагов 1000-2000 нукл., E. сoli - 1000 нукл., для эукариот - 200-400 нукл.
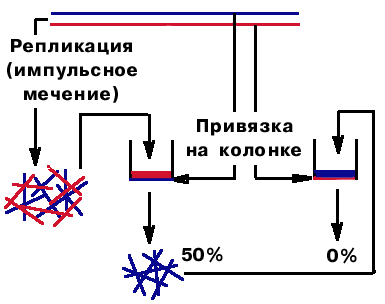
У фага Т7 обе цепи ДНК тоже реплицируются прерывисто. Они имеют разную плотность (в одной больше пуринов). Цепи были разделены в градиенте плотности CsCl и помещены на две колонки. Была осуществлена ковалентная привязка, поэтому они не могли сойти со смолы. Потом провели репликацию в условиях импульсного мечения. Пропустили все фрагменты через первую колонку. Выход был 50%. Остальные прогнали через вторую колонку. Выхода не было. Таким образом, было показано, что фрагменты комплементарны обеим матричным цепям. Значит, фрагменты образуются по обеим цепям
Схема размножения фага М13
1974 г. Оказаки.
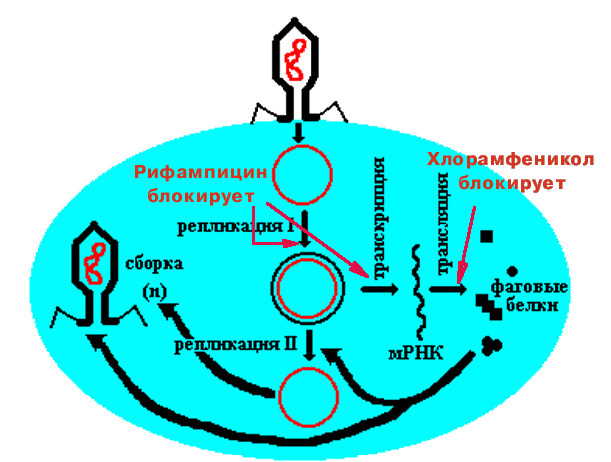
Рифампицин - ингибитор бактериальной РНК-полимеразы (на стадии инициации).
Хлорамфеникол - ингибитор трансляции на бактериальных рибосомах.
Если одновременно с заражением E. сoli фагом добавить хлорамфеникол, то блокируются трансляция, репликация II и сборка фагов.
Если подействовать рифампицином, то блокируется не только транскрипция и все следующие процессы, но и репликация I.
Вывод: бактериальная РНК-полимераза участвует в репликации ДНК фага.
Вся фаговая ДНК составляет
6000 нукл.
Определение: origin (ori) - район начала репликации.
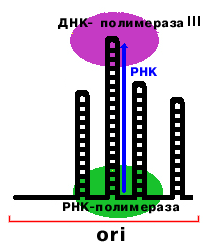
В районе ori (начало репликации) имеется 4 шпильки. Эти шпильки опознаются РНК-полимеразой, и вторая шпилька используется в качестве матрицы. По мере образования РНК шпилька плавится. Образуется РНК-затравка длиной 24 нукл., 3'-конец которой используется ДНК полимеразой III.
Когда 3'-конец синтезируемой цепи ДНК "утыкается" в 5'-конец РНК-затравки, ДНК-полимераза III вытесняется ДНК-полимеразой I, которая, обладая 5' 3' гидролитической активностью, "съедает" РНК-затравку, одновременно продолжая синтез ДНК. Когда затравка (РНК) съедена, ДНК-полимераза I вытесняется лигазой, которая сшивает концы ДНК.
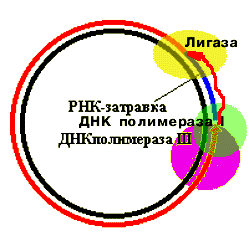
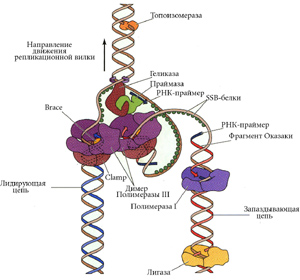
Все эти ферменты (ДНК-полимераза III, ДНК-полимераза I, лигаза) входят в состав реплисомы. Они представляют единый белковый комплекс, который реагирует изменением конформации на выполнение очередной функции.
Протяженная (более 100 нукл.) одноцепочечная ДНК-матрица может быть использована ДНК полимеразой III, когда полимераза III представлена в форме holo-фермента. Помимо субъединицы , обладающей полимеразной активностью, в holo-фермент входит еще несколько субъединиц, обеспечивающих высокую процессивность синтеза ДНК.
Фаг X174
Репликация ДНК этого фага не зависит от рифампицина.
Здесь работает не обычная РНК-полимераза, а особый фермент - праймаза. Он умеет делать только РНК-затравку.
Праймаза нуждается в дополнительных факторах - белках препрайминга. Точно так же (с помощью праймазы и белков препрайминга) образуются РНК-затравки при репликации ДНК E. сoli.
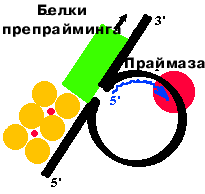
Праймосома - это белки препрайминга и праймаза.
Белки движутся по матричной цепи ДНК в 5' 3' направлении, праймаза - в противоположном, синтезируя РНК-затравки в организованных с помощью белков препрайминга участках ДНК на расстоянии 1000 нукл. друг от друга.
Топологические проблемы репликации ДНК
SSB
Белки Альбертса, обнаруженные в 1968г., снижают температуру плавления ДНК in vitro на 20-40 С. Они связываются с ДНК электростатически, хотя имеют отрицательный заряд. Эти белки содержат кластер положительно заряженных аминокислотных остатков, но общий заряд белка отрицателен. У них повышенное сродство к одноцепочечной ДНК. Белок не связывается с двуцепочечной ДНК, не имеющей расплавленных участков.
Но если есть одноцепочечная ДНК, то белки легко садятся на нее, выпрямляют ее, превращая ДНК в "палку".
Белки связываются с двуцепочечной ДНК, если в ней есть нарушения вторичной структуры.
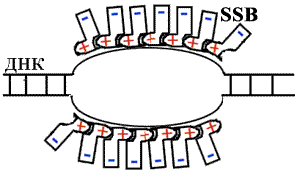
Когда в ДНК образуется расплавленный участок, белок покрывает его за счет электростатических взаимодействий. При этом проявляется сродство белков друг к другу. Они покрывают ДНК сплошным слоем (стехиометрическое количество белка).
Белки, сидящие на комплементарных цепях, не дают цепям схлопнуться, т.к. имеют мощный отрицательный заряд. Называются эти белки SSB (single strand bind).
Они не денатурируют ДНК, а лишь фиксируют одноцепочечное состояние.
Участие SSB в репликации абсолютно необходимо. Они удерживают матричные цепи ДНК в репликативной вилке в одноцепочечном состоянии, а также защищают одноцепочечную ДНК от действия нуклеаз. Они избирательно стимулируют работу ДНК-полимеразы. РНК-полимераза не может использовать одноцепочечную ДНК, покрытую SSB. Избирательность касается и вида. Например, SSB фага Т4 стимулирует ДНК- полимеразу фага Т4, но не ДНК-полимеразы Е. сoli.
SSB не ферменты - они нужны в стехиометрическом количестве.
Геликазы
В 1974г найдены геликазы.
Определение: геликазы - ферменты, денатурирующие ДНК.
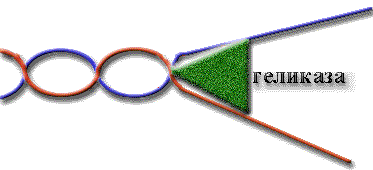
У E.coli есть четыре геликазы: геликаза I, геликаза II, геликаза III и rep-белок.
Rep-геликаза используется при репликациии II одноцепочечных ДНК-содержащих фагов. Для репликации бактериальной ДНК она не нужна.
Геликазы различаются требованиями к размеру посадочной площадки, на которую они садятся для начала движения.
Площадка - это одноцепочечный участок ДНК, т.е. геликаза не может начать плавление нативной ДНК без дефектов.
Как образуется такая площадка в нативной ДНК? Эта проблема решается с помощью топоизомераз.
Топоизомеразы
Определение: топоизомеразы - ферменты, изменяющие топологию ДНК.
Топоизомеразы меняют число зацеплений одной цепи за другую.
Делятся на два класса:
Тип I (релаксазы) - уменьшают число зацеплений.
Тип II (гиразы) - увеличивают число зацеплений.
Гиразы вносят двуцепочечный разрыв ДНК по принципу работы рестриктаз.
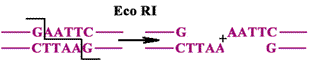
Определение: рестриктазы - эндонуклеазы, которые узнают определенные последовательности и делают разрезы в обеих цепях.
После разрыва цепей гираза поворачивает концы ДНК на 360 и проявляет лигазную активность, т.е. сшивает цепи ДНК. В этом процессе используется энергия АТФ. Результат деятельности гираз - супервитки.
Суперспирализованная ДНК напряжена. При высоком напряжении в суперспирали в некоторых местах цепи расходятся, т.к. расплавляются А-Т богатые участки.
Гиразы имеют отношение и к транскрипции, поскольку при напряжении в молекуле ДНК плавятся А-Т богатые районы промоторов, а палиндромы переходят в форму креста.
Все природные кольцевые двуцепочечные ДНК имеют отрицательную суперспирализацию. Один супервиток приходится на каждые 200 пар нуклеотидов.
У релаксаз есть только эндонуклеазная и лигазная активности, но нет АТФ-азной.
Они разрывают только одну цепь. Происходит раскручивание напряженной ДНК, после чего релаксаза сшивает концы. Релаксаза узнает определенную конформацию суперспирализованной молекулы ДНК и режет ее, сбрасывая тем самым лишнме супервитки.
Регуляция транскрипции в бактериальной клетке осуществляется не только на уровне белков репрессоров (активаторов), но и на уровне активности гираз и релаксаз.
Современная схема репликации ДНК E. сoli
1 2 3 4 5 6 7 8 9
Фермент способен гидролизовать спаренный 5'-конец, расчищая себе дорогу и продолжая полимеризацию.
 | Если на пути фермента встречается короткий (меньше 10 нуклеотидов) неспаренный 5'-конец, то полимераза сначала проявляет эндонуклеазную активность и откусывает весь свисающий конец, а затем проявляет экзонуклеазную 5' 3' активность т.е. откусывает по одному нуклеотиду. Если неспаренный 5'-конец длинный, то фермент использует его как матрицу. |
| При мягком расщеплении ДНК-полимеразы трипсином можно получить два активных фрагмента: один обладает полимеразной и 3' 5' гидролитической активностью (фрагмент Кленова), другой - 5' 3' гидролитической активностью. |  |
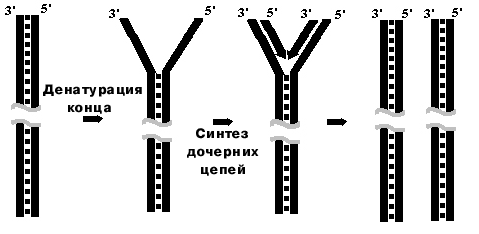
Схема непрерывной антипараллельной репликации in vivo по Корнбергу
1960г. Гипотетическая модель.

Суть предположения: неизвестный фактор денатурирует концы линейной молекулы, 3'-ОН-концы загибаются и служат затравками для работы ДНК-полимеразы. Фермент осуществляет денатурацию матричной ДНК по мере продвижения и синтеза дочерних цепей. На выходе - дочерние молекулы, которые короче на загнутый конец, т.к. эндонуклеаза вносит разрыв в материнскую цепь.
Схема непрерывной параллельной репликации Джона Кэрнса
 |
| 1963г. Авторадиография |  |
| Бактерии выращивались на среде с радиоактивным H3-тимидином в течение 5-и, 10-и, 15-и мин., после чего проводили авторадиографию. |  |
Ширина полос засветки соответствовала двум меченым нитям ДНК (если помечена одна цепь, то полоса будет получаться уже).
В модели допускалось наличие фермента, способного вести синтез в направлении 3' 5'. Такой фермент не найден и сегодня.
Модель неверна, однако, она побудила искать новые ДНК-полимеразы и в Е. coli были найдены еще две: II и III.
Сравнительные характеристики ДНК-полимераз E. сoli
| Функция | ДНК-полимераза I | ДНК-полимераза II | ДНК-полимераза III |
| Полимеризация в 5' 3' направлении | + | + | + |
| Гидролитическая активность 3' 5' | + | + | + |
| Гидролитическая активность 5' 3' | + | - | - |
| Потребность в матрице-затравке: | | ||
| Нативная двуцепочечная ДНК | - | - | - |
| Одноцепочечная ДНК с олигонуклеотидной затравкой | + | - | - |
| 2-х цепочечная ДНК с ником | + | - | - |
| или с пробелом меньше 100 нуклеотидов | + | + | + |
| или с пробелом больше 100 нуклеотидов | + | - | - |
| Оптимальная концентрация KCl | Активность | ||
| 20мМ | 60% | 60% | 100% |
| 50мМ | 80% | 100% | 50% |
| 100мМ | 100% | 70% | 10% |
| 150мМ | 80% | 50% | 0% |
| Влияние 10% этанола | 40% | 45% | 200% |
| Молекулярный вес (кДа) | 109 | 120 | субъединич.состав |
| Число оборотов, принимая за единицу 667 нукл/мин. | 1 | 0.05 | 15 |
| Число молекул на клетку | 250 | 100 | 20 |
К репликации имеют отношение полимеразы I и III.
Причем именно полимераза III является репликазой, т.е. она синтезирует in vivo новые цепи ДНК.
Участие ДНК-полимеразы I необходимо. У нее вспомогательная, репаративная функция.
ДНК-полимераза II имеет отношение лишь к репарации.
Схема прерывистой антипараллельной репликации Рейджи Оказаки
1968 г.
Исходные посылки: все данные Корнберга, полученные в ферментативной системе in vitro, и "картинки" Кэрнса верны ( но картинки неправильно интерпретированы).
Оказаки специально разработал два новых метода исследования.
1. Метод импульсного мечения.
До Оказаки метку давали в культуральную среду и быстро начинали отмывать клетки, но минимальное время подачи метки было 5 мин. Оказаки через нужный момент времени после добавления меченого тимидина давал 1000-кратный избыток холодного (немеченого) тимидина. Таким образом, метка включается только в течение очень короткого времени.
Оказаки считал, что время Кэрнса (5 мин.) очень велико для получения истинной картины происходящего при репликации.
2. Центрифугирование в щелочном градиенте сахарозы.
Сахароза разводится на щелочи. В щелочной среде происходит денатурация ДНК. В этом случае короткие фрагменты ДНК, если они есть, отделяются от длинных. После этого их можно выявить при центрифугировании в градиенте плотности сахарозы, разделяющем молекулы по молекулярному весу.
Оказаки предположил, что синтез ДНК идет короткими фрагментами и что короткие фрагменты должны сшиваться.
Сшиваются они лигазой. ДНК-лигаза была обнаружена как у прокариот, так и у эукариот. У E. сoli были найдены мутанты по лигазе.
Оказаки провел эксперимент на бактериях, зараженных фагом Т4, у которого есть своя термочувствительная лигаза, которая работает при 20 С и не работает при 43 С. Если в клетку попадает фаговая ДНК, то клетка переключается на репликацию ДНК фага.
Клетки заражали фагом Т4, давали импульсную метку Н3-тимидин и выращивали при двух температурах: 20 С и 43 С. Потом проводили центрифугирование в щелочном градиенте сахарозы.

Лигаза E. coli нуждается в коферменте НАД, а лигаза фага - в АТФ. Если E.coli не давать никотиновую кислоту (предшественник НАД), бактериальная ДНК реплицируется, но не сшивается.
Прерывистость репликации показана для всех объектов, кроме фагов, содержащих одноцепочечную ДНК.
У некоторых фагов и вирусов прерывистый синтез идет по обеим цепям. У бактерий и высших организмов одна цепь образуется непрерывно, а другая - прерывисто (лидирующая и запаздывающая цепи).

Размер фрагментов Оказаки видоспецифичен и составляет для фагов 1000-2000 нукл., E. сoli - 1000 нукл., для эукариот - 200-400 нукл.
 | У фага Т7 обе цепи ДНК тоже реплицируются прерывисто. Они имеют разную плотность (в одной больше пуринов). Цепи были разделены в градиенте плотности CsCl и помещены на две колонки. Была осуществлена ковалентная привязка, поэтому они не могли сойти со смолы. Потом провели репликацию в условиях импульсного мечения. Пропустили все фрагменты через первую колонку. Выход был 50%. Остальные прогнали через вторую колонку. Выхода не было. Таким образом, было показано, что фрагменты комплементарны обеим матричным цепям. Значит, фрагменты образуются по обеим цепям |
Схема размножения фага М13
1974 г. Оказаки.

Рифампицин - ингибитор бактериальной РНК-полимеразы (на стадии инициации).
Хлорамфеникол - ингибитор трансляции на бактериальных рибосомах.
Если одновременно с заражением E. сoli фагом добавить хлорамфеникол, то блокируются трансляция, репликация II и сборка фагов.
Если подействовать рифампицином, то блокируется не только транскрипция и все следующие процессы, но и репликация I.
Вывод: бактериальная РНК-полимераза участвует в репликации ДНК фага.
Вся фаговая ДНК составляет
 | В районе ori (начало репликации) имеется 4 шпильки. Эти шпильки опознаются РНК-полимеразой, и вторая шпилька используется в качестве матрицы. По мере образования РНК шпилька плавится. Образуется РНК-затравка длиной 24 нукл., 3'-конец которой используется ДНК полимеразой III. |
| Когда 3'-конец синтезируемой цепи ДНК "утыкается" в 5'-конец РНК-затравки, ДНК-полимераза III вытесняется ДНК-полимеразой I, которая, обладая 5' 3' гидролитической активностью, "съедает" РНК-затравку, одновременно продолжая синтез ДНК. Когда затравка (РНК) съедена, ДНК-полимераза I вытесняется лигазой, которая сшивает концы ДНК. |  |
 | Праймосома - это белки препрайминга и праймаза. Белки движутся по матричной цепи ДНК в 5' 3' направлении, праймаза - в противоположном, синтезируя РНК-затравки в организованных с помощью белков препрайминга участках ДНК на расстоянии 1000 нукл. друг от друга. |
 | Когда в ДНК образуется расплавленный участок, белок покрывает его за счет электростатических взаимодействий. При этом проявляется сродство белков друг к другу. Они покрывают ДНК сплошным слоем (стехиометрическое количество белка). |
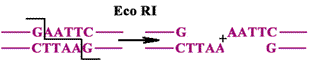 | Определение: рестриктазы - эндонуклеазы, которые узнают определенные последовательности и делают разрезы в обеих цепях. |
Белки, участвующие в репликации ДНК E.сoli.
-
Название
Мол.вес (кДа)
Число субъединиц
Количество молекул на клетку
Функция
Гираза
gyrA
gyrB
400
210
190
4
2
2
25
суперскручивание для плавления ori
эндонуклеазная и лигазная активности
АТФ-азная активность
SSB
76
4
300
Фиксация одноцепочечной ДНК
Геликаза
I
II
III
180
75
56
1
1
1
5000
Плавление ori в репликативной вилке
Белки препрайминга
Препрайминг
priA
82
1
50
3' 5' геликаза по запаздывающей цепи, удаляет SSB
dnaT
66
3
50
n
14
2
80
n'
76
1
70
АТФ-аза
n"
17
1
dnaC
29
1
100
dna B
330
6
20
5' 3' геликаза по запаздывающей цепи
Праймаза dnaG
60
1
50
Синтез РНК-затравок (праймеров)
ДНК-полимераза III
Синтез ДНК
holo-фермент
800
260
50
20
142
104
64
160
16
2
2
2
2
2
2
4
20
полимеразная
5' 3' активность
гидролитическая
3' 5' активность
ДНК-полимераза I
109
1
300
Удаление праймеров и заполнение брешей
Лигаза
74
1
300
Сшивание фрагментов Оказаки
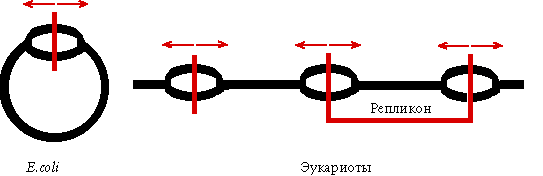
У E.coli один origin репликации и две репликативные вилки. Сегодня популярна модель "тромбона", согласно которой ДНК-полимераза III образует асимметричный димер и одновременно ведет непрерывный синтез лидирующей цепи и фрагментов Оказаки запаздывающей цепи.
ДНК у эукариот не кольцевая. Тогда возникает вопрос: как же достигается плавление ori?
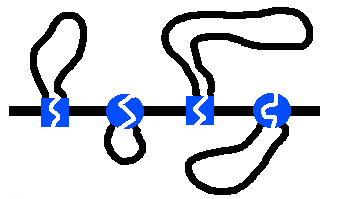
У фага Т4 тоже не кольцевая ДНК. Субъединицы гиразы сближают несмежные участки ДНК и образуется петля. В ней и ведется суперспирализация.
У эукариот ДНК закрепляется белками в нескольких местах на ядерной мембране. На каждом отдельном участке работает топоизомераза. Сколько участков, столько и ori.
Хотя в клетке у человека ДНК на 3 порядка больше чем у E. сoli, время репликации соизмеримо (за счет большего количества ori).
Каждая эукариотическая хромосома - полирепликон.
Определение: репликон - участок ДНК между двумя ori.
Размер фрагментов Оказаки у эукариот меньше (200-400 нукл).
Скорость работы ДНК-полимераз эукариот на порядок ниже, чем у прокариот.
Организм
Количество репликонов
Средний размер репликона, тыс.п.н.
Скорость движения репликативной вилки п.н./мин.
E.сoli
1
4200
50000
Дрожжи
500
40
3600
Дрозофила
3500
40
2600
Ксенопус (лягушка)
15000
200
500
Мышь
25000
150
2200
Бобы
35000
300
2200
У эукариот РНК-затравки размером 6-10 нукл. удаляются РНК-азой Н (hybrid). Бреши заделываются репарирующими ферментами.
Проблема репликации концов линейных молекул
Модель "заячьи уши".
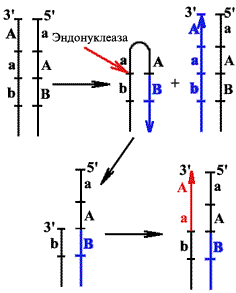
Работает у ряда вирусов.
Репликация концов ДНК хромосом эукариот
Удаление РНК-праймеров после завершения синтеза линейных ДНК в виде фрагментов Оказаки и заделывание образующихся между фрагментами брешей нуклеотидами ДНК приводит к тому, что дочерние цепи ДНК оказываются короче материнских на размер первого РНК-праймера (10-20 нукл.).
Образуются 3'-оверхенги, т.е. выступающие 3'-концы материнских цепей. Они узнаются теломеразой - ферментом, содержащим помимо белковой части еще и РНК, выполняющую роль матрицы для наращивания ДНК повторами.
Теломераза последовательно наращивает материнские цепи ДНК повторами, используя 3'-оверхенги в качестве затравок. Образующиеся длинные одноцепочечные концы в свою очередь служат матрицами для синтеза дочерних цепей традиционным репликативным механизмом.
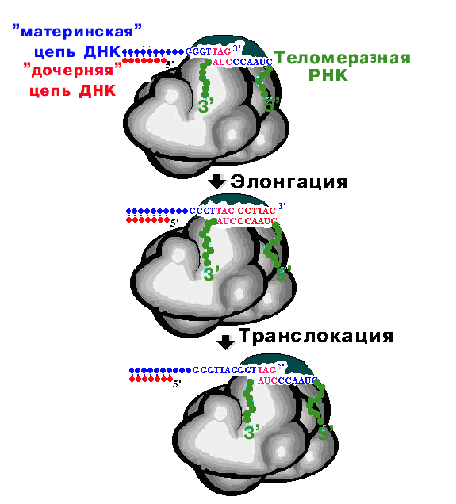
Хромосомы соматических клеток человека фланкированы многократно повторенными гексамерами TTAГГГ, общая длина районов с повторами может достигать 10 тыс. пар нуклеотидов. В комплексе со специфическими белками такие тандемные повторы образуют теломеры, защищающие концы ДНК от действия экзонуклеаз, предотвращающие неправильную рекомбинацию и позволяющие концам хромосом прикрепляться к ядерной оболочке.
При каждом раунде репликации происходит укорочение теломер в среднем на 50 пар нуклеотидов. Поскольку теломерные последовательности не являются кодирующими, они выступают в роли буферной зоны - как защита от "проблемы концевой репликации".
Укорочение ДНК в ходе каждого раунда репликации лишь сокращает нетранскрибируемый текст теломеры, но не приводит к утрате смысловых последовательностей - генов и регуляторов их экспрессии.
Регуляция репликации прокариот известна, т.к. известны гены белков регуляции репликации E.сoli и механизмы их включения (выключения). Для эукариот эти механизмы еще не ясны, но известно расписание репликации ДНК по разным хромосомам.
Причины ошибок при синтезе ДНК
Способность ошибаться заложена в самой структуре фермента.
Скорее всего, ферменты, которые не ошибались, были тупиковыми ветвями эволюции. На первых этапах зарождения жизни разнообразие обеспечивалось только такими ошибками.
In vitro происходит 1 ошибка на 100 тыс. нукл. для средней ДНК-полимеразы.
In vitro можно уменьшить вероятность ошибки до 1 на 1млн. нукл., если добавить SSB, геликазу и лигазу.
Можно и увеличить вероятность ошибки до 1 на 100, если дать неадекватное количество субстрата, а также если добавить ионы серебра, бериллия, меди, кобальта, никеля, свинца. Это происходит из-за конкуренции этих ионов с ионами магния за связывание с ДНК-полимеразой.
Еще один способ повышения количества ошибок - добавление аналогов нуклеотидов. Например бромдезоксиуридина - аналога тимидина.
Это одно из средств борьбы со СПИДом и раком. Аналоги одинаково вредны для всех клеток, однако в пораженных вирусом клетках чаще проходит репликация.
Этапы проверки
Первичный отбор нуклеотидов идет по принципу комплементарности.
Способностью к этому виду отбора обладают все ДНК-полимеразы благодаря полимеризационной 5' 3' активности.
Редактирующий отбор.
Его проводят все полимеразы благодаря экзонуклеазной активности 3' 5'.
Исправление ошибок в уже синтезированной ДНК.
Этим занимаются ферменты репарации.
Вероятность ошибок для ферментов вирусов, про- и эукариот
Объект
Вероятность замены на пару оснований
E.coli
2х10-10
Дрозофила
5х10-11
Фаг Т4
2х10-8
Разницу связывают со скоростью работы фермента. Чем медленней, тем точнее!
Основные репарабельные повреждения в ДНК и принципы их устранения
1. Апуринизация.
Каждая соматическая клетка теряет за сутки около 10000 пуринов и пиримидинов. В ДНК образуются АП-сайты.
Причины апуринизации:
изменение рН, ионизирующее излучение, повышение температуры и т.д.
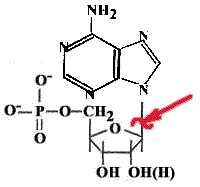
Разрывается N-гликозидная связь между пуриновым основанием и дезоксирибозой. Если бы апуриновые участки не исправлялись, то была бы катастрофа.
Пиримидины тоже могут отщепляться, но скорость этого процесса на два порядка ниже.
2. Дезаминирование.
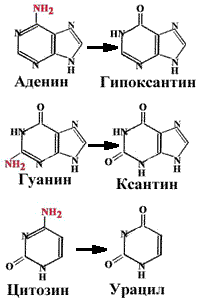
Аденин превращается в гипоксантин, который образует две водородные связи с цитозином.
Гуанин превращается в ксантин, который образует водородные связи с тимином.
При дезаминировании цитозина образуется урацил.
Тимин не может быть дезаминирован (единственный в ДНК).
Наличие тимина в ДНК (вместо урацила) позволяет отличать дезаминированнный цитозин (т.е. урацил) от законного урацила, если бы он был в ДНК.
N-гликозилаза - фермент, который узнает дезаминированное основание, разрывает N-гликозидную связь и удаляет неправильное основание.
После этого АП-специфическая эндонуклеаза вносит одноцепочечный разрыв, и фосфодиэстераза отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь размером в один нуклеотид.
У E. coli она заделывается ДНК-полимеразой I, а лигаза сшивает концы ДНК.
У эукариот брешь заделывает ДНК- полимераза .
ДНК - двуцепочечна в отличие от РНК. Наличие второй цепи обеспечивает исправление ошибок. Дезоксирибоза более устойчива, чем рибоза, к действию щелочи, т.е. при рН > 8, ДНК устойчива, а РНК- нет.
3. Тиминовые димеры.
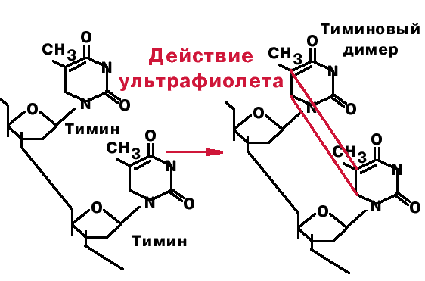
Под действием ультрафиолетого света происходит ковалентное сшивание рядом стоящих пиримидинов. При сшивании тиминов образуется циклобутановое производное, блокирующее репликацию.
Фермент фотолиаза - узнает тиминовые димеры и на свету или в темноте образует с ними комплекс. При освещении видимым светом происходит активация фермента, циклобутановое кольцо разрывается, и вновь получаются два тимина. Этот процесс называется фотореактивацией.
И дезаминированные основания, и тиминовые димеры, кроме того, могут удаляться с помощью эксцизионной репарации.
Специфические эндонуклеазы производят одноцепочечные разрезы (инцизия). Затем происходит удаление (эксцизия) нескольких нуклеотидов и заделывание бреши. У E. сoli заделыванием бреши занимается ДНК-полимераза I. Лигаза сшивает цепь. Она же ликвидирует одноцепочечные разрывы, возникающие при действии ионизирующей радиации.
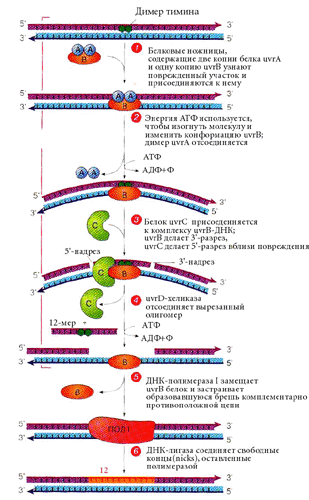
У E.coli эксцизионная репарация осуществляется мультиферментным комплексом, включающим белки uvrA, uvrB, uvrC (ultraviolet repair), которые узнают поврежденный участок и вносят 5'- и 3'- разрывы с разных сторон от него, uvrD - геликазу, которая отсоединяет вырезанный олигомер - 12 нуклеотидов, используя энергию АТФ.
У эукариот существует функциональный (но не структурный) аналог такого мультиферментативного комплекса.
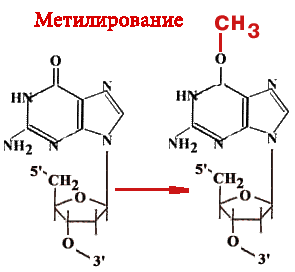
О-6-метилгуанинтрансфераза - Фермент-"самоубийца".
Имеется 14 позиций, по которым ДНК метелируется.
Гуанин может быть метилирован (по кислороду в 6-ом положении) и в такой форме будет связываться не только с цитозином, но и с тимином. Таким образом, в два шага может произойти замена пары Г-Ц на А-Т. Фермент принимает метильную группу на один из 12 цистеиновых остатков и при этом "гибнет".
Определение: геном - вся совокупность молекул ДНК клетки (в случае ряда вирусов говорят о геномной РНК).
Существует ядерный геном, митохондриальный геном и геном пластид. Мы будем рассматривать только ядерный геном. Соматические клетки содержат диплоидный (2n) геном, половые - гаплоидный (n).
Размер генома
Объект
Размер гаплоидного генома в парах нуклеотидов
Микоплазмы
104-106
Эубактерии (E.coli)
105-107
Грибы
(2-5)х107
Водоросли
(5-7)х107
Черви
108
Моллюски
5х108-5х109
Насекомые
108-5х109
Ракообразные
109
Иглокожие
2х108-2х109
Рыбы
3х108-1010
Амфибии
7х108-7х1010
Рептилии
(2-3)х109
Птицы
109
Млекопитающие
3х109
Цветковые растения
2х108-1011
Прямой корреляции между количеством ДНК и эволюционной продвинутостью организма нет.
Так, например, у малярийного плазмодия 0.06 пг ДНК в ядре, а у амебы 490 пг. Большое количество ДНК не обязательно приносит качественно новую информацию. Амеба пошла на увеличение количества ДНК для увеличения размеров ядра и самой клетки. Генов у нее меньше, чем у плазмодия, но они копированы много раз. У малярийного плазмодия генов больше, чем у амебы, а ДНК меньше для максимальной компактности. Малые размеры ядра и самого одноклеточного организма позволяют ему быть внутриклеточным паразитом.
У африканской двоякодышащей рыбы ДНК в 15 раз, а у амебы в 70 раз больше, чем у человека.
"Избыточность" эукариотического генома
На
106 пар нуклеотидов у бактерий приходится
5 тыс. генов. На
109 пар нуклеотидов у млекопитающих
50 тыс. генов.
Минусы "избыточной" ДНК:
- увеличение времени синтеза ДНК;
- cложнее организовывать удвоение ДНК;
- высокая энергоемкость - на 1 нуклеотид для включения в цепь ДНК нужно затратить
60 молекул АТФ.
Неопределенное следствие:
- благодаря зависимости размера ядра от количества ДНК происходит увеличение размеров клетки.
Плюсы "избыточной" ДНК:
- возникает возможность создания сложного регуляторного аппарата, позволяющего поднять организм на более высокий эволюционный уровень.
Причины избыточности:
1. Большой размер генов (за счет наличия интронов).
2. Присутствие повторенных последовательностей.
Повторяются и гены, и некодирующие участки. У эукариот некоторые последовательности повторены сотни и тысячи раз.
3. Наличие большого числа некодирующих последовательностей, часть из которых выполняет регуляторную функцию при транскрипции, а часть - необходима для компактизации генома.
Компактность генома эукариот
Компактность - другое принципиальное отличие генома эукариот от прокариотического генома.
При средней разнице размеров геномов на 3 порядка, линейные размеры эукариотических хромосом соизмеримы с длиной ДНК прокариот.
Выделяют, по крайней мере, 4 уровня компактизации ДНК. При этом нить ДНК "укорачивается" в 10000 раз.
Это все равно, что нить, длиной с Останкинскую башню (500 м), уложить в спичечный коробок (5см).
Два первых уровня компактизации эукариотического генома обеспечиваются гистонами.
Общая характеристика гистонов
Гистоны - основные белки.
Все они обогащены лизином и аргинином - положительно заряженными аминокислотами.
Выделяют 5 фракций гистонов.
Нарабатывается их очень много - 60 млн. молекул каждой фракции на клетку.
Фракция
Лизин
Аргинин
лиз./арг
осн.АК/кис.АК
Мол. вес (Да)
Н1 (очень богатая лизином)
29%
1%
>20
5.4
23000
Н2В (умернно богатая лизином)
16%
6%
2.5
1.7
13774
Н2А (умеренно богатая лизином и аргинином)
11%
9%
1
1.4
13960
Н4 (богатая аргинином и глицином)
11%
14%
0.8
2.5
11282
Н3 (очень богатая аргинином); в ней есть цистеин, а в других - нет
10%
13%
0.7
1.8
15348
1 2 3 4 5 6 7 8 9
Белки, участвующие в репликации ДНК E.сoli.
-
Название
Мол.вес (кДа)
Число субъединиц
Количество молекул на клетку
Функция
Гираза
gyrA
gyrB
400
210
190
4
2
2
25
суперскручивание для плавления ori
эндонуклеазная и лигазная активности
АТФ-азная активность
SSB
76
4
300
Фиксация одноцепочечной ДНК
Геликаза
I
II
III
180
75
56
1
1
1
5000
Плавление ori в репликативной вилке
Белки препрайминга
Препрайминг
priA
82
1
50
3' 5' геликаза по запаздывающей цепи, удаляет SSB
dnaT
66
3
50
n
14
2
80
n'
76
1
70
АТФ-аза
n"
17
1
dnaC
29
1
100
dna B
330
6
20
5' 3' геликаза по запаздывающей цепи
Праймаза dnaG
60
1
50
Синтез РНК-затравок (праймеров)
ДНК-полимераза III
Синтез ДНК
holo-фермент
800
260
50
20
142
104
64
160
16
2
2
2
2
2
2
4
20
полимеразная
5' 3' активность
гидролитическая
3' 5' активность
ДНК-полимераза I
109
1
300
Удаление праймеров и заполнение брешей
Лигаза
74
1
300
Сшивание фрагментов Оказаки
У E.coli один origin репликации и две репликативные вилки. Сегодня популярна модель "тромбона", согласно которой ДНК-полимераза III образует асимметричный димер и одновременно ведет непрерывный синтез лидирующей цепи и фрагментов Оказаки запаздывающей цепи.

ДНК у эукариот не кольцевая. Тогда возникает вопрос: как же достигается плавление ori?

У фага Т4 тоже не кольцевая ДНК. Субъединицы гиразы сближают несмежные участки ДНК и образуется петля. В ней и ведется суперспирализация.

У эукариот ДНК закрепляется белками в нескольких местах на ядерной мембране. На каждом отдельном участке работает топоизомераза. Сколько участков, столько и ori.
Хотя в клетке у человека ДНК на 3 порядка больше чем у E. сoli, время репликации соизмеримо (за счет большего количества ori).
Каждая эукариотическая хромосома - полирепликон.
Определение: репликон - участок ДНК между двумя ori.

Размер фрагментов Оказаки у эукариот меньше (200-400 нукл).
Скорость работы ДНК-полимераз эукариот на порядок ниже, чем у прокариот.
Организм
Количество репликонов
Средний размер репликона, тыс.п.н.
Скорость движения репликативной вилки п.н./мин.
E.сoli
1
4200
50000
Дрожжи
500
40
3600
Дрозофила
3500
40
2600
Ксенопус (лягушка)
15000
200
500
Мышь
25000
150
2200
Бобы
35000
300
2200
У эукариот РНК-затравки размером 6-10 нукл. удаляются РНК-азой Н (hybrid). Бреши заделываются репарирующими ферментами.
Проблема репликации концов линейных молекул
Модель "заячьи уши".

Работает у ряда вирусов.
Репликация концов ДНК хромосом эукариот
Удаление РНК-праймеров после завершения синтеза линейных ДНК в виде фрагментов Оказаки и заделывание образующихся между фрагментами брешей нуклеотидами ДНК приводит к тому, что дочерние цепи ДНК оказываются короче материнских на размер первого РНК-праймера (10-20 нукл.).
Образуются 3'-оверхенги, т.е. выступающие 3'-концы материнских цепей. Они узнаются теломеразой - ферментом, содержащим помимо белковой части еще и РНК, выполняющую роль матрицы для наращивания ДНК повторами.
Теломераза последовательно наращивает материнские цепи ДНК повторами, используя 3'-оверхенги в качестве затравок. Образующиеся длинные одноцепочечные концы в свою очередь служат матрицами для синтеза дочерних цепей традиционным репликативным механизмом.

Хромосомы соматических клеток человека фланкированы многократно повторенными гексамерами TTAГГГ, общая длина районов с повторами может достигать 10 тыс. пар нуклеотидов. В комплексе со специфическими белками такие тандемные повторы образуют теломеры, защищающие концы ДНК от действия экзонуклеаз, предотвращающие неправильную рекомбинацию и позволяющие концам хромосом прикрепляться к ядерной оболочке.
При каждом раунде репликации происходит укорочение теломер в среднем на 50 пар нуклеотидов. Поскольку теломерные последовательности не являются кодирующими, они выступают в роли буферной зоны - как защита от "проблемы концевой репликации".
Укорочение ДНК в ходе каждого раунда репликации лишь сокращает нетранскрибируемый текст теломеры, но не приводит к утрате смысловых последовательностей - генов и регуляторов их экспрессии.
Регуляция репликации прокариот известна, т.к. известны гены белков регуляции репликации E.сoli и механизмы их включения (выключения). Для эукариот эти механизмы еще не ясны, но известно расписание репликации ДНК по разным хромосомам.
Причины ошибок при синтезе ДНК
Способность ошибаться заложена в самой структуре фермента.
Скорее всего, ферменты, которые не ошибались, были тупиковыми ветвями эволюции. На первых этапах зарождения жизни разнообразие обеспечивалось только такими ошибками.
In vitro происходит 1 ошибка на 100 тыс. нукл. для средней ДНК-полимеразы.
In vitro можно уменьшить вероятность ошибки до 1 на 1млн. нукл., если добавить SSB, геликазу и лигазу.
Можно и увеличить вероятность ошибки до 1 на 100, если дать неадекватное количество субстрата, а также если добавить ионы серебра, бериллия, меди, кобальта, никеля, свинца. Это происходит из-за конкуренции этих ионов с ионами магния за связывание с ДНК-полимеразой.
Еще один способ повышения количества ошибок - добавление аналогов нуклеотидов. Например бромдезоксиуридина - аналога тимидина.
Это одно из средств борьбы со СПИДом и раком. Аналоги одинаково вредны для всех клеток, однако в пораженных вирусом клетках чаще проходит репликация.
Этапы проверки
Первичный отбор нуклеотидов идет по принципу комплементарности.
Способностью к этому виду отбора обладают все ДНК-полимеразы благодаря полимеризационной 5' 3' активности.
Редактирующий отбор.
Его проводят все полимеразы благодаря экзонуклеазной активности 3' 5'.
Исправление ошибок в уже синтезированной ДНК.
Этим занимаются ферменты репарации.
Вероятность ошибок для ферментов вирусов, про- и эукариот
Объект
Вероятность замены на пару оснований
E.coli
2х10-10
Дрозофила
5х10-11
Фаг Т4
2х10-8
Разницу связывают со скоростью работы фермента. Чем медленней, тем точнее!
Основные репарабельные повреждения в ДНК и принципы их устранения
1. Апуринизация.
Каждая соматическая клетка теряет за сутки около 10000 пуринов и пиримидинов. В ДНК образуются АП-сайты.
Причины апуринизации:
изменение рН, ионизирующее излучение, повышение температуры и т.д.

Разрывается N-гликозидная связь между пуриновым основанием и дезоксирибозой. Если бы апуриновые участки не исправлялись, то была бы катастрофа.
Пиримидины тоже могут отщепляться, но скорость этого процесса на два порядка ниже.
2. Дезаминирование.

Аденин превращается в гипоксантин, который образует две водородные связи с цитозином.
Гуанин превращается в ксантин, который образует водородные связи с тимином.
При дезаминировании цитозина образуется урацил.
Тимин не может быть дезаминирован (единственный в ДНК).
Наличие тимина в ДНК (вместо урацила) позволяет отличать дезаминированнный цитозин (т.е. урацил) от законного урацила, если бы он был в ДНК.
N-гликозилаза - фермент, который узнает дезаминированное основание, разрывает N-гликозидную связь и удаляет неправильное основание.
После этого АП-специфическая эндонуклеаза вносит одноцепочечный разрыв, и фосфодиэстераза отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь размером в один нуклеотид.
У E. coli она заделывается ДНК-полимеразой I, а лигаза сшивает концы ДНК.
У эукариот брешь заделывает ДНК- полимераза .
ДНК - двуцепочечна в отличие от РНК. Наличие второй цепи обеспечивает исправление ошибок. Дезоксирибоза более устойчива, чем рибоза, к действию щелочи, т.е. при рН > 8, ДНК устойчива, а РНК- нет.
3. Тиминовые димеры.

Под действием ультрафиолетого света происходит ковалентное сшивание рядом стоящих пиримидинов. При сшивании тиминов образуется циклобутановое производное, блокирующее репликацию.
Фермент фотолиаза - узнает тиминовые димеры и на свету или в темноте образует с ними комплекс. При освещении видимым светом происходит активация фермента, циклобутановое кольцо разрывается, и вновь получаются два тимина. Этот процесс называется фотореактивацией.
И дезаминированные основания, и тиминовые димеры, кроме того, могут удаляться с помощью эксцизионной репарации.
Специфические эндонуклеазы производят одноцепочечные разрезы (инцизия). Затем происходит удаление (эксцизия) нескольких нуклеотидов и заделывание бреши. У E. сoli заделыванием бреши занимается ДНК-полимераза I. Лигаза сшивает цепь. Она же ликвидирует одноцепочечные разрывы, возникающие при действии ионизирующей радиации.

У E.coli эксцизионная репарация осуществляется мультиферментным комплексом, включающим белки uvrA, uvrB, uvrC (ultraviolet repair), которые узнают поврежденный участок и вносят 5'- и 3'- разрывы с разных сторон от него, uvrD - геликазу, которая отсоединяет вырезанный олигомер - 12 нуклеотидов, используя энергию АТФ.
У эукариот существует функциональный (но не структурный) аналог такого мультиферментативного комплекса.
О-6-метилгуанинтрансфераза - Фермент-"самоубийца".
Имеется 14 позиций, по которым ДНК метелируется.
Гуанин может быть метилирован (по кислороду в 6-ом положении) и в такой форме будет связываться не только с цитозином, но и с тимином. Таким образом, в два шага может произойти замена пары Г-Ц на А-Т. Фермент принимает метильную группу на один из 12 цистеиновых остатков и при этом "гибнет".

Определение: геном - вся совокупность молекул ДНК клетки (в случае ряда вирусов говорят о геномной РНК).
Существует ядерный геном, митохондриальный геном и геном пластид. Мы будем рассматривать только ядерный геном. Соматические клетки содержат диплоидный (2n) геном, половые - гаплоидный (n).
Размер генома
Объект
Размер гаплоидного генома в парах нуклеотидов
Микоплазмы
104-106
Эубактерии (E.coli)
105-107
Грибы
(2-5)х107
Водоросли
(5-7)х107
Черви
108
Моллюски
5х108-5х109
Насекомые
108-5х109
Ракообразные
109
Иглокожие
2х108-2х109
Рыбы
3х108-1010
Амфибии
7х108-7х1010
Рептилии
(2-3)х109
Птицы
109
Млекопитающие
3х109
Цветковые растения
2х108-1011
Прямой корреляции между количеством ДНК и эволюционной продвинутостью организма нет.
Так, например, у малярийного плазмодия 0.06 пг ДНК в ядре, а у амебы 490 пг. Большое количество ДНК не обязательно приносит качественно новую информацию. Амеба пошла на увеличение количества ДНК для увеличения размеров ядра и самой клетки. Генов у нее меньше, чем у плазмодия, но они копированы много раз. У малярийного плазмодия генов больше, чем у амебы, а ДНК меньше для максимальной компактности. Малые размеры ядра и самого одноклеточного организма позволяют ему быть внутриклеточным паразитом.
У африканской двоякодышащей рыбы ДНК в 15 раз, а у амебы в 70 раз больше, чем у человека.
"Избыточность" эукариотического генома
На
106 пар нуклеотидов у бактерий приходится
5 тыс. генов. На
109 пар нуклеотидов у млекопитающих
50 тыс. генов.
Минусы "избыточной" ДНК:
- увеличение времени синтеза ДНК;
- cложнее организовывать удвоение ДНК;
- высокая энергоемкость - на 1 нуклеотид для включения в цепь ДНК нужно затратить
60 молекул АТФ.
Неопределенное следствие:
- благодаря зависимости размера ядра от количества ДНК происходит увеличение размеров клетки.
Плюсы "избыточной" ДНК:
- возникает возможность создания сложного регуляторного аппарата, позволяющего поднять организм на более высокий эволюционный уровень.
Причины избыточности:
1. Большой размер генов (за счет наличия интронов).
2. Присутствие повторенных последовательностей.
Повторяются и гены, и некодирующие участки. У эукариот некоторые последовательности повторены сотни и тысячи раз.
3. Наличие большого числа некодирующих последовательностей, часть из которых выполняет регуляторную функцию при транскрипции, а часть - необходима для компактизации генома.
Компактность генома эукариот
Компактность - другое принципиальное отличие генома эукариот от прокариотического генома.
При средней разнице размеров геномов на 3 порядка, линейные размеры эукариотических хромосом соизмеримы с длиной ДНК прокариот.
Выделяют, по крайней мере, 4 уровня компактизации ДНК. При этом нить ДНК "укорачивается" в 10000 раз.
Это все равно, что нить, длиной с Останкинскую башню (500 м), уложить в спичечный коробок (5см).
Два первых уровня компактизации эукариотического генома обеспечиваются гистонами.
Общая характеристика гистонов
Гистоны - основные белки.
Все они обогащены лизином и аргинином - положительно заряженными аминокислотами.
Выделяют 5 фракций гистонов.
Нарабатывается их очень много - 60 млн. молекул каждой фракции на клетку.
Фракция
Лизин
Аргинин
лиз./арг
осн.АК/кис.АК
Мол. вес (Да)
Н1 (очень богатая лизином)
29%
1%
>20
5.4
23000
Н2В (умернно богатая лизином)
16%
6%
2.5
1.7
13774
Н2А (умеренно богатая лизином и аргинином)
11%
9%
1
1.4
13960
Н4 (богатая аргинином и глицином)
11%
14%
0.8
2.5
11282
Н3 (очень богатая аргинином); в ней есть цистеин, а в других - нет
10%
13%
0.7
1.8
15348
1 2 3 4 5 6 7 8 9
Белки, участвующие в репликации ДНК E.сoli.
-
Название
Мол.вес (кДа)
Число субъединиц
Количество молекул на клетку
Функция
Гираза
gyrA
gyrB
400
210
190
4
2
2
25
суперскручивание для плавления ori
эндонуклеазная и лигазная активности
АТФ-азная активность
SSB
76
4
300
Фиксация одноцепочечной ДНК
Геликаза
I
II
III
180
75
56
1
1
1
5000
Плавление ori в репликативной вилке
Белки препрайминга
Препрайминг
priA
82
1
50
3' 5' геликаза по запаздывающей цепи, удаляет SSB
dnaT
66
3
50
n
14
2
80
n'
76
1
70
АТФ-аза
n"
17
1
dnaC
29
1
100
dna B
330
6
20
5' 3' геликаза по запаздывающей цепи
Праймаза dnaG
60
1
50
Синтез РНК-затравок (праймеров)
ДНК-полимераза III
Синтез ДНК
holo-фермент
800
260
50
20
142
104
64
160
16
2
2
2
2
2
2
4
20
полимеразная
5' 3' активность
гидролитическая
3' 5' активность
ДНК-полимераза I
109
1
300
Удаление праймеров и заполнение брешей
Лигаза
74
1
300
Сшивание фрагментов Оказаки
У E.coli один origin репликации и две репликативные вилки. Сегодня популярна модель "тромбона", согласно которой ДНК-полимераза III образует асимметричный димер и одновременно ведет непрерывный синтез лидирующей цепи и фрагментов Оказаки запаздывающей цепи.

ДНК у эукариот не кольцевая. Тогда возникает вопрос: как же достигается плавление ori?

У фага Т4 тоже не кольцевая ДНК. Субъединицы гиразы сближают несмежные участки ДНК и образуется петля. В ней и ведется суперспирализация.

У эукариот ДНК закрепляется белками в нескольких местах на ядерной мембране. На каждом отдельном участке работает топоизомераза. Сколько участков, столько и ori.
Хотя в клетке у человека ДНК на 3 порядка больше чем у E. сoli, время репликации соизмеримо (за счет большего количества ori).
Каждая эукариотическая хромосома - полирепликон.
Определение: репликон - участок ДНК между двумя ori.

Размер фрагментов Оказаки у эукариот меньше (200-400 нукл).
Скорость работы ДНК-полимераз эукариот на порядок ниже, чем у прокариот.
Организм
Количество репликонов
Средний размер репликона, тыс.п.н.
Скорость движения репликативной вилки п.н./мин.
E.сoli
1
4200
50000
Дрожжи
500
40
3600
Дрозофила
3500
40
2600
Ксенопус (лягушка)
15000
200
500
Мышь
25000
150
2200
Бобы
35000
300
2200
У эукариот РНК-затравки размером 6-10 нукл. удаляются РНК-азой Н (hybrid). Бреши заделываются репарирующими ферментами.
Проблема репликации концов линейных молекул
Модель "заячьи уши".

Работает у ряда вирусов.
Репликация концов ДНК хромосом эукариот
Удаление РНК-праймеров после завершения синтеза линейных ДНК в виде фрагментов Оказаки и заделывание образующихся между фрагментами брешей нуклеотидами ДНК приводит к тому, что дочерние цепи ДНК оказываются короче материнских на размер первого РНК-праймера (10-20 нукл.).
Образуются 3'-оверхенги, т.е. выступающие 3'-концы материнских цепей. Они узнаются теломеразой - ферментом, содержащим помимо белковой части еще и РНК, выполняющую роль матрицы для наращивания ДНК повторами.
Теломераза последовательно наращивает материнские цепи ДНК повторами, используя 3'-оверхенги в качестве затравок. Образующиеся длинные одноцепочечные концы в свою очередь служат матрицами для синтеза дочерних цепей традиционным репликативным механизмом.

Хромосомы соматических клеток человека фланкированы многократно повторенными гексамерами TTAГГГ, общая длина районов с повторами может достигать 10 тыс. пар нуклеотидов. В комплексе со специфическими белками такие тандемные повторы образуют теломеры, защищающие концы ДНК от действия экзонуклеаз, предотвращающие неправильную рекомбинацию и позволяющие концам хромосом прикрепляться к ядерной оболочке.
При каждом раунде репликации происходит укорочение теломер в среднем на 50 пар нуклеотидов. Поскольку теломерные последовательности не являются кодирующими, они выступают в роли буферной зоны - как защита от "проблемы концевой репликации".
Укорочение ДНК в ходе каждого раунда репликации лишь сокращает нетранскрибируемый текст теломеры, но не приводит к утрате смысловых последовательностей - генов и регуляторов их экспрессии.
Регуляция репликации прокариот известна, т.к. известны гены белков регуляции репликации E.сoli и механизмы их включения (выключения). Для эукариот эти механизмы еще не ясны, но известно расписание репликации ДНК по разным хромосомам.
Причины ошибок при синтезе ДНК
Способность ошибаться заложена в самой структуре фермента.
Скорее всего, ферменты, которые не ошибались, были тупиковыми ветвями эволюции. На первых этапах зарождения жизни разнообразие обеспечивалось только такими ошибками.
In vitro происходит 1 ошибка на 100 тыс. нукл. для средней ДНК-полимеразы.
In vitro можно уменьшить вероятность ошибки до 1 на 1млн. нукл., если добавить SSB, геликазу и лигазу.
Можно и увеличить вероятность ошибки до 1 на 100, если дать неадекватное количество субстрата, а также если добавить ионы серебра, бериллия, меди, кобальта, никеля, свинца. Это происходит из-за конкуренции этих ионов с ионами магния за связывание с ДНК-полимеразой.
Еще один способ повышения количества ошибок - добавление аналогов нуклеотидов. Например бромдезоксиуридина - аналога тимидина.
Это одно из средств борьбы со СПИДом и раком. Аналоги одинаково вредны для всех клеток, однако в пораженных вирусом клетках чаще проходит репликация.
Этапы проверки
Первичный отбор нуклеотидов идет по принципу комплементарности.
Способностью к этому виду отбора обладают все ДНК-полимеразы благодаря полимеризационной 5' 3' активности.
Редактирующий отбор.
Его проводят все полимеразы благодаря экзонуклеазной активности 3' 5'.
Исправление ошибок в уже синтезированной ДНК.
Этим занимаются ферменты репарации.
Вероятность ошибок для ферментов вирусов, про- и эукариот
Объект
Вероятность замены на пару оснований
E.coli
2х10-10
Дрозофила
5х10-11
Фаг Т4
2х10-8
Разницу связывают со скоростью работы фермента. Чем медленней, тем точнее!
Основные репарабельные повреждения в ДНК и принципы их устранения
1. Апуринизация.
Каждая соматическая клетка теряет за сутки около 10000 пуринов и пиримидинов. В ДНК образуются АП-сайты.
Причины апуринизации:
изменение рН, ионизирующее излучение, повышение температуры и т.д.

Разрывается N-гликозидная связь между пуриновым основанием и дезоксирибозой. Если бы апуриновые участки не исправлялись, то была бы катастрофа.
Пиримидины тоже могут отщепляться, но скорость этого процесса на два порядка ниже.
2. Дезаминирование.

Аденин превращается в гипоксантин, который образует две водородные связи с цитозином.
Гуанин превращается в ксантин, который образует водородные связи с тимином.
При дезаминировании цитозина образуется урацил.
Тимин не может быть дезаминирован (единственный в ДНК).
Наличие тимина в ДНК (вместо урацила) позволяет отличать дезаминированнный цитозин (т.е. урацил) от законного урацила, если бы он был в ДНК.
N-гликозилаза - фермент, который узнает дезаминированное основание, разрывает N-гликозидную связь и удаляет неправильное основание.
После этого АП-специфическая эндонуклеаза вносит одноцепочечный разрыв, и фосфодиэстераза отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь размером в один нуклеотид.
У E. coli она заделывается ДНК-полимеразой I, а лигаза сшивает концы ДНК.
У эукариот брешь заделывает ДНК- полимераза .
ДНК - двуцепочечна в отличие от РНК. Наличие второй цепи обеспечивает исправление ошибок. Дезоксирибоза более устойчива, чем рибоза, к действию щелочи, т.е. при рН > 8, ДНК устойчива, а РНК- нет.
3. Тиминовые димеры.

Под действием ультрафиолетого света происходит ковалентное сшивание рядом стоящих пиримидинов. При сшивании тиминов образуется циклобутановое производное, блокирующее репликацию.
Фермент фотолиаза - узнает тиминовые димеры и на свету или в темноте образует с ними комплекс. При освещении видимым светом происходит активация фермента, циклобутановое кольцо разрывается, и вновь получаются два тимина. Этот процесс называется фотореактивацией.
И дезаминированные основания, и тиминовые димеры, кроме того, могут удаляться с помощью эксцизионной репарации.
Специфические эндонуклеазы производят одноцепочечные разрезы (инцизия). Затем происходит удаление (эксцизия) нескольких нуклеотидов и заделывание бреши. У E. сoli заделыванием бреши занимается ДНК-полимераза I. Лигаза сшивает цепь. Она же ликвидирует одноцепочечные разрывы, возникающие при действии ионизирующей радиации.

У E.coli эксцизионная репарация осуществляется мультиферментным комплексом, включающим белки uvrA, uvrB, uvrC (ultraviolet repair), которые узнают поврежденный участок и вносят 5'- и 3'- разрывы с разных сторон от него, uvrD - геликазу, которая отсоединяет вырезанный олигомер - 12 нуклеотидов, используя энергию АТФ.
У эукариот существует функциональный (но не структурный) аналог такого мультиферментативного комплекса.
О-6-метилгуанинтрансфераза - Фермент-"самоубийца".
Имеется 14 позиций, по которым ДНК метелируется.
Гуанин может быть метилирован (по кислороду в 6-ом положении) и в такой форме будет связываться не только с цитозином, но и с тимином. Таким образом, в два шага может произойти замена пары Г-Ц на А-Т. Фермент принимает метильную группу на один из 12 цистеиновых остатков и при этом "гибнет".

Определение: геном - вся совокупность молекул ДНК клетки (в случае ряда вирусов говорят о геномной РНК).
Существует ядерный геном, митохондриальный геном и геном пластид. Мы будем рассматривать только ядерный геном. Соматические клетки содержат диплоидный (2n) геном, половые - гаплоидный (n).
Размер генома
Объект
Размер гаплоидного генома в парах нуклеотидов
Микоплазмы
104-106
Эубактерии (E.coli)
105-107
Грибы
(2-5)х107
Водоросли
(5-7)х107
Черви
108
Моллюски
5х108-5х109
Насекомые
108-5х109
Ракообразные
109
Иглокожие
2х108-2х109
Рыбы
3х108-1010
Амфибии
7х108-7х1010
Рептилии
(2-3)х109
Птицы
109
Млекопитающие
3х109
Цветковые растения
2х108-1011
Прямой корреляции между количеством ДНК и эволюционной продвинутостью организма нет.
Так, например, у малярийного плазмодия 0.06 пг ДНК в ядре, а у амебы 490 пг. Большое количество ДНК не обязательно приносит качественно новую информацию. Амеба пошла на увеличение количества ДНК для увеличения размеров ядра и самой клетки. Генов у нее меньше, чем у плазмодия, но они копированы много раз. У малярийного плазмодия генов больше, чем у амебы, а ДНК меньше для максимальной компактности. Малые размеры ядра и самого одноклеточного организма позволяют ему быть внутриклеточным паразитом.
У африканской двоякодышащей рыбы ДНК в 15 раз, а у амебы в 70 раз больше, чем у человека.
"Избыточность" эукариотического генома
На
106 пар нуклеотидов у бактерий приходится
5 тыс. генов. На
109 пар нуклеотидов у млекопитающих
50 тыс. генов.
Минусы "избыточной" ДНК:
- увеличение времени синтеза ДНК;
- cложнее организовывать удвоение ДНК;
- высокая энергоемкость - на 1 нуклеотид для включения в цепь ДНК нужно затратить
60 молекул АТФ.
Неопределенное следствие:
- благодаря зависимости размера ядра от количества ДНК происходит увеличение размеров клетки.
Плюсы "избыточной" ДНК:
- возникает возможность создания сложного регуляторного аппарата, позволяющего поднять организм на более высокий эволюционный уровень.
Причины избыточности:
1. Большой размер генов (за счет наличия интронов).
2. Присутствие повторенных последовательностей.
Повторяются и гены, и некодирующие участки. У эукариот некоторые последовательности повторены сотни и тысячи раз.
3. Наличие большого числа некодирующих последовательностей, часть из которых выполняет регуляторную функцию при транскрипции, а часть - необходима для компактизации генома.
Компактность генома эукариот
Компактность - другое принципиальное отличие генома эукариот от прокариотического генома.
При средней разнице размеров геномов на 3 порядка, линейные размеры эукариотических хромосом соизмеримы с длиной ДНК прокариот.
Выделяют, по крайней мере, 4 уровня компактизации ДНК. При этом нить ДНК "укорачивается" в 10000 раз.
Это все равно, что нить, длиной с Останкинскую башню (500 м), уложить в спичечный коробок (5см).
Два первых уровня компактизации эукариотического генома обеспечиваются гистонами.
Общая характеристика гистонов
Гистоны - основные белки.
Все они обогащены лизином и аргинином - положительно заряженными аминокислотами.
Выделяют 5 фракций гистонов.
Нарабатывается их очень много - 60 млн. молекул каждой фракции на клетку.
Фракция
Лизин
Аргинин
лиз./арг
осн.АК/кис.АК
Мол. вес (Да)
Н1 (очень богатая лизином)
29%
1%
>20
5.4
23000
Н2В (умернно богатая лизином)
16%
6%
2.5
1.7
13774
Н2А (умеренно богатая лизином и аргинином)
11%
9%
1
1.4
13960
Н4 (богатая аргинином и глицином)
11%
14%
0.8
2.5
11282
Н3 (очень богатая аргинином); в ней есть цистеин, а в других - нет
10%
13%
0.7
1.8
15348
1 2 3 4 5 6 7 8 9
Белки, участвующие в репликации ДНК E.сoli.
-
Название
Мол.вес (кДа)
Число субъединиц
Количество молекул на клетку
Функция
Гираза
gyrA
gyrB
400
210
190
4
2
2
25
суперскручивание для плавления ori
эндонуклеазная и лигазная активности
АТФ-азная активность
SSB
76
4
300
Фиксация одноцепочечной ДНК
Геликаза
I
II
III
180
75
56
1
1
1
5000
Плавление ori в репликативной вилке
Белки препрайминга
Препрайминг
priA
82
1
50
3' 5' геликаза по запаздывающей цепи, удаляет SSB
dnaT
66
3
50
n
14
2
80
n'
76
1
70
АТФ-аза
n"
17
1
dnaC
29
1
100
dna B
330
6
20
5' 3' геликаза по запаздывающей цепи
Праймаза dnaG
60
1
50
Синтез РНК-затравок (праймеров)
ДНК-полимераза III
Синтез ДНК
holo-фермент
800
260
50
20
142
104
64
160
16
2
2
2
2
2
2
4
20
полимеразная
5' 3' активность
гидролитическая
3' 5' активность
ДНК-полимераза I
109
1
300
Удаление праймеров и заполнение брешей
Лигаза
74
1
300
Сшивание фрагментов Оказаки
У E.coli один origin репликации и две репликативные вилки. Сегодня популярна модель "тромбона", согласно которой ДНК-полимераза III образует асимметричный димер и одновременно ведет непрерывный синтез лидирующей цепи и фрагментов Оказаки запаздывающей цепи.

ДНК у эукариот не кольцевая. Тогда возникает вопрос: как же достигается плавление ori?

У фага Т4 тоже не кольцевая ДНК. Субъединицы гиразы сближают несмежные участки ДНК и образуется петля. В ней и ведется суперспирализация.

У эукариот ДНК закрепляется белками в нескольких местах на ядерной мембране. На каждом отдельном участке работает топоизомераза. Сколько участков, столько и ori.
Хотя в клетке у человека ДНК на 3 порядка больше чем у E. сoli, время репликации соизмеримо (за счет большего количества ori).
Каждая эукариотическая хромосома - полирепликон.
Определение: репликон - участок ДНК между двумя ori.

Размер фрагментов Оказаки у эукариот меньше (200-400 нукл).
Скорость работы ДНК-полимераз эукариот на порядок ниже, чем у прокариот.
Организм
Количество репликонов
Средний размер репликона, тыс.п.н.
Скорость движения репликативной вилки п.н./мин.
E.сoli
1
4200
50000
Дрожжи
500
40
3600
Дрозофила
3500
40
2600
Ксенопус (лягушка)
15000
200
500
Мышь
25000
150
2200
Бобы
35000
300
2200
У эукариот РНК-затравки размером 6-10 нукл. удаляются РНК-азой Н (hybrid). Бреши заделываются репарирующими ферментами.
Проблема репликации концов линейных молекул
Модель "заячьи уши".

Работает у ряда вирусов.
Репликация концов ДНК хромосом эукариот
Удаление РНК-праймеров после завершения синтеза линейных ДНК в виде фрагментов Оказаки и заделывание образующихся между фрагментами брешей нуклеотидами ДНК приводит к тому, что дочерние цепи ДНК оказываются короче материнских на размер первого РНК-праймера (10-20 нукл.).
Образуются 3'-оверхенги, т.е. выступающие 3'-концы материнских цепей. Они узнаются теломеразой - ферментом, содержащим помимо белковой части еще и РНК, выполняющую роль матрицы для наращивания ДНК повторами.
Теломераза последовательно наращивает материнские цепи ДНК повторами, используя 3'-оверхенги в качестве затравок. Образующиеся длинные одноцепочечные концы в свою очередь служат матрицами для синтеза дочерних цепей традиционным репликативным механизмом.

Хромосомы соматических клеток человека фланкированы многократно повторенными гексамерами TTAГГГ, общая длина районов с повторами может достигать 10 тыс. пар нуклеотидов. В комплексе со специфическими белками такие тандемные повторы образуют теломеры, защищающие концы ДНК от действия экзонуклеаз, предотвращающие неправильную рекомбинацию и позволяющие концам хромосом прикрепляться к ядерной оболочке.
При каждом раунде репликации происходит укорочение теломер в среднем на 50 пар нуклеотидов. Поскольку теломерные последовательности не являются кодирующими, они выступают в роли буферной зоны - как защита от "проблемы концевой репликации".
Укорочение ДНК в ходе каждого раунда репликации лишь сокращает нетранскрибируемый текст теломеры, но не приводит к утрате смысловых последовательностей - генов и регуляторов их экспрессии.
Регуляция репликации прокариот известна, т.к. известны гены белков регуляции репликации E.сoli и механизмы их включения (выключения). Для эукариот эти механизмы еще не ясны, но известно расписание репликации ДНК по разным хромосомам.
Причины ошибок при синтезе ДНК
Способность ошибаться заложена в самой структуре фермента.
Скорее всего, ферменты, которые не ошибались, были тупиковыми ветвями эволюции. На первых этапах зарождения жизни разнообразие обеспечивалось только такими ошибками.
In vitro происходит 1 ошибка на 100 тыс. нукл. для средней ДНК-полимеразы.
In vitro можно уменьшить вероятность ошибки до 1 на 1млн. нукл., если добавить SSB, геликазу и лигазу.
Можно и увеличить вероятность ошибки до 1 на 100, если дать неадекватное количество субстрата, а также если добавить ионы серебра, бериллия, меди, кобальта, никеля, свинца. Это происходит из-за конкуренции этих ионов с ионами магния за связывание с ДНК-полимеразой.
Еще один способ повышения количества ошибок - добавление аналогов нуклеотидов. Например бромдезоксиуридина - аналога тимидина.
Это одно из средств борьбы со СПИДом и раком. Аналоги одинаково вредны для всех клеток, однако в пораженных вирусом клетках чаще проходит репликация.
Этапы проверки
Первичный отбор нуклеотидов идет по принципу комплементарности.
Способностью к этому виду отбора обладают все ДНК-полимеразы благодаря полимеризационной 5' 3' активности.
Редактирующий отбор.
Его проводят все полимеразы благодаря экзонуклеазной активности 3' 5'.
Исправление ошибок в уже синтезированной ДНК.
Этим занимаются ферменты репарации.
Вероятность ошибок для ферментов вирусов, про- и эукариот
Объект
Вероятность замены на пару оснований
E.coli
2х10-10
Дрозофила
5х10-11
Фаг Т4
2х10-8
Разницу связывают со скоростью работы фермента. Чем медленней, тем точнее!
Основные репарабельные повреждения в ДНК и принципы их устранения
1. Апуринизация.
Каждая соматическая клетка теряет за сутки около 10000 пуринов и пиримидинов. В ДНК образуются АП-сайты.
Причины апуринизации:
изменение рН, ионизирующее излучение, повышение температуры и т.д.

Разрывается N-гликозидная связь между пуриновым основанием и дезоксирибозой. Если бы апуриновые участки не исправлялись, то была бы катастрофа.
Пиримидины тоже могут отщепляться, но скорость этого процесса на два порядка ниже.
2. Дезаминирование.

Аденин превращается в гипоксантин, который образует две водородные связи с цитозином.
Гуанин превращается в ксантин, который образует водородные связи с тимином.
При дезаминировании цитозина образуется урацил.
Тимин не может быть дезаминирован (единственный в ДНК).
Наличие тимина в ДНК (вместо урацила) позволяет отличать дезаминированнный цитозин (т.е. урацил) от законного урацила, если бы он был в ДНК.
N-гликозилаза - фермент, который узнает дезаминированное основание, разрывает N-гликозидную связь и удаляет неправильное основание.
После этого АП-специфическая эндонуклеаза вносит одноцепочечный разрыв, и фосфодиэстераза отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь размером в один нуклеотид.
У E. coli она заделывается ДНК-полимеразой I, а лигаза сшивает концы ДНК.
У эукариот брешь заделывает ДНК- полимераза .
ДНК - двуцепочечна в отличие от РНК. Наличие второй цепи обеспечивает исправление ошибок. Дезоксирибоза более устойчива, чем рибоза, к действию щелочи, т.е. при рН > 8, ДНК устойчива, а РНК- нет.
3. Тиминовые димеры.

Под действием ультрафиолетого света происходит ковалентное сшивание рядом стоящих пиримидинов. При сшивании тиминов образуется циклобутановое производное, блокирующее репликацию.
Фермент фотолиаза - узнает тиминовые димеры и на свету или в темноте образует с ними комплекс. При освещении видимым светом происходит активация фермента, циклобутановое кольцо разрывается, и вновь получаются два тимина. Этот процесс называется фотореактивацией.
И дезаминированные основания, и тиминовые димеры, кроме того, могут удаляться с помощью эксцизионной репарации.
Специфические эндонуклеазы производят одноцепочечные разрезы (инцизия). Затем происходит удаление (эксцизия) нескольких нуклеотидов и заделывание бреши. У E. сoli заделыванием бреши занимается ДНК-полимераза I. Лигаза сшивает цепь. Она же ликвидирует одноцепочечные разрывы, возникающие при действии ионизирующей радиации.

У E.coli эксцизионная репарация осуществляется мультиферментным комплексом, включающим белки uvrA, uvrB, uvrC (ultraviolet repair), которые узнают поврежденный участок и вносят 5'- и 3'- разрывы с разных сторон от него, uvrD - геликазу, которая отсоединяет вырезанный олигомер - 12 нуклеотидов, используя энергию АТФ.
У эукариот существует функциональный (но не структурный) аналог такого мультиферментативного комплекса.
О-6-метилгуанинтрансфераза - Фермент-"самоубийца".
Имеется 14 позиций, по которым ДНК метелируется.
Гуанин может быть метилирован (по кислороду в 6-ом положении) и в такой форме будет связываться не только с цитозином, но и с тимином. Таким образом, в два шага может произойти замена пары Г-Ц на А-Т. Фермент принимает метильную группу на один из 12 цистеиновых остатков и при этом "гибнет".

Определение: геном - вся совокупность молекул ДНК клетки (в случае ряда вирусов говорят о геномной РНК).
Существует ядерный геном, митохондриальный геном и геном пластид. Мы будем рассматривать только ядерный геном. Соматические клетки содержат диплоидный (2n) геном, половые - гаплоидный (n).
Размер генома
Объект
Размер гаплоидного генома в парах нуклеотидов
Микоплазмы
104-106
Эубактерии (E.coli)
105-107
Грибы
(2-5)х107
Водоросли
(5-7)х107
Черви
108
Моллюски
5х108-5х109
Насекомые
108-5х109
Ракообразные
109
Иглокожие
2х108-2х109
Рыбы
3х108-1010
Амфибии
7х108-7х1010
Рептилии
(2-3)х109
Птицы
109
Млекопитающие
3х109
Цветковые растения
2х108-1011
Прямой корреляции между количеством ДНК и эволюционной продвинутостью организма нет.
Так, например, у малярийного плазмодия 0.06 пг ДНК в ядре, а у амебы 490 пг. Большое количество ДНК не обязательно приносит качественно новую информацию. Амеба пошла на увеличение количества ДНК для увеличения размеров ядра и самой клетки. Генов у нее меньше, чем у плазмодия, но они копированы много раз. У малярийного плазмодия генов больше, чем у амебы, а ДНК меньше для максимальной компактности. Малые размеры ядра и самого одноклеточного организма позволяют ему быть внутриклеточным паразитом.
У африканской двоякодышащей рыбы ДНК в 15 раз, а у амебы в 70 раз больше, чем у человека.
"Избыточность" эукариотического генома
На
106 пар нуклеотидов у бактерий приходится
5 тыс. генов. На
109 пар нуклеотидов у млекопитающих
50 тыс. генов.
Минусы "избыточной" ДНК:
- увеличение времени синтеза ДНК;
- cложнее организовывать удвоение ДНК;
- высокая энергоемкость - на 1 нуклеотид для включения в цепь ДНК нужно затратить
60 молекул АТФ.
Белки, участвующие в репликации ДНК E.сoli.
-
Название
Мол.вес (кДа)
Число субъединиц
Количество молекул на клетку
Функция
Гираза
gyrA
gyrB
400
210
190
4
2
2
25
суперскручивание для плавления ori
эндонуклеазная и лигазная активности
АТФ-азная активность
SSB
76
4
300
Фиксация одноцепочечной ДНК
Геликаза
I
II
III
180
75
56
1
1
1
5000
Плавление ori в репликативной вилке
Белки препрайминга
Препрайминг
priA
82
1
50
3' 5' геликаза по запаздывающей цепи, удаляет SSB
dnaT
66
3
50
n
14
2
80
n'
76
1
70
АТФ-аза
n"
17
1
dnaC
29
1
100
dna B
330
6
20
5' 3' геликаза по запаздывающей цепи
Праймаза dnaG
60
1
50
Синтез РНК-затравок (праймеров)
ДНК-полимераза III
Синтез ДНК
holo-фермент
800
260
50
20
142
104
64
160
16
2
2
2
2
2
2
4
20
полимеразная
5' 3' активность
гидролитическая
3' 5' активность
ДНК-полимераза I
109
1
300
Удаление праймеров и заполнение брешей
Лигаза
74
1
300
Сшивание фрагментов Оказаки
У E.coli один origin репликации и две репликативные вилки. Сегодня популярна модель "тромбона", согласно которой ДНК-полимераза III образует асимметричный димер и одновременно ведет непрерывный синтез лидирующей цепи и фрагментов Оказаки запаздывающей цепи.

ДНК у эукариот не кольцевая. Тогда возникает вопрос: как же достигается плавление ori?

У фага Т4 тоже не кольцевая ДНК. Субъединицы гиразы сближают несмежные участки ДНК и образуется петля. В ней и ведется суперспирализация.

У эукариот ДНК закрепляется белками в нескольких местах на ядерной мембране. На каждом отдельном участке работает топоизомераза. Сколько участков, столько и ori.
Хотя в клетке у человека ДНК на 3 порядка больше чем у E. сoli, время репликации соизмеримо (за счет большего количества ori).
Каждая эукариотическая хромосома - полирепликон.
Определение: репликон - участок ДНК между двумя ori.

Размер фрагментов Оказаки у эукариот меньше (200-400 нукл).
Скорость работы ДНК-полимераз эукариот на порядок ниже, чем у прокариот.
Организм
Количество репликонов
Средний размер репликона, тыс.п.н.
Скорость движения репликативной вилки п.н./мин.
E.сoli
1
4200
50000
Дрожжи
500
40
3600
Дрозофила
3500
40
2600
Ксенопус (лягушка)
15000
200
500
Мышь
25000
150
2200
Бобы
35000
300
2200
У эукариот РНК-затравки размером 6-10 нукл. удаляются РНК-азой Н (hybrid). Бреши заделываются репарирующими ферментами.
Проблема репликации концов линейных молекул
Модель "заячьи уши".

Работает у ряда вирусов.
Репликация концов ДНК хромосом эукариот
Удаление РНК-праймеров после завершения синтеза линейных ДНК в виде фрагментов Оказаки и заделывание образующихся между фрагментами брешей нуклеотидами ДНК приводит к тому, что дочерние цепи ДНК оказываются короче материнских на размер первого РНК-праймера (10-20 нукл.).
Образуются 3'-оверхенги, т.е. выступающие 3'-концы материнских цепей. Они узнаются теломеразой - ферментом, содержащим помимо белковой части еще и РНК, выполняющую роль матрицы для наращивания ДНК повторами.
Теломераза последовательно наращивает материнские цепи ДНК повторами, используя 3'-оверхенги в качестве затравок. Образующиеся длинные одноцепочечные концы в свою очередь служат матрицами для синтеза дочерних цепей традиционным репликативным механизмом.

Хромосомы соматических клеток человека фланкированы многократно повторенными гексамерами TTAГГГ, общая длина районов с повторами может достигать 10 тыс. пар нуклеотидов. В комплексе со специфическими белками такие тандемные повторы образуют теломеры, защищающие концы ДНК от действия экзонуклеаз, предотвращающие неправильную рекомбинацию и позволяющие концам хромосом прикрепляться к ядерной оболочке.
При каждом раунде репликации происходит укорочение теломер в среднем на 50 пар нуклеотидов. Поскольку теломерные последовательности не являются кодирующими, они выступают в роли буферной зоны - как защита от "проблемы концевой репликации".
Укорочение ДНК в ходе каждого раунда репликации лишь сокращает нетранскрибируемый текст теломеры, но не приводит к утрате смысловых последовательностей - генов и регуляторов их экспрессии.
Регуляция репликации прокариот известна, т.к. известны гены белков регуляции репликации E.сoli и механизмы их включения (выключения). Для эукариот эти механизмы еще не ясны, но известно расписание репликации ДНК по разным хромосомам.
Причины ошибок при синтезе ДНК
Способность ошибаться заложена в самой структуре фермента.
Скорее всего, ферменты, которые не ошибались, были тупиковыми ветвями эволюции. На первых этапах зарождения жизни разнообразие обеспечивалось только такими ошибками.
In vitro происходит 1 ошибка на 100 тыс. нукл. для средней ДНК-полимеразы.
In vitro можно уменьшить вероятность ошибки до 1 на 1млн. нукл., если добавить SSB, геликазу и лигазу.
Можно и увеличить вероятность ошибки до 1 на 100, если дать неадекватное количество субстрата, а также если добавить ионы серебра, бериллия, меди, кобальта, никеля, свинца. Это происходит из-за конкуренции этих ионов с ионами магния за связывание с ДНК-полимеразой.
Еще один способ повышения количества ошибок - добавление аналогов нуклеотидов. Например бромдезоксиуридина - аналога тимидина.
Это одно из средств борьбы со СПИДом и раком. Аналоги одинаково вредны для всех клеток, однако в пораженных вирусом клетках чаще проходит репликация.
Этапы проверки
Первичный отбор нуклеотидов идет по принципу комплементарности.
Способностью к этому виду отбора обладают все ДНК-полимеразы благодаря полимеризационной 5' 3' активности.
Редактирующий отбор.
Его проводят все полимеразы благодаря экзонуклеазной активности 3' 5'.
Исправление ошибок в уже синтезированной ДНК.
Этим занимаются ферменты репарации.
Вероятность ошибок для ферментов вирусов, про- и эукариот
Объект
Вероятность замены на пару оснований
E.coli
2х10-10
Дрозофила
5х10-11
Фаг Т4
2х10-8
Разницу связывают со скоростью работы фермента. Чем медленней, тем точнее!
Основные репарабельные повреждения в ДНК и принципы их устранения
1. Апуринизация.
Каждая соматическая клетка теряет за сутки около 10000 пуринов и пиримидинов. В ДНК образуются АП-сайты.
Причины апуринизации:
изменение рН, ионизирующее излучение, повышение температуры и т.д.

Разрывается N-гликозидная связь между пуриновым основанием и дезоксирибозой. Если бы апуриновые участки не исправлялись, то была бы катастрофа.
Пиримидины тоже могут отщепляться, но скорость этого процесса на два порядка ниже.
2. Дезаминирование.

Аденин превращается в гипоксантин, который образует две водородные связи с цитозином.
Гуанин превращается в ксантин, который образует водородные связи с тимином.
При дезаминировании цитозина образуется урацил.
Тимин не может быть дезаминирован (единственный в ДНК).
Наличие тимина в ДНК (вместо урацила) позволяет отличать дезаминированнный цитозин (т.е. урацил) от законного урацила, если бы он был в ДНК.
N-гликозилаза - фермент, который узнает дезаминированное основание, разрывает N-гликозидную связь и удаляет неправильное основание.
После этого АП-специфическая эндонуклеаза вносит одноцепочечный разрыв, и фосфодиэстераза отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь размером в один нуклеотид.
У E. coli она заделывается ДНК-полимеразой I, а лигаза сшивает концы ДНК.
У эукариот брешь заделывает ДНК- полимераза .
ДНК - двуцепочечна в отличие от РНК. Наличие второй цепи обеспечивает исправление ошибок. Дезоксирибоза более устойчива, чем рибоза, к действию щелочи, т.е. при рН > 8, ДНК устойчива, а РНК- нет.
3. Тиминовые димеры.

Под действием ультрафиолетого света происходит ковалентное сшивание рядом стоящих пиримидинов. При сшивании тиминов образуется циклобутановое производное, блокирующее репликацию.
Фермент фотолиаза - узнает тиминовые димеры и на свету или в темноте образует с ними комплекс. При освещении видимым светом происходит активация фермента, циклобутановое кольцо разрывается, и вновь получаются два тимина. Этот процесс называется фотореактивацией.
И дезаминированные основания, и тиминовые димеры, кроме того, могут удаляться с помощью эксцизионной репарации.
Специфические эндонуклеазы производят одноцепочечные разрезы (инцизия). Затем происходит удаление (эксцизия) нескольких нуклеотидов и заделывание бреши. У E. сoli заделыванием бреши занимается ДНК-полимераза I. Лигаза сшивает цепь. Она же ликвидирует одноцепочечные разрывы, возникающие при действии ионизирующей радиации.

У E.coli эксцизионная репарация осуществляется мультиферментным комплексом, включающим белки uvrA, uvrB, uvrC (ultraviolet repair), которые узнают поврежденный участок и вносят 5'- и 3'- разрывы с разных сторон от него, uvrD - геликазу, которая отсоединяет вырезанный олигомер - 12 нуклеотидов, используя энергию АТФ.
У эукариот существует функциональный (но не структурный) аналог такого мультиферментативного комплекса.
О-6-метилгуанинтрансфераза - Фермент-"самоубийца".
Имеется 14 позиций, по которым ДНК метелируется.
Гуанин может быть метилирован (по кислороду в 6-ом положении) и в такой форме будет связываться не только с цитозином, но и с тимином. Таким образом, в два шага может произойти замена пары Г-Ц на А-Т. Фермент принимает метильную группу на один из 12 цистеиновых остатков и при этом "гибнет".

Определение: геном - вся совокупность молекул ДНК клетки (в случае ряда вирусов говорят о геномной РНК).
Существует ядерный геном, митохондриальный геном и геном пластид. Мы будем рассматривать только ядерный геном. Соматические клетки содержат диплоидный (2n) геном, половые - гаплоидный (n).
Размер генома
Объект
Размер гаплоидного генома в парах нуклеотидов
Микоплазмы
104-106
Эубактерии (E.coli)
105-107
Грибы
(2-5)х107
Водоросли
(5-7)х107
Черви
108
Моллюски
5х108-5х109
Насекомые
108-5х109
Ракообразные
109
Иглокожие
2х108-2х109
Рыбы
3х108-1010
Амфибии
7х108-7х1010
Рептилии
(2-3)х109
Птицы
109
Млекопитающие
3х109
Цветковые растения
2х108-1011
Прямой корреляции между количеством ДНК и эволюционной продвинутостью организма нет.
Так, например, у малярийного плазмодия 0.06 пг ДНК в ядре, а у амебы 490 пг. Большое количество ДНК не обязательно приносит качественно новую информацию. Амеба пошла на увеличение количества ДНК для увеличения размеров ядра и самой клетки. Генов у нее меньше, чем у плазмодия, но они копированы много раз. У малярийного плазмодия генов больше, чем у амебы, а ДНК меньше для максимальной компактности. Малые размеры ядра и самого одноклеточного организма позволяют ему быть внутриклеточным паразитом.
У африканской двоякодышащей рыбы ДНК в 15 раз, а у амебы в 70 раз больше, чем у человека.
"Избыточность" эукариотического генома
На
106 пар нуклеотидов у бактерий приходится
5 тыс. генов. На
109 пар нуклеотидов у млекопитающих
Белки, участвующие в репликации ДНК E.сoli.
-
Название
Мол.вес (кДа)
Число субъединиц
Количество молекул на клетку
Функция
Гираза
gyrA
gyrB
400
210
190
4
2
2
25
суперскручивание для плавления ori
эндонуклеазная и лигазная активности
АТФ-азная активность
SSB
76
4
300
Фиксация одноцепочечной ДНК
Геликаза
I
II
III
180
75
56
1
1
1
5000
Плавление ori в репликативной вилке
Белки препрайминга
Препрайминг
priA
82
1
50
3' 5' геликаза по запаздывающей цепи, удаляет SSB
dnaT
66
3
50
n
14
2
80
n'
76
1
70
АТФ-аза
n"
17
1
dnaC
29
1
100
dna B
330
6
20
5' 3' геликаза по запаздывающей цепи
Праймаза dnaG
60
1
50
Синтез РНК-затравок (праймеров)
ДНК-полимераза III
Синтез ДНК
holo-фермент
800
260
50
20
142
104
64
160
16
2
2
2
2
2
2
4
20
полимеразная
5' 3' активность
гидролитическая
3' 5' активность
ДНК-полимераза I
109
1
300
Удаление праймеров и заполнение брешей
Лигаза
74
1
300
Сшивание фрагментов Оказаки
У E.coli один origin репликации и две репликативные вилки. Сегодня популярна модель "тромбона", согласно которой ДНК-полимераза III образует асимметричный димер и одновременно ведет непрерывный синтез лидирующей цепи и фрагментов Оказаки запаздывающей цепи.

ДНК у эукариот не кольцевая. Тогда возникает вопрос: как же достигается плавление ori?

У фага Т4 тоже не кольцевая ДНК. Субъединицы гиразы сближают несмежные участки ДНК и образуется петля. В ней и ведется суперспирализация.

У эукариот ДНК закрепляется белками в нескольких местах на ядерной мембране. На каждом отдельном участке работает топоизомераза. Сколько участков, столько и ori.
Хотя в клетке у человека ДНК на 3 порядка больше чем у E. сoli, время репликации соизмеримо (за счет большего количества ori).
Каждая эукариотическая хромосома - полирепликон.
Определение: репликон - участок ДНК между двумя ori.

Размер фрагментов Оказаки у эукариот меньше (200-400 нукл).
Скорость работы ДНК-полимераз эукариот на порядок ниже, чем у прокариот.
Организм
Количество репликонов
Средний размер репликона, тыс.п.н.
Скорость движения репликативной вилки п.н./мин.
E.сoli
1
4200
50000
Дрожжи
500
40
3600
Дрозофила
3500
40
2600
Ксенопус (лягушка)
15000
200
500
Мышь
25000
150
2200
Бобы
35000
300
2200
У эукариот РНК-затравки размером 6-10 нукл. удаляются РНК-азой Н (hybrid). Бреши заделываются репарирующими ферментами.
Проблема репликации концов линейных молекул
Модель "заячьи уши".

Работает у ряда вирусов.
Репликация концов ДНК хромосом эукариот
Удаление РНК-праймеров после завершения синтеза линейных ДНК в виде фрагментов Оказаки и заделывание образующихся между фрагментами брешей нуклеотидами ДНК приводит к тому, что дочерние цепи ДНК оказываются короче материнских на размер первого РНК-праймера (10-20 нукл.).
Образуются 3'-оверхенги, т.е. выступающие 3'-концы материнских цепей. Они узнаются теломеразой - ферментом, содержащим помимо белковой части еще и РНК, выполняющую роль матрицы для наращивания ДНК повторами.
Теломераза последовательно наращивает материнские цепи ДНК повторами, используя 3'-оверхенги в качестве затравок. Образующиеся длинные одноцепочечные концы в свою очередь служат матрицами для синтеза дочерних цепей традиционным репликативным механизмом.

Хромосомы соматических клеток человека фланкированы многократно повторенными гексамерами TTAГГГ, общая длина районов с повторами может достигать 10 тыс. пар нуклеотидов. В комплексе со специфическими белками такие тандемные повторы образуют теломеры, защищающие концы ДНК от действия экзонуклеаз, предотвращающие неправильную рекомбинацию и позволяющие концам хромосом прикрепляться к ядерной оболочке.
При каждом раунде репликации происходит укорочение теломер в среднем на 50 пар нуклеотидов. Поскольку теломерные последовательности не являются кодирующими, они выступают в роли буферной зоны - как защита от "проблемы концевой репликации".
Укорочение ДНК в ходе каждого раунда репликации лишь сокращает нетранскрибируемый текст теломеры, но не приводит к утрате смысловых последовательностей - генов и регуляторов их экспрессии.
Регуляция репликации прокариот известна, т.к. известны гены белков регуляции репликации E.сoli и механизмы их включения (выключения). Для эукариот эти механизмы еще не ясны, но известно расписание репликации ДНК по разным хромосомам.
Причины ошибок при синтезе ДНК
Способность ошибаться заложена в самой структуре фермента.
Скорее всего, ферменты, которые не ошибались, были тупиковыми ветвями эволюции. На первых этапах зарождения жизни разнообразие обеспечивалось только такими ошибками.
In vitro происходит 1 ошибка на 100 тыс. нукл. для средней ДНК-полимеразы.
In vitro можно уменьшить вероятность ошибки до 1 на 1млн. нукл., если добавить SSB, геликазу и лигазу.
Можно и увеличить вероятность ошибки до 1 на 100, если дать неадекватное количество субстрата, а также если добавить ионы серебра, бериллия, меди, кобальта, никеля, свинца. Это происходит из-за конкуренции этих ионов с ионами магния за связывание с ДНК-полимеразой.
Еще один способ повышения количества ошибок - добавление аналогов нуклеотидов. Например бромдезоксиуридина - аналога тимидина.
Это одно из средств борьбы со СПИДом и раком. Аналоги одинаково вредны для всех клеток, однако в пораженных вирусом клетках чаще проходит репликация.
Этапы проверки
Первичный отбор нуклеотидов идет по принципу комплементарности.
Способностью к этому виду отбора обладают все ДНК-полимеразы благодаря полимеризационной 5' 3' активности.
Редактирующий отбор.
Его проводят все полимеразы благодаря экзонуклеазной активности 3' 5'.
Исправление ошибок в уже синтезированной ДНК.
Этим занимаются ферменты репарации.
Вероятность ошибок для ферментов вирусов, про- и эукариот
Объект
Вероятность замены на пару оснований
E.coli
2х10-10
Дрозофила
5х10-11
Фаг Т4
2х10-8
Разницу связывают со скоростью работы фермента. Чем медленней, тем точнее!
Основные репарабельные повреждения в ДНК и принципы их устранения
1. Апуринизация.
Каждая соматическая клетка теряет за сутки около 10000 пуринов и пиримидинов. В ДНК образуются АП-сайты.
Причины апуринизации:
изменение рН, ионизирующее излучение, повышение температуры и т.д.

Разрывается N-гликозидная связь между пуриновым основанием и дезоксирибозой. Если бы апуриновые участки не исправлялись, то была бы катастрофа.
Пиримидины тоже могут отщепляться, но скорость этого процесса на два порядка ниже.
2. Дезаминирование.

Аденин превращается в гипоксантин, который образует две водородные связи с цитозином.
Гуанин превращается в ксантин, который образует водородные связи с тимином.
При дезаминировании цитозина образуется урацил.
Тимин не может быть дезаминирован (единственный в ДНК).
Наличие тимина в ДНК (вместо урацила) позволяет отличать дезаминированнный цитозин (т.е. урацил) от законного урацила, если бы он был в ДНК.
N-гликозилаза - фермент, который узнает дезаминированное основание, разрывает N-гликозидную связь и удаляет неправильное основание.
После этого АП-специфическая эндонуклеаза вносит одноцепочечный разрыв, и фосфодиэстераза отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь размером в один нуклеотид.
У E. coli она заделывается ДНК-полимеразой I, а лигаза сшивает концы ДНК.
У эукариот брешь заделывает ДНК- полимераза .
ДНК - двуцепочечна в отличие от РНК. Наличие второй цепи обеспечивает исправление ошибок. Дезоксирибоза более устойчива, чем рибоза, к действию щелочи, т.е. при рН > 8, ДНК устойчива, а РНК- нет.
3. Тиминовые димеры.

Под действием ультрафиолетого света происходит ковалентное сшивание рядом стоящих пиримидинов. При сшивании тиминов образуется циклобутановое производное, блокирующее репликацию.
Фермент фотолиаза - узнает тиминовые димеры и на свету или в темноте образует с ними комплекс. При освещении видимым светом происходит активация фермента, циклобутановое кольцо разрывается, и вновь получаются два тимина. Этот процесс называется фотореактивацией.
И дезаминированные основания, и тиминовые димеры, кроме того, могут удаляться с помощью эксцизионной репарации.
Специфические эндонуклеазы производят одноцепочечные разрезы (инцизия). Затем происходит удаление (эксцизия) нескольких нуклеотидов и заделывание бреши. У E. сoli заделыванием бреши занимается ДНК-полимераза I. Лигаза сшивает цепь. Она же ликвидирует одноцепочечные разрывы, возникающие при действии ионизирующей радиации.

У E.coli эксцизионная репарация осуществляется мультиферментным комплексом, включающим белки uvrA, uvrB, uvrC (ultraviolet repair), которые узнают поврежденный участок и вносят 5'- и 3'- разрывы с разных сторон от него, uvrD - геликазу, которая отсоединяет вырезанный олигомер - 12 нуклеотидов, используя энергию АТФ.
У эукариот существует функциональный (но не структурный) аналог такого мультиферментативного комплекса.
О-6-метилгуанинтрансфераза - Фермент-"самоубийца".
Имеется 14 позиций, по которым ДНК метелируется.
Гуанин может быть метилирован (по кислороду в 6-ом положении) и в такой форме будет связываться не только с цитозином, но и с тимином. Таким образом, в два шага может произойти замена пары Г-Ц на А-Т. Фермент принимает метильную группу на один из 12 цистеиновых остатков и при этом "гибнет".

Определение: геном - вся совокупность молекул ДНК клетки (в случае ряда вирусов говорят о геномной РНК).
Существует ядерный геном, митохондриальный геном и геном пластид. Мы будем рассматривать только ядерный геном. Соматические клетки содержат диплоидный (2n) геном, половые - гаплоидный (n).
Размер генома
Объект
Размер гаплоидного генома в парах нуклеотидов
Микоплазмы
104-106
Эубактерии (E.coli)
105-107
Грибы
(2-5)х107
Водоросли
(5-7)х107
Черви
108
Моллюски
5х108-5х109
Насекомые
108-5х109
Ракообразные
109
Иглокожие
2х108-2х109
Рыбы
3х108-1010
Амфибии
7х108-7х1010
Рептилии
(2-3)х109
Птицы
109
Млекопитающие
3х109
Цветковые растения
2х108-1011
Прямой корреляции между количеством ДНК и эволюционной продвинутостью организма нет.
Так, например, у малярийного плазмодия 0.06 пг ДНК в ядре, а у амебы 490 пг. Большое количество ДНК не обязательно приносит качественно новую информацию. Амеба пошла на увеличение количества ДНК для увеличения размеров ядра и самой клетки. Генов у нее меньше, чем у плазмодия, но они копированы много раз. У малярийного плазмодия генов больше, чем у амебы, а ДНК меньше для максимальной компактности. Малые размеры ядра и самого одноклеточного организма позволяют ему быть внутриклеточным паразитом.
У африканской двоякодышащей рыбы ДНК в 15 раз, а у амебы в 70 раз больше, чем у человека.
"Избыточность" эукариотического генома
На
106 пар нуклеотидов у бактерий приходится
-
Название
Мол.вес (кДа)
Число субъединиц
Количество молекул на клетку
Функция
Гираза
gyrA
gyrB
400
210
190
4
2
2
25
суперскручивание для плавления ori
эндонуклеазная и лигазная активности
АТФ-азная активность
SSB
76
4
300
Фиксация одноцепочечной ДНК
Геликаза
I
II
III
180
75
56
1
1
1
5000
Плавление ori в репликативной вилке
Белки препрайминга
Препрайминг
priA
82
1
50
3' 5' геликаза по запаздывающей цепи, удаляет SSB
dnaT
66
3
50
n
14
2
80
n'
76
1
70
АТФ-аза
n"
17
1
dnaC
29
1
100
dna B
330
6
20
5' 3' геликаза по запаздывающей цепи
Праймаза dnaG
60
1
50
Синтез РНК-затравок (праймеров)
ДНК-полимераза III
Синтез ДНК
holo-фермент
800
260
50
20
142
104
64
160
16
2
2
2
2
2
2
4
20
полимеразная
5' 3' активность
гидролитическая
3' 5' активность
ДНК-полимераза I
109
1
300
Удаление праймеров и заполнение брешей
Лигаза
74
1
300
Сшивание фрагментов Оказаки
 | У фага Т4 тоже не кольцевая ДНК. Субъединицы гиразы сближают несмежные участки ДНК и образуется петля. В ней и ведется суперспирализация. |
 | У эукариот ДНК закрепляется белками в нескольких местах на ядерной мембране. На каждом отдельном участке работает топоизомераза. Сколько участков, столько и ori. |
| Определение: репликон - участок ДНК между двумя ori. |  |
| Организм | Количество репликонов | Средний размер репликона, тыс.п.н. | Скорость движения репликативной вилки п.н./мин. |
| E.сoli | 1 | 4200 | 50000 |
| Дрожжи | 500 | 40 | 3600 |
| Дрозофила | 3500 | 40 | 2600 |
| Ксенопус (лягушка) | 15000 | 200 | 500 |
| Мышь | 25000 | 150 | 2200 |
| Бобы | 35000 | 300 | 2200 |
 | Работает у ряда вирусов. |
 |
| Объект | Вероятность замены на пару оснований |
| E.coli | 2х10-10 |
| Дрозофила | 5х10-11 |
| Фаг Т4 | 2х10-8 |
 | Разрывается N-гликозидная связь между пуриновым основанием и дезоксирибозой. Если бы апуриновые участки не исправлялись, то была бы катастрофа. |
 | Аденин превращается в гипоксантин, который образует две водородные связи с цитозином. Гуанин превращается в ксантин, который образует водородные связи с тимином. При дезаминировании цитозина образуется урацил. Тимин не может быть дезаминирован (единственный в ДНК). |
 | Под действием ультрафиолетого света происходит ковалентное сшивание рядом стоящих пиримидинов. При сшивании тиминов образуется циклобутановое производное, блокирующее репликацию. |
 | У E.coli эксцизионная репарация осуществляется мультиферментным комплексом, включающим белки uvrA, uvrB, uvrC (ultraviolet repair), которые узнают поврежденный участок и вносят 5'- и 3'- разрывы с разных сторон от него, uvrD - геликазу, которая отсоединяет вырезанный олигомер - 12 нуклеотидов, используя энергию АТФ. У эукариот существует функциональный (но не структурный) аналог такого мультиферментативного комплекса. |
| Гуанин может быть метилирован (по кислороду в 6-ом положении) и в такой форме будет связываться не только с цитозином, но и с тимином. Таким образом, в два шага может произойти замена пары Г-Ц на А-Т. Фермент принимает метильную группу на один из 12 цистеиновых остатков и при этом "гибнет". |  |
| Объект | Размер гаплоидного генома в парах нуклеотидов |
| Микоплазмы | 104-106 |
| Эубактерии (E.coli) | 105-107 |
| Грибы | (2-5)х107 |
| Водоросли | (5-7)х107 |
| Черви | 108 |
| Моллюски | 5х108-5х109 |
| Насекомые | 108-5х109 |
| Ракообразные | 109 |
| Иглокожие | 2х108-2х109 |
| Рыбы | 3х108-1010 |
| Амфибии | 7х108-7х1010 |
| Рептилии | (2-3)х109 |
| Птицы | 109 |
| Млекопитающие | 3х109 |
| Цветковые растения | 2х108-1011 |
Неопределенное следствие:
- благодаря зависимости размера ядра от количества ДНК происходит увеличение размеров клетки.
Плюсы "избыточной" ДНК:
- возникает возможность создания сложного регуляторного аппарата, позволяющего поднять организм на более высокий эволюционный уровень.
Причины избыточности:
1. Большой размер генов (за счет наличия интронов).
2. Присутствие повторенных последовательностей.
Повторяются и гены, и некодирующие участки. У эукариот некоторые последовательности повторены сотни и тысячи раз.
3. Наличие большого числа некодирующих последовательностей, часть из которых выполняет регуляторную функцию при транскрипции, а часть - необходима для компактизации генома.
Компактность генома эукариот
Компактность - другое принципиальное отличие генома эукариот от прокариотического генома.
При средней разнице размеров геномов на 3 порядка, линейные размеры эукариотических хромосом соизмеримы с длиной ДНК прокариот.
Выделяют, по крайней мере, 4 уровня компактизации ДНК. При этом нить ДНК "укорачивается" в 10000 раз.
Это все равно, что нить, длиной с Останкинскую башню (500 м), уложить в спичечный коробок (5см).
Два первых уровня компактизации эукариотического генома обеспечиваются гистонами.
Общая характеристика гистонов
Гистоны - основные белки.
Все они обогащены лизином и аргинином - положительно заряженными аминокислотами.
Выделяют 5 фракций гистонов.
Нарабатывается их очень много - 60 млн. молекул каждой фракции на клетку.
| Фракция | Лизин | Аргинин | лиз./арг | осн.АК/кис.АК | Мол. вес (Да) |
| Н1 (очень богатая лизином) | 29% | 1% | >20 | 5.4 | 23000 |
| Н2В (умернно богатая лизином) | 16% | 6% | 2.5 | 1.7 | 13774 |
| Н2А (умеренно богатая лизином и аргинином) | 11% | 9% | 1 | 1.4 | 13960 |
| Н4 (богатая аргинином и глицином) | 11% | 14% | 0.8 | 2.5 | 11282 |
| Н3 (очень богатая аргинином); в ней есть цистеин, а в других - нет | 10% | 13% | 0.7 | 1.8 | 15348 |
1 2 3 4 5 6 7 8 9
Все гистоны, кроме Н1, черезвычайно консервативны в эволюционном отношении (у коровы и клевера разница в Н2А всего в одну аминокислоту!).
Следовательно, эти белки выполняют принципиальную функцию, которая у всех эукариот обеспечивается одинаково.
Любая мутация в гистоновых генах летальна.
Н1 - очень вариабельная фракция. Этот гистон различен не только у видов, но даже у одного организма, в зависимости от стадий онтогенеза.
В гистонах лизин и аргинин кластированы. Средняя часть гистона содержит гидрофобные аминокислоты.
Положительно заряженные аминокислоты гистонов обеспечивают электростатические взаимодействия с ДНК.
Центральная часть необходима для взаимодействия гистонов между собой.
Четыре уровня компактизации ДНК
1. Нуклеосомный.
В основе нуклеосомы лежит гистоновый октамер.
Расположение гистонов не случайно. Каждая молекула представлена дважды. Они образуют кор (серцевину) нуклеосомы. На кор наматывается ДНК - 1.75 левых витка спирали.
Определение: нуклеосомой называется повторяющийся структурный элемент хроматина, содержащий гистоновый октамер и
180 п.н. ДНК.
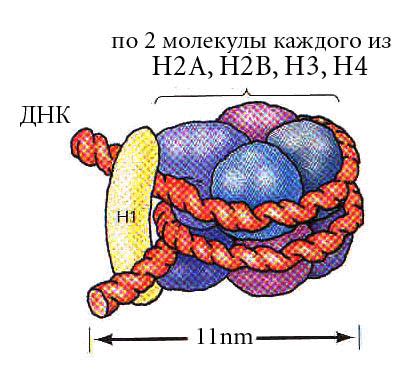
Непосредственно с октамером контактирует 145 п.н. и 20-30-40 п.н. между нуклеосомными корами.
Нуклеосомный уровень упаковки свойственен всей эукариотической ДНК, он дает укорочение в 7 раз. Диаметр увеличивается с 20 Å до 110 Å.
Гистоновые октамеры "скользят" по ДНК.
При репликации снимается и этот уровень компактизации. При транскрипции нуклеосомы сохраняются.
2. Супербидный, или соленоидный.
Фактически обеспечивается Н1 гистоном.
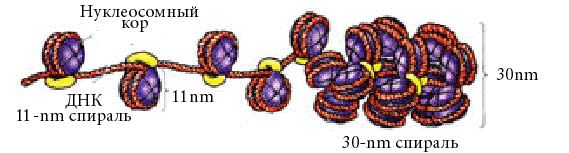
Н1 взаимодействует с октамерами, сближает их, и еще на него наматывется ДНК. Образуется супербид.
Происходит сокращение линейного размера ДНК в 6-10 раз. Диаметр увеличивается до 300Å.
Этот уровень компактизации, как и первый, не зависит от первичной структуры ДНК.
3. Петлевой уровень.
Обеспечивается негистоновыми белками.
Они узнают определенные последовательности ДНК и связываются с ними и друг другом, образуя петли по 20-80 тыс. п.н.

Петля обеспечивает экспрессию гена, т.е петля является не только структурным, но и функциональным образованием.
Есть участки, в которых нет петель.Укорочение за счет петель проходит в 20-30 раз. Образуются и петлевые домены. Диаметр увеличивается до 700Å.
4. Метафазная хромосома.

Метафазная хромосома уже удвоена. Она состоит из двух хроматид. Каждая из них содержит одну молекулу ДНК.
Сюда входят белки ядерной ламины, серия белковых нитей, сопряженных с ядерной оболочкой и пронизывающих все ядро.
Модификации гистонов очень сильно влияют на компактизацию ДНК.
Гистоны могут метилироваться, фосфорилироваться (по серину, треонину, тирозину), т.е. аминокислотные остатки легко модифицируются. Кроме того, возможно алкилирование и ацетилирование гистонов.
Геном высших эукариот А-Т типа (пары А-Т преобладают), низших эукариот - Г-Ц типа. У человека соотношение (Г+Ц)/(А+Т) = 0.45. У разных типов бактерий диапазон соотношения А-Т пар и Г-Ц пар велик.
Чем больше в геноме А-Т пар, тем больше возможностей для изменения вторичной структуры ДНК. При суперспирализации ДНК А-Т богатые участки плавятся в первую очередь.
Основы метода ренатурации ДНК
ДНК обрабатывают ультразвуком. При этом она деградирует на двуцепочечные куски одинакового размера.
Затем смесь денатурируют и медленно охлаждают.
При температуре на 20 С ниже, чем температура плавления ДНК, идет восстановление вторичной структуры (ренатурация).
Если последовательности часто встречаются, то они ренатурируют быстрее.
В процессе ренатурации выделяют две стадии:
1. Бимолекулярная стадия нуклеации.
Образуется несколько "ядер"- участков спаривания.
Описывается реакцией второго порядка ( ).
).
2. Мономолекулярная стадия замыкания.
Скорость реакции пропорционально первой степени концентрации ДНК.
Это дальнейшее образование водородных связей - замыкание.
Процесс ренатурации описывается уравнением:  ,
,
где k - константа скорости ренатурации,
С - концентрация одноцепочечной ДНК.
В нулевой момент времени .
Тогда 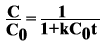 .
.
Если , то 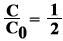 , и это полуренатурация.
, и это полуренатурация.
Таким образом мы получили характеристику для описания разных молекул ДНК или их частей.
По значению можно выделить 3 фракции:
1. Быстрые повторы.
меньше 0,01 .
Частота встречаемости на гаплоидный геном больше 105.
2. Умеренные повторы.
от 0,01 до 1000 .
Частота встречаемости на гаплоидный геном больше 10, но меньше 105.
3. Уникальные последовательности.
больше 1000 .
Частота встречаемости меньше 10 раз на геном.
Есть отдельные последовательности, которые по значению относятся к одному классу, а по частоте встречаемости - к другому. Это - палиндромы. Они ренатурируют мгновенно, т.к. отсутствует поиск комплементарной цепи, а их встречаемость в геноме может быть низка.
Значение у палиндромов такое же, как и у быстрых повторов, а встречаемость, как у уников или умеренных повторов. У некоторых организмов, например, у черепах, 20% ДНК - палиндромы. В среднем у животных от 2% до 12% генома приходится на палиндромы. У растений - от 1% до 4% (у пшеницы 3 млн. обращенных повторов). Они могут содержать от нескольких десятков до десятков тысяч нуклеотидов. Наиболее часто палиндромы встречаются в регуляторных участках генов.
Гены tРНК - часто встречаемые палиндромы.
Быстрые повторы
К быстрым повторам относится сателлитная ДНК.
Особенности:
1. В этой короткой последовательности (6-10 нукл.) отсутствует один из нуклеотидов. Отсюда следует, что эта ДНК не может быть кодирующей, она никогда не транслируется. Встречается в конститутивном гетерохроматине.
Хромосома не гомогенна. В ней чередуются участки гетерохроматина (более плотный) и эухроматина (не плотные участки). В основном гены располагаются в эухроматине. Но встречаются и в гетерохроматиновых районах.
В зависимости от стадий клеточного цикла один и тот же участок хромосомы может быть в состоянинии как гетеро-, так и эухроматина. Такие участки хромосом называют факультативным гетерохроматином.
Участки, которые всегда уплотнены - конститутивный гетерохроматин. В нем, как правило, генов нет.
2. Сателлитная ДНК обязательно располагается в центромерном районе.
В местах расположения сателлитной ДНК возможна максимальная компактизация. В конститутивном гетерохроматине все четыре уровня упаковки ДНК представлены даже в интерфазе.
По сателлитной ДНК происходит кроссинговер между гомологичными хромосомами.
3. Сателлитная ДНК всегда располагается тандемно по 100-200 единиц в блоке. Образуются длинные последовательности в геноме.
4. У недавно образовавшихся на одной территории близких видов сателлитная ДНК заведомо разная.
Это обеспечивает бесплодие возможных межвидовых гибридов.
Умеренные повторы
К умеренным повторам относят как транскрибируемые и транслируемые, так и только транскрибируемые, но нетранслируемые последовательности ДНК и регуляторные участки.
Умеренные повторы
гены
регуляторные участки
транскрибируемые и
транслируемые
Гены белков рибосом, гистоновые гены, гены мембранных белков, цитоскелетных белков, гены иммуноглобулинов
транскрибируемые, но не
нетранслируемые Гены rРНК, sРНК, tРНК
энхансерные модули, ori репликации, промоторы и терминаторы транскрипции
Гены tРНК в среднем повторяются в геноме 5 тыс. раз. Гены sРНК - сотни тысяч раз.
Уникальные гены
У человека, по разным оценкам, 30-50 тыс. генов. Большинство генов - уникальны. Но даже в них есть повторяющиеся элементы. Это - некоторые экзоны.
Все гены разделяют на гены "домашнего хозяйства" и гены "роскоши".
Гены "домашнего хозяйства" кодируют то, что всегда нужно любой клетке независимо от ткани.
По разным оценкам таких генов у человека 10-20 тыс. Это гистоновые гены, гены tРНК, rРНК и т.п. Гены "роскоши", которых заведомо больше в 2-3 раза, это гены, которые экспрессируются в клетках определенных тканей и в определенное время. Например, все гены белковых гормонов - гены "роскоши".
Другая классификация генов
1. Уникальные гены, имеющие специализированную функцию.
Например, глобиновый, инсулиновый и другие гены. Они экспрессируются лишь в определенных клетках.
2. Уникальные гены, обладающие общими функциями, экспрессирующиеся в подавляющем большинстве клеток.
Эти гены плохо изучены.
3. Множественные сгруппированные гены.
Это гены rРНК, часть генов tРНК, часть гистоновых генов.
4. Множественные рассеянные гены.
Это оставшаяся часть гистоновых генов, оставшиеся гены tРНК и большинство генов sРНК, а так же МДГ (мобильные диспергированные (рассеяные) гены).
В 40-х годах Барбара Мак-Клинток, американский генетик, обнаружила мозаичность окраски зерен у кукурузы, небъяснимую законами Менделя и мутационной теорией.
Она предположила, что некоторые гены могут менять свое место в геноме.
Определение: мобильные генетические элементы (МГЭ) - это последовательности нуклеотидов, меняющие свою локализацию и копийность в геноме.
Выделяют следущие классы МГЭ:
1. IS - вставочные элементы у прокариот.
2. Tn - транспозоны у прокариот.
3. Эписомы у прокариот.
4. Некоторые умеренные фаги.
5. Контролирующие элементы кукурузы.
6. Мобильные диспергированные гены у дрозофилы, мыши, человека.
7. Провирусы.
В литературе "транспозоны" - все мобильные генетические элементы. Это элементы генома, которые меняют свое положение и копийность в геноме.
IS-элементы
Это самые простые транспозоны.
Размер IS-элементов
1000 п.н. На концах они содержат инвертированные повторы (
20 п.н.). IS- элементы содержат только один ген - ген транспозазы, фермента, обеспечивающего перемещение IS-элемента по геному.
Все гистоны, кроме Н1, черезвычайно консервативны в эволюционном отношении (у коровы и клевера разница в Н2А всего в одну аминокислоту!).
Следовательно, эти белки выполняют принципиальную функцию, которая у всех эукариот обеспечивается одинаково.
Любая мутация в гистоновых генах летальна.
Н1 - очень вариабельная фракция. Этот гистон различен не только у видов, но даже у одного организма, в зависимости от стадий онтогенеза.
В гистонах лизин и аргинин кластированы. Средняя часть гистона содержит гидрофобные аминокислоты.
Положительно заряженные аминокислоты гистонов обеспечивают электростатические взаимодействия с ДНК.
Центральная часть необходима для взаимодействия гистонов между собой.
Четыре уровня компактизации ДНК
1. Нуклеосомный.

В основе нуклеосомы лежит гистоновый октамер.
Расположение гистонов не случайно. Каждая молекула представлена дважды. Они образуют кор (серцевину) нуклеосомы. На кор наматывается ДНК - 1.75 левых витка спирали.
Определение: нуклеосомой называется повторяющийся структурный элемент хроматина, содержащий гистоновый октамер и
180 п.н. ДНК.  | В основе нуклеосомы лежит гистоновый октамер. Расположение гистонов не случайно. Каждая молекула представлена дважды. Они образуют кор (серцевину) нуклеосомы. На кор наматывается ДНК - 1.75 левых витка спирали. |
 | Непосредственно с октамером контактирует 145 п.н. и 20-30-40 п.н. между нуклеосомными корами. Нуклеосомный уровень упаковки свойственен всей эукариотической ДНК, он дает укорочение в 7 раз. Диаметр увеличивается с 20 Å до 110 Å. |
Гистоновые октамеры "скользят" по ДНК.
При репликации снимается и этот уровень компактизации. При транскрипции нуклеосомы сохраняются.
2. Супербидный, или соленоидный.
Фактически обеспечивается Н1 гистоном.
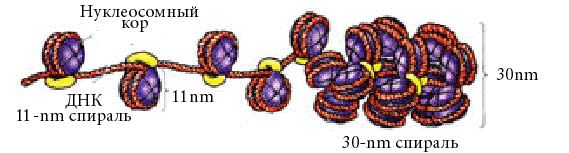 | Н1 взаимодействует с октамерами, сближает их, и еще на него наматывется ДНК. Образуется супербид. |
Происходит сокращение линейного размера ДНК в 6-10 раз. Диаметр увеличивается до 300Å.
Этот уровень компактизации, как и первый, не зависит от первичной структуры ДНК.
3. Петлевой уровень.
| Обеспечивается негистоновыми белками. Они узнают определенные последовательности ДНК и связываются с ними и друг другом, образуя петли по 20-80 тыс. п.н. |  |
Петля обеспечивает экспрессию гена, т.е петля является не только структурным, но и функциональным образованием.
Есть участки, в которых нет петель.Укорочение за счет петель проходит в 20-30 раз. Образуются и петлевые домены. Диаметр увеличивается до 700Å.
4. Метафазная хромосома.
| | Метафазная хромосома уже удвоена. Она состоит из двух хроматид. Каждая из них содержит одну молекулу ДНК. |
Сюда входят белки ядерной ламины, серия белковых нитей, сопряженных с ядерной оболочкой и пронизывающих все ядро.
Модификации гистонов очень сильно влияют на компактизацию ДНК.
Гистоны могут метилироваться, фосфорилироваться (по серину, треонину, тирозину), т.е. аминокислотные остатки легко модифицируются. Кроме того, возможно алкилирование и ацетилирование гистонов.
Геном высших эукариот А-Т типа (пары А-Т преобладают), низших эукариот - Г-Ц типа. У человека соотношение (Г+Ц)/(А+Т) = 0.45. У разных типов бактерий диапазон соотношения А-Т пар и Г-Ц пар велик.
Чем больше в геноме А-Т пар, тем больше возможностей для изменения вторичной структуры ДНК. При суперспирализации ДНК А-Т богатые участки плавятся в первую очередь.
Основы метода ренатурации ДНК
ДНК обрабатывают ультразвуком. При этом она деградирует на двуцепочечные куски одинакового размера.
Затем смесь денатурируют и медленно охлаждают.
При температуре на 20 С ниже, чем температура плавления ДНК, идет восстановление вторичной структуры (ренатурация).
Если последовательности часто встречаются, то они ренатурируют быстрее.
В процессе ренатурации выделяют две стадии:
1. Бимолекулярная стадия нуклеации.
Образуется несколько "ядер"- участков спаривания.
Описывается реакцией второго порядка (
2. Мономолекулярная стадия замыкания.
Скорость реакции пропорционально первой степени концентрации ДНК.
Это дальнейшее образование водородных связей - замыкание.
Процесс ренатурации описывается уравнением:
где k - константа скорости ренатурации,
С - концентрация одноцепочечной ДНК.
В нулевой момент времени .
Тогда
Если , то
Таким образом мы получили характеристику для описания разных молекул ДНК или их частей.
По значению можно выделить 3 фракции:
1. Быстрые повторы.
меньше 0,01 .
Частота встречаемости на гаплоидный геном больше 105.
2. Умеренные повторы.
от 0,01 до 1000 .
Частота встречаемости на гаплоидный геном больше 10, но меньше 105.
3. Уникальные последовательности.
больше 1000 .
Частота встречаемости меньше 10 раз на геном.
Есть отдельные последовательности, которые по значению относятся к одному классу, а по частоте встречаемости - к другому. Это - палиндромы. Они ренатурируют мгновенно, т.к. отсутствует поиск комплементарной цепи, а их встречаемость в геноме может быть низка.
Значение у палиндромов такое же, как и у быстрых повторов, а встречаемость, как у уников или умеренных повторов. У некоторых организмов, например, у черепах, 20% ДНК - палиндромы. В среднем у животных от 2% до 12% генома приходится на палиндромы. У растений - от 1% до 4% (у пшеницы 3 млн. обращенных повторов). Они могут содержать от нескольких десятков до десятков тысяч нуклеотидов. Наиболее часто палиндромы встречаются в регуляторных участках генов.
Гены tРНК - часто встречаемые палиндромы.
Быстрые повторы
К быстрым повторам относится сателлитная ДНК.
Особенности:
1. В этой короткой последовательности (6-10 нукл.) отсутствует один из нуклеотидов. Отсюда следует, что эта ДНК не может быть кодирующей, она никогда не транслируется. Встречается в конститутивном гетерохроматине.
Хромосома не гомогенна. В ней чередуются участки гетерохроматина (более плотный) и эухроматина (не плотные участки). В основном гены располагаются в эухроматине. Но встречаются и в гетерохроматиновых районах.
В зависимости от стадий клеточного цикла один и тот же участок хромосомы может быть в состоянинии как гетеро-, так и эухроматина. Такие участки хромосом называют факультативным гетерохроматином.
Участки, которые всегда уплотнены - конститутивный гетерохроматин. В нем, как правило, генов нет.
2. Сателлитная ДНК обязательно располагается в центромерном районе.
В местах расположения сателлитной ДНК возможна максимальная компактизация. В конститутивном гетерохроматине все четыре уровня упаковки ДНК представлены даже в интерфазе.
По сателлитной ДНК происходит кроссинговер между гомологичными хромосомами.
3. Сателлитная ДНК всегда располагается тандемно по 100-200 единиц в блоке. Образуются длинные последовательности в геноме.
4. У недавно образовавшихся на одной территории близких видов сателлитная ДНК заведомо разная.
Это обеспечивает бесплодие возможных межвидовых гибридов.
Умеренные повторы
К умеренным повторам относят как транскрибируемые и транслируемые, так и только транскрибируемые, но нетранслируемые последовательности ДНК и регуляторные участки.
| Умеренные повторы | ||
| гены | регуляторные участки | |
| транскрибируемые и транслируемые Гены белков рибосом, гистоновые гены, гены мембранных белков, цитоскелетных белков, гены иммуноглобулинов | транскрибируемые, но не нетранслируемые Гены rРНК, sРНК, tРНК | энхансерные модули, ori репликации, промоторы и терминаторы транскрипции |
Гены tРНК в среднем повторяются в геноме 5 тыс. раз. Гены sРНК - сотни тысяч раз.
Уникальные гены
У человека, по разным оценкам, 30-50 тыс. генов. Большинство генов - уникальны. Но даже в них есть повторяющиеся элементы. Это - некоторые экзоны.
Все гены разделяют на гены "домашнего хозяйства" и гены "роскоши".
Гены "домашнего хозяйства" кодируют то, что всегда нужно любой клетке независимо от ткани.
По разным оценкам таких генов у человека 10-20 тыс. Это гистоновые гены, гены tРНК, rРНК и т.п. Гены "роскоши", которых заведомо больше в 2-3 раза, это гены, которые экспрессируются в клетках определенных тканей и в определенное время. Например, все гены белковых гормонов - гены "роскоши".
Другая классификация генов
1. Уникальные гены, имеющие специализированную функцию.
Например, глобиновый, инсулиновый и другие гены. Они экспрессируются лишь в определенных клетках.
2. Уникальные гены, обладающие общими функциями, экспрессирующиеся в подавляющем большинстве клеток.
Эти гены плохо изучены.
3. Множественные сгруппированные гены.
Это гены rРНК, часть генов tРНК, часть гистоновых генов.
4. Множественные рассеянные гены.
Это оставшаяся часть гистоновых генов, оставшиеся гены tРНК и большинство генов sРНК, а так же МДГ (мобильные диспергированные (рассеяные) гены).
В 40-х годах Барбара Мак-Клинток, американский генетик, обнаружила мозаичность окраски зерен у кукурузы, небъяснимую законами Менделя и мутационной теорией.
Она предположила, что некоторые гены могут менять свое место в геноме.
Определение: мобильные генетические элементы (МГЭ) - это последовательности нуклеотидов, меняющие свою локализацию и копийность в геноме.
Выделяют следущие классы МГЭ:
1. IS - вставочные элементы у прокариот.
2. Tn - транспозоны у прокариот.
3. Эписомы у прокариот.
4. Некоторые умеренные фаги.
5. Контролирующие элементы кукурузы.
6. Мобильные диспергированные гены у дрозофилы, мыши, человека.
7. Провирусы.
В литературе "транспозоны" - все мобильные генетические элементы. Это элементы генома, которые меняют свое положение и копийность в геноме.
IS-элементы
Это самые простые транспозоны.
Размер IS-элементов
Транспозаза - это обобщеный термин.
Разные транспозазы работают по-разному, но смысл общий:
транспозаза вырезает ДНК в одном месте и вставляет в другое место генома.
Перед геном в IS-элементе имеется промотор, за геном - слабый терминатор транскрипции. Не всегда РНК-полимераза останавливается на нем, она может продолжать транскрибировать и рядом стоящий участок генома до сильного терминатора.
Tn-транспозоны
Помимо гена транспозазы Tn-транспозоны содержат один или несколько генов лекарственной устойчивости. Копийность транспозона возрастает при наличии провокационного фона (например, наличие в среде антибиотика, ген устойчивости к которому кодируется в транспозоне).
Есть транспозоны, не содержащие гена транспозазы.
 | Такие транспозоны содержат по краям IS-элементы. |
Размер транспозонов - 2.5-10 тыс. п. н.
Всем транспозонам свойственно наличие прямых повторов, LTR (long terminal repeats - длинные концевые повторы)
После перехода из основной ДНК в плазмиду транспозон может попасть с ней в другую бактерию, придавая новому хозяину ранее отсутствующую лекарственную устойчивость. Кроме того, при вырезании транспозона из геномной бактериальной ДНК захватываются участки генома одной бактерии, которые вместе с транспозоном переносятся в другую бактерию. Захват ДНК происходит, если эта ДНК находится между двумя транспозонами.
Умеренные фаги
-фаг может захватывать часть генетической информации одной бактерии и переносить ее в другую. Поэтому сегодня говорят о едином генофонде прокариот.
Эффекты, вызываемые мобильными элементами
- Внедрение мобильных элементов внутрь гена приводит к выключению гена.
- Может нарушаться регуляция гена, если мобильный элемент внедряется между оператором и цистроном (у мобильного элемента есть свой промотор).
- Вставка мобильного элемента может привести к экспрессии генов, которые не должны в данное время работать.
Наличие мобильных элементов является фактором, способствующим незаконной рекомбинации.
При незаконной рекомбинации перетасовываются гены, не имеющие отношения друг к другу.
Мобильные элементы провоцируют образование делеций, инверсий, дупликаций. Все это - хромосомные мутации.
 |  |
Некоторые вирусы - на самом деле тоже мобильные элементы. В форме провируса они находятся в геноме клетки хозяина, а потом могут начать перемещаться. Это, например, онкорнавирусы, являющиеся ретровирусами.
Молекулярные основы канцерогенеза
Признаки трансформированной клетки
1. Неконтролируемое деление.
Искажен клеточный цикл. Продолжителен S-период. Стадия G2 сведена к минимуму. Клетка вступает в митоз неготовой.
Последствия: нарушения при расхождении хромосом.
Высокая потребность в энергии. При этом в элокачественных клетках гликолиз (идущий без кислорода) превалирует над окислительным фосфорилированием.
2. Клетки перестают узнавать друг друга.
Происходит утрата контактного торможения. Это связано с изменением мембранных белков - белков-рецепторов и пр.
Нарушается адгезия (прилипание к поверхности).
3. Раковые клетки дедифференцированы.
Теории рака
До 70-х годов существовало три теории рака:
1. Канцерогенная теория.
Известны професиональные раковые заболевания: рак кожи у трубочистов, рак губы у кровельщиков и пр.
Бензпирен - первый описанный канцероген.
Определение: