ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 26.10.2023
Просмотров: 150
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Билет 32Алкены. Реакции

Правило Марковникова(богатый богатеет):
старая формулировка: в реакциях присоединения галогеноводородов и воды к несимметричным алкенам атом водорода присоединяется к наиболее гидрогенизированному (гидрированному) атому углерода.
современная формулировка: реакции электрофильного присоединения несимметричных реагентов к несимметричным ненасыщенным соединениям протекают через образование наиболее устойчивого карбокатиона.
Реакции электрофильного присоединения AE – с разрывом π-связи:
Разберем подробно одну из реакций, н-р, гидрохлорирование (+HCl):
Схема с указанием реакционных центров, эффектов и атаки:
Механизм:
Роль кислотного катализа – формирование электрофильной частицы:
Замещение по правилу Марковникова – заместители у двойной связи – электродонорные
Замещение против правила Марковникова – заместители у двойной связи - электроакцепторные
Реакции электрофильного присоединения AE:
1. Гидрогалогенирование алкадиенов
При присоединении несимметричных молекул (H2O, HHal) к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи.
2. Присоединение галогенов (+Hal2)
Основная реакция при комнатной температуре (1,4-присоединение):
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
Механизм:
Особенность сопряженных диенов состоит в том, что две двойные связи в их молекулах функционируют как единое целое, поэтому реакции присоединения могут протекать в двух направлениях:
-
к одной из двойных связей (1,2-присоединение) -
или в крайние положения сопряжённой системы с образованием новой двойной связи в центре системы (1,4-присоединение).
Моносахариды.
Углеводы. Моносахариды – простейшие углеводы, природные гетерофункциональные органические соединения, являющиеся оксопроизводными многоатомных спиртов. Соответствуют общей формуле Сх(H2O)у. По расположению карбонильной группы (С=О) делятся:
Альдозы в названии имеют окончание –оза (галактоза), а кетоны –улоза (галактулоза), исключение – фруктоза.
В зависимости от общего числа атомов углерода в молекуле моносахариды подразделяют на триозы (С3), тетрозы (С4), пентозы (С5), гексозы (С6), гептозы (С7) и т. д
Стереоизомерия.
Хиральный (т. е. асимметричный) атом C – атом углерода с четырьмя различными заместителями. Первый (три заместителя) и последний (два одинаковых) углерод в моносахаридах нехиральный.
D- и L-изомеры – пара энантиомеров (зеркальных отражений друг друга). Если –ОН-группа у наиболее удалённого "хирального" атома C от карбонильной группы, располагается слева, то такой энантиомер обозначают символом L (лат. lævus — левый), если же она располагается справа, то это D-энантиомер (лат. dexter — правый). Почти все природные моносахариды принадлежат к D-ряду. Каждая пара энантиомеров моносахаридов имеет свое тривиальное название.
Эпимеры — -диастереомеры, различающиеся конфигурацией только одного из нескольких асимметрических атомов углерода.
Пентозы:
Открытые формы (линейные) изображаются в проекциях Фишера (картинки выше), а циклические формы моносахаридов обычно изображают в виде формул Хеуорса, которые в большей степени соответствуют реальному расположению атомов в пространстве.
Пятичленные циклы называют фуранозами, а шестичленные — пиранозами.
Таутомерные превращения или цикло-оксо таутомерия – переход из цепной формы углевода (где есть оксогруппа) в циклическую форму (пиранозу или фуранозу) в результате внутримолекулярной циклизации (читай по слогам) – нападения ОН-группы на электрофильный центр карбонильной. Такие превращения происходят в водных растворах.
Каждая из таутомерных форм обладает собственным значением оптической активности, поэтому оптическая активность свежеприготовленного раствора углевода изменяется до некоторого усредненного значения. Это явление называется мутаротацией.
Аномеры — стереоизомеры циклических форм моносахаридов, различающиеся конфигурацией образующегося аномерного атома углерода, т.е. атома углерода, у которого имеется полуацетальная (гликозидная) гидроксильная группа.
-
α-аномер – гликозидный гидроксил (-ОН) находится под циклом в формуле Хеорса. -
β-аномер - гликозидный гидроксил (-ОН) находится над циклом в формуле Хеуорса.
Билет 13
Кислотные и основные свойства органических соединений; теории Брёнстеда-Лоури и Льюиса. Типы органических кислот
Кислотные и основные свойства органических соединений – свойства отдавать или принимать ион H+
Теории Брёнстеда-Лоури и Льюиса:
Бренстеда кислота – донор протона при кислотно-основном взаимодействии: молекула или ион, способные отщепить протон (ион Н+.
Бренстеда основание – акцептор протона при кислотно-основном взаимодействии: молекула или ион, способные присоединить протон Н+.
Льюиса кислота — акцептор электронной пары: молекула или ион, обладающие пустой (вакантной) орбиталью (FeBr3, AlCl3).
Льюиса основание — донор электронной пары (совпадает с основанием Бренстеда).
Типы органических соединений:
Кислоты – доноры пртонов:
СН-Кислоты — отщепляют протон от атома sp углерода (RC≡C–Н).
ОН-Кслоты — отщепляют протон от атома кислорода (RО–Н).
NН-Кислоты — отщепляют протон от атома азота (R3N+–Н).
SН-Кислоты — отщепляют протон от атома серы (RS–Н).
Основания – акцепторы протонов:
n-Основания — частицы (молекулы или ионы), присоединяющие протон к неподеленной паре электронов атома (R–NH2, R–OH, R–SH2,).
π-Основания — частицы (молекулы или ионы), присоединяющие протон к π-связи (СН2=СН2) или ароматической системе.
Факторы, определяющие кислотность и основность:
Чем стабильнее образующиеся сопряженное основание (или кислота), тем сильнее кислота (или основание). А эта стабильность зависит от ряда факторов:
1) Электроотрицательности ЭО кислотного (или основного) центра – чем больше ЭО атома, тем слабее основные свойства, поэтому спирты и простые эфиры являются более слабыми основаниями по сравнению с аминами;
2) Размера атома – чем больше, тем стабильнее;
3) Заместителей связанного с центром, они могут быть либо электродонорными (повышают основность и понижают кислотность), либо электроакцепторными (понижают основность и повышают кислотность).
Олигосахариды.
Олигосахариды – углеводы, содержащие от 2 до 10 моносахаридных звеньев (ди-, три-, тетрасахариды и т.д.), которые соединены гликозидными связями.
Восстанавливающие дисахариды. Принцип строения – гликозидный ОН одного моносахарида связан со спиртовым ОН другого моносахарида.
Мальтоза (α-глюкоза+глюкоза) продукты расщепления крахмала и гликогена (основной продукт — мальтоза). Мальтоза также содержится в солоде.
Целлобиоза (β-глюкоза+глюкоза) – образуется при неполном гидролизе целлюлозы. Состоит из двух остатков D-глюкопиранозы, связанных β(1→4) гликозидной связью.
Лактоза (β-галактоза+глюкоза)— молочный сахар. Состоит из остатков D-галактопиранозы и D-глюкопиранозы, связанных β(1→4) гликозидной связью (восстанавливающий дисахарид). В организме человека расщепляется ферментом лактазой.
Невосстанавливающий дисахарид: Принцип строения – гликозидный ОН одного моносахарида связан с гликозидным ОН другого моносахарида
Сахароза — свекловичный или тростниковый сахар. Состоит из остатков D- α-глюкопиранозы и D- β-фруктофуранозы, связанных (1→2) гликозид-гликозидной связью. В молекуле отсутствуют полуацетальные гидроксильные группы, поэтому она не способна к цикло-оксо-таутомерии. В организме расщепляется ферментом сахаразой.
Таутомерия. Восстанавливающие дисахариды способны к цикло-оксо-таутомерии во фрагменте, содержащем полуацетальную гидрокси-группу, а также легко окисляются под действием мягких окислителей, например, они дают реакцию «серебряного зеркала»:
Аналогичные превращения возможны для изомальтозы, лактозы и целлобиозы.
Гидролиз – разрушение гликозидной связи, с образованием смеси аномеров.
( он донор, повышает нуклеофильность а в бензоле нужен катализатор)
20 билет
Дисперсные системы и их классификация. Строение мицелл в лиофобных коллоидных растворах. Дисперсные системы – это гетерогенная система, в которой одна из фаз представлена мелкими частицами, равномерно распределенными в объеме другой однородной фазы.
Фаза – это однородная часть системы.
Дисперсная фаза – мелкораздробленные частицы, равномерно распределенные в дисперсной среде.
Дисперсная среда – однородная непрерывная фаза, в которой распределены частицы дисперсной фазы.
Классификация растворов по строению частиц растворенного вещества:
Истинные растворы - растворы, где частицы растворенного вещества находятся в воде или другом растворителе в виде молекул, атомов или ионов. Это растворы низкомолекулярных соединений НМС (солей, кислот, щелочей). Размер частиц 10-10 – 10-9м
Коллоидные растворы – это растворы, относящиеся к дисперсным системам, где частицы дисперсной фазы находятся в дисперсной среде в виде мицелл, размеры которых превышают молекулярные. Это золи (кровь, лимфа) и гели (кожа, мозг). Размер частиц 10-9 – 10-6м
Растворы высокомолекулярных соединений (ВМС) – это растворы, занимающие промежуточное состояние между истинными и коллоидными. Н-р, растворы белков, нуклеиновых кислот и полисахаридов.
Лиофобные (гидрофобные) дисперсные системы –– системы, частицы дисперсной фазы которых не взаимодействуют или слабо взаимодействуют с дисперсионной средой (водой).
(m+n)AgNO3 (изб) + m KI = m AgI+mKNO3+nAgNO3 (стабилизатор1)
Мицелла лиофобной системы – коллоидная частица, частица дисперсной фазы золей; состоит из гранулы и подвижного диффузного слоя, электронейтральна.Агрегат – микрокристалл, на основе которого строится мицелла коллоидной частицы.Потенциалопределяющие ионы – ионы, которые адсорбируются ядром. Адсорбируется тот ион, который уже есть в агрегате и взят в избытке (в агрегате уже есть Ag из-за этого он же и адсорбируется);Ядро мицеллы – кристаллический агрегат + слой потенциалопределяющих ионов, сообщающие заряд ядру мицеллы.Противоионы – ионы, противоположные по знаку заряда ядра мицеллы. Они образуют в плотный адсорбционный и диффузный слои.Гранула – часть мицеллы, состоящая из агрегата и плотного адсорбционного слоя; несет электрический заряд
Моносахариды.
Углеводы. Моносахариды – простейшие углеводы, природные гетерофункциональные органические соединения, являющиеся оксопроизводными многоатомных спиртов. Соответствуют общей формуле Сх(H2O)у. По расположению карбонильной группы (С=О) делятся:
Альдозы в названии имеют окончание –оза (галактоза), а кетоны –улоза (галактулоза), исключение – фруктоза.
В зависимости от общего числа атомов углерода в молекуле моносахариды подразделяют на триозы (С3), тетрозы (С4), пентозы (С5), гексозы (С6), гептозы (С7) и т. д
Стереоизомерия.
Хиральный (т. е. асимметричный) атом C – атом углерода с четырьмя различными заместителями. Первый (три заместителя) и последний (два одинаковых) углерод в моносахаридах нехиральный.
D- и L-изомеры – пара энантиомеров (зеркальных отражений друг друга). Если –ОН-группа у наиболее удалённого "хирального" атома C от карбонильной группы, располагается слева, то такой энантиомер обозначают символом L (лат. lævus — левый), если же она располагается справа, то это D-энантиомер (лат. dexter — правый). Почти все природные моносахариды принадлежат к D-ряду. Каждая пара энантиомеров моносахаридов имеет свое тривиальное название.
Эпимеры — -диастереомеры, различающиеся конфигурацией только одного из нескольких асимметрических атомов углерода.
Пентозы:
Открытые формы (линейные) изображаются в проекциях Фишера (картинки выше), а циклические формы моносахаридов обычно изображают в виде формул Хеуорса, которые в большей степени соответствуют реальному расположению атомов в пространстве.
Пятичленные циклы называют фуранозами, а шестичленные — пиранозами.
Таутомерные превращения или цикло-оксо таутомерия – переход из цепной формы углевода (где есть оксогруппа) в циклическую форму (пиранозу или фуранозу) в результате внутримолекулярной циклизации (читай по слогам) – нападения ОН-группы на электрофильный центр карбонильной. Такие превращения происходят в водных растворах.
Каждая из таутомерных форм обладает собственным значением оптической активности, поэтому оптическая активность свежеприготовленного раствора углевода изменяется до некоторого усредненного значения. Это явление называется мутаротацией.
Аномеры — стереоизомеры циклических форм моносахаридов, различающиеся конфигурацией образующегося аномерного атома углерода, т.е. атома углерода, у которого имеется полуацетальная (гликозидная) гидроксильная группа.
-
α-аномер – гликозидный гидроксил (-ОН) находится под циклом в формуле Хеорса. -
β-аномер - гликозидный гидроксил (-ОН) находится над циклом в формуле Хеуорса.
Билет 35
Изотонические, гипертонические и гипотонические растворы.
Тоничность – мера градиента осмотического давления
| Раствор | Pосм |
| Оба раствора изотоничны по отношению друг к другу | Росм(А) = Росм(В) |
| Раствор А гипотонический по отношению к В | Росм(А) < Росм(В) |
| Раствор В гипертонический по отношению к А | Росм(А) > Росм(В) |
В медицине изотонические растворы – это растворы, осмотическое давление которых равно осмотическому давлению крови, н-р, 0,9% NaCl и 5% р-р глюкозы:
Росм (р-ра) = Росм (плазмы крови) = 740 – 780 кПа (при 370С).
Тургор – осмотическое давление воды в клетках, которое придает этим клеткам упругость и напряжение.
Плазмолиз эритроцитов – осмос воды из эритроцитов в окружающую плазму (экзоосмос). Это происходит если вводимый в вену раствор гипертоничен по отношению к плазме, в результате эритроциты обезвоживаются и сморщиваются:
Гемолиз эритроцитов - осмос воды внутрь эритроцитов (эндоосмос). Это происходит если вводимый в вену раствор гипотоничен по отношению к плазме. Эритроциты увеличиваются в объеме, что может привести к разрыву оболочки. В результате гемоглобин выходит в плазму.
Давление насыщенного пара растворителя над раствором при любой температуре будет ниже, чем над чистым растворителем.
Первый закон Рауля - относительное понижение давления насыщенного пара растворителя над раствором по сравнению с чистым растворителем при данной температуре равно мольной доле растворенного вещества:
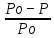 = iN(х)
= iN(х)Где Ро – давление насыщенного пара над чистым растворителем;
Р – давление насыщенного пара над раствором;
N(х) – мольная доля растворенного вещества x.
i – изотонический коэффициент (используется если раствор электролита)
Можно выразить P насыщенного пара растворителя над раствором: Р = Ро [1 - N(х)] = Р N(р-ля)
Моляльная концентрация СМ – это количество моль растворенного вещества в 1000 г (1 кг) растворителя [моль/кг]:
Второй закон Рауля:
Понижение температуры замерзания растворa Δtзам по сравнению с чистым растворителем пропорционально моляльной концентрации неэлектролита:
tзам(р-ра) = tзам (р-ля) – Δtзам
Δtзам= ККР СМ
– следовательно, раствор замерзает при более низкой температуре, чем чистый растворитель.
Ккр – криоскопическая константа [K*кг/моль] для воды 1,86
Повышение температуры кипения раствора Δtкип по сравнению с чистым растворителем пропорционально моляльной концентрации неэлектролита:
tкип(р-ра) = tкип (р-ля) + Δtкип
Δtкип= КЭ СМ
– следовтельно, раствор кипит при более высокой температуре, чем читый растворитель
КЭ – эбуллиоскопическая константа [K*кг/моль] для воды 0,52
Физический смысл Кэ и Ккр
Если взять 1М раствор неэлектролита, тогда Кэ покажет насколько градусов повысится температура кипения 1М раствора, а Ккр покажет насколько градусов понизится температура замерзания 1М раствора по сравнению с чистым растворителем.
Вывод: эти константы не зависят от природы растворенного вещества, его концентрации, а зависят только от природы растворителя.
Липиды. Химическая и биологическая классификации. Признаки классов.
Липиды – большая группа природных органических соединений, объединяемых общим свойством – гидрофобностью (нерастворимостью в воде) и хорошей растворимостью в органических растворителях (эфире, бензоле).
По способности к гидролизу делятся на две большие группы: омыляемые и неомыляемые.
Омыляемые липиды по количеству образующихся видов веществ делятся на простые (меньше двух) и сложные (больше двух).
Простые омыляемые липиды - при гидролизе образуется два вида веществ.
Воски — сложные эфиры высших жирных кислот и высших одноатомных спиртов.
Триацилглицериды – сложные эфиры глицерина и высших жирных кислот.
Церамиды – сложные эфиры (по аминогруппе) сфингозина и высшей жирной кислоты
Сложные омыляемые липиды – при гидролизе образуется более двух видов веществ.
Фосфолипиды – имеют спиртовый компонент, остаток ВЖК и остаток фосфорной кислоты.
Сфинголипиды – сложные липиды, содержат аминоспирт сфингозин.
Гликолипиды – содержат двухатомный аминоспирт сфингозин. Обязательным компонентом является углеводный остаток (моно- или олигосахарид), связанный с остатком церамида. (цереброзиды и ганглиозиды).
Неомыляемые липиды – не подвергаются гидролизу.
Терпены – ряд соединений, в состав которых входят изопреновые звенья.
Стероиды – класс соединений в основе которых лежит циклопентанпергидро-фенантрен (стеран).
Задача : вещество класса триптаминов. Структурно схож с серотонином - важным нейротрансмиттером головного мозга млекопитающих. Представляет собой алкалоид, обнаруживаемый в коже некоторых жаб, в некоторых видах грибов, и других растениях и животных.
Билет 2
ковалентная, ионная, водородная, металлическая; их краткая характеристика. Характеристики ковалентной связи: длина, энергия, валентный угол. Механизмы образования ковалентной связи. Химическая связь – это совокупность сил, связывающих атомы или молекулы друг с другом в новые устойчивые структуры. Основные типы химической связи:Ионная связь – хим. связь, образованная электростатическим притяжением (притяжением плюса к минусу) двух противоположно заряженных ионов, где электронная пара принадлежит полноценно одному из ионов. Обычно это связь между ионами металла и неметалла. Ме-Неме. В твердом состоянии имеют ионную кристаллическую решётку. Водородная связь — электростатическое взаимодействие между атомом водорода, связанным с электроотрицательным атомом, и другим электроотрицательным атомом (O, S, N, F). Она слабее и длиннее ковалентных связей. Водородные связи могут быть межмолекулярными или внутримолекулярными. Водородные связи принимают важную роль в межмолекулярном взаимодействии, от чего зависит агрегатное состояние вещества. Еще ее можно встретить между азотистыми основаниями в двуцепочной ДНК или во вторичной структуре белков и т.д.Металлическая связь – это связь между положительными ионами металлов с помощью общих электронов. Ме-Ме. Это происходит из-за того, что у металлов – небольшое число электронов на внешнем уровне, слабо удерживаемых ядром и из-за этого они покидают свои орбитали и свободно передвигаются по всему объему. Металлическая связь делокализована, ненаправлена и ненасыщена. Ковалентная связь – химическая связь, осуществляемая за счет образования общей электронной пары, при перекрывании электронных облаков соединяемых атомов. Образуется между атомами неметаллов.
Длиной ковалентной связи называют расстояние между ядрами атомов, которые образуют связь. Длина связи напрямую связана с радиусом атома - чем он больше, тем длиннее связь. Зная ковалентный радиус атомов, очень легко вычислять длину ковалентной связи в молекуле. Например, длина ковалентной связи молекулы HF = 30 + 58 = 88 пм.
Энергия ковалентной связи (выражают в ккал/моль или кДж/моль) – энергия, которая необходима для разрыва связи (при образовании ковалентной связи энергия выделяется, при разрыве - поглощается). Чем выше энергия связи, тем прочнее связь. Энергия связи зависит от ее длины - чем длиннее связь в молекуле, тем проще ее разорвать (затратить меньше энергии).
Валентный угол — угол между линиями, соединяющими химически связанные атомы.
Механизмы образования:
Обменный. При обменном механизме в образовании общей электронной пары от каждого атома участвуют и атомная орбиталь, и неспаренный электрон, находящийся этой орбитали.
Донорно акцепторный. Наблюдается, когда один компонент (донор) имеет на атомной орбитали внешнего уровня электронную пару, а другой (акцептор) – свободную орбиталь. При слиянии атомных орбиталей возникает молекулярная орбиталь , на которой находится общая электронная пара. Встречается в ионе аммония NH4+, гидроксония H3O+, комплексах.
Альдегиды и кетоны.
Альдегиды и кетоны – органические соединения, в молекуле которых есть карбонильная >C=O группа с общей формулой CnH2nO
У альдегидов карбонильный углерод соединен с атомом Н и органической группой R (общая формула RHC=O).
В кетонах – с двумя органическими группами (общая формула R2С=О).
Альдегидная группа обусловливает наркотическое действие и дезинфицирующие свойства.
Муравьиный альдегид (формальдегид) HС(O)H – единственный газообазный альдегид, обладает свойством свертывать белки. Формалин (40%-ный раствор формальдегида) применяется в качестве консерванта анатомических препаратов и дезинфицирующего средства.
Влияние строения на реакционную способность. В реакциях с нуклеофильными реагентами альдегиды проявляют большую реакционную способность по сравнению с кетонами. Так как:
1. Для атаки Nu меньше стереохимических преград в реакции с альдегидами (у альдегида один Н и один большой алкильный радикал, а у кетона два алкильных радикала, следовательно, к альдегиду проще подобраться).
2. Электрофильный центр у альдегида более выражен (что больше нравится Nu) так как у него один электродонорный радикал, в отличие от кетона, у которого их два (они гасят Сδ+ своими электронами).
Образование полуацеталей и ацеталей в реакциях AN со спиртами:
Механизм:
*ацетали устойчивы у кетонов с электродонорными заместителями
Роль кислотного катализа – активация оксо-группы (т.е. усиление электрофильного центра Сδ+ до С+).
Образование гидратных форм – в реакциях гидратации (присоединение воды). Так как это реакция нуклеофильного замещения AN гидратации больше подвержены альдегиды, с электроакцепторными заместителями.
Билет 21
Концепция гибридизации атомных орбиталей. Типы гибридизации s- и p-орбиталей: sp, sp 2 , sp3 . Типы связей по характеру перекрывания атомных орбиталей: - и - связи. Одинарные и кратные связи.
Гибридизация – это выравнивания различных валентных орбиталей (s, p, d, f) по форме и энергии, с образованием такого же числа одинаковых гибридных орбиталей.
При смешивании s-АО и р-АО образуются гибридные (от лат. hybrida смесь) атомные орбитали (σ – АО), которые в зависимости от вида гибридизации располагаются под разным углом.
Гибридные орбитали более вытянуты в пространстве в сторону соседних атомов. Это обеспечивает их более полное перекрывание с атомными орбиталями соседних атомов и, соответственно, более прочные связи с ними.
В гибридизации участвуют разные по форме, н-р, s и p, но близкие по энергии атомные орбитали (то есть орбитали общего уровня).
Гибридные орбитали располагаются в пространстве на максимальном удалении друг от друга.
Гибридные орбитали участвуют в образовании только σ-связей.
π-Связи образуются за счёт бокового перекрывания негибридных орбиталей.
В гибридизации принимают участие не только орбитали, которые образуют σ-связи, но и s- и р-орбитали с неподелённой парой электронов того же энергетического уровня, н-р, атом кислорода в органическом соединении может быть sp3-гибридизованным и образовывать только две связи с соседними атомами, а на двух других гибридизованных орбиталях будут находится неподеленные пары электронов.
σ-Связи – ковалентная связь, образованная при перекрывании атомных орбиталей АО по оси, соединяющей ядра двух атомов с максимумом электронной плотности на этой оси. Атомы углерода образуют σ-связи только гибридными орбиталями. π-Связи – ковалентная связь, образованная при боковом перекрывании негибридизованных р-АО с максимумом перекрывания по обе стороны от прямой, соединяющей ядра атомов. Образование π-связи возможно, только если между атомами уже есть σ-связь.
Кратные связи. Если атомы соединены одной общей электронной парой, то говорят, что образуется одинарная связь. Если связь между двумя атомами одна σ-связь и одна π-связь, то такая связь называется двойной связью. Если связь между двумя атомами одна σ-связь и две π-связь, то такая связь называется тройной связью.
4 билет Растворы – гомогенные (однородные) системы переменного состава, состоящие из двух или более компонентов (т. е. независимых друг от друга веществ).
Компоненты раствора:
растворитель – вещество, способное растворять другие твёрдые, жидкие или газообразные вещества, не изменяя их химического состава. Обычно это преобладающий компонент раствора.
растворенные вещества – вещество, которое в процессе растворения равномерно распределилось в виде молекул или ионов в растворителе.
продукты их взаимодействия – часто под действием растворителя растворенное вещество начинает диссоциировать, с образованием ионов.
Процессы, происходящие при растворении:
— сольватация (гидратация или окружение молекулами воды частиц растворенного вещества) и диссоциация (распад электролита на ионы);
— выделение или поглощение тепла;
— образование водородных связей.
На случай если начнут спрашивать про эквивалентную концентрацию.
Эквивалент — реальная или мнимая частица вещества, которая может присоединять, высвобождать или быть каким-либо иным образом эквивалентна (то есть равноценна) одному иону H+ в обменных реакциях или одному электрону в окислительно-восстановительных реакциях.
Чтобы найти эквивалентное количество вещества нужно понять сколько вещество отдает или принимает протонов (или электронов) z.
Так, например, HCl в растворе отдает один протон z=1, из-за чего
nэ(HCl)=z*n(HCl)=n(HCl)
А примером сильной двухосновной кислоты может послужить H2SO4, она в водных растворах отдает два протона z=2, соответственно:
nэ(H2SO4) = z*n(H2SO4) = 2*n(H2SO4)
Эквивалентная молярная масса – масса вещества (в г), которая может отдать или присоединить 1 моль протонов (или е)
Mэ(x)=
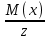
Альдегиды и кетоны. Строение карбонильной группы.
Альдегиды и кетоны – органические соединения, в молекуле которых есть карбонильная >C=O группа с общей формулой CnH2nO
-
У альдегидов карбонильный углерод соединен с атомом Н и органической группой R (общая формула RHC=O).
-
В кетонах – с двумя органическими группами (общая формула R2С=О).
Альдегидная группа обусловливает наркотическое действие и дезинфицирующие свойства.
Муравьиный альдегид (формальдегид) HС(O)H – единственный газообазный альдегид, обладает свойством свертывать белки. Формалин (40%-ный раствор формальдегида) применяется в качестве консерванта анатомических препаратов и дезинфицирующего средства.
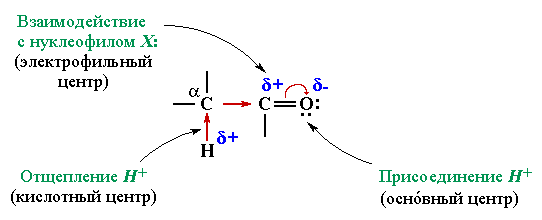 Влияние строения на реакционную способность. В реакциях с нуклеофильными реагентами альдегиды проявляют большую реакционную способность по сравнению с кетонами. Так как:
Влияние строения на реакционную способность. В реакциях с нуклеофильными реагентами альдегиды проявляют большую реакционную способность по сравнению с кетонами. Так как:
1. Для атаки Nu меньше стереохимических преград в реакции с альдегидами (у альдегида один Н и один большой алкильный радикал, а у кетона два алкильных радикала, следовательно, к альдегиду проще подобраться).
2. Электрофильный центр у альдегида более выражен (что больше нравится Nu) так как у него один электродонорный радикал, в отличие от кетона, у которого их два (они гасят Сδ+ своими электронами).
Образование полуацеталей и ацеталей в реакциях AN со спиртами:
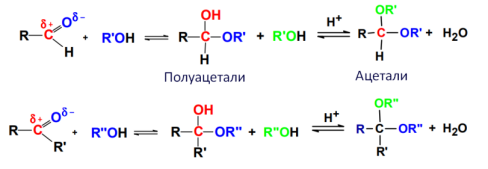
Механизм:
*ацетали устойчивы у кетонов с электродонорными заместителями
Роль кислотного катализа – активация оксо-группы (т.е. усиление электрофильного центра Сδ+ до С+).
Образование гидратных форм – в реакциях гидратации (присоединение воды). Так как это реакция нуклеофильного замещения AN гидратации больше подвержены альдегиды, с электроакцепторными заместителями.
Билет 14 ?
Кислотность желудочного сока. Общая, активная и потенциальная кислотность.
Кислотность желудочного сока обуславливается pН среды желудка, в норме он должен быть в пределах pH=1,5-2
Активную кислотность желудочного сока обеспечивает главный неорганический компонент – соляная кислота (норма 20-40 т.е.).
Потенциальная кислотность обуславливается наличием в желудочном соке слабых кислот, таких как лимонная, яблочная, молочная, пировиноградная, масляная и др., которые не отдают свой протон в кислой среде.
Общая кислотность – суммарное содержание всех кислот (норма 40-60 т.е.).
Титриметрические единицы (т.е.) – это объем (в мл) 0.1э раствора NaOH необходимого для нейтрализации 100 мл желудочного сока.
Для того чтобы найти кислотность желудочного сока, его титруют раствором гидроксида натрия известной концентрации в присутствии двух индикаторов.
Первый переход окраски (черный квадратик) – это точка титрования свободной кислотности (которая определяется сильной кислотой - соляной),
НCl + NaОН → НОН + NaCl
Когда соляная кислота полностью прореагировала, в желудочном соке остались только слабые кислоты (которые на первой стадии не должны оттитровываться), они задают рН
3,5. Такое значение pH (точка эквивалентности) соответствует зоне перехода цвета индикатора метилового оранжевого рН 3,0÷ 4,0.
Второй переход окраски (серый квадратик)– точка титрования общей кислотности жел. сока.
СН3СООН + NaОН ⇌ НОН + СН3СООNa
Когда все слабые кислоты прореагировали со щелочью, среда желудочного сока приобретает рН
8,7. И эту точка эквивалентности устанавливается с помощью фенолфталеина (зона перехода цвета этого индикатора рН 8,2 ÷ 10,0).
Альдегиды и кетоны. Строение карбонильной группы.
Альдегиды и кетоны – органические соединения, в молекуле которых есть карбонильная >C=O группа с общей формулой CnH2nO
-
У альдегидов карбонильный углерод соединен с атомом Н и органической группой R (общая формула RHC=O). -
В кетонах – с двумя органическими группами (общая формула R2С=О).
Альдегидная группа обусловливает наркотическое действие и дезинфицирующие свойства.
Муравьиный альдегид (формальдегид) HС(O)H – единственный газообазный альдегид, обладает свойством свертывать белки. Формалин (40%-ный раствор формальдегида) применяется в качестве консерванта анатомических препаратов и дезинфицирующего средства.
 Влияние строения на реакционную способность. В реакциях с нуклеофильными реагентами альдегиды проявляют большую реакционную способность по сравнению с кетонами. Так как:
Влияние строения на реакционную способность. В реакциях с нуклеофильными реагентами альдегиды проявляют большую реакционную способность по сравнению с кетонами. Так как:1. Для атаки Nu меньше стереохимических преград в реакции с альдегидами (у альдегида один Н и один большой алкильный радикал, а у кетона два алкильных радикала, следовательно, к альдегиду проще подобраться).
2. Электрофильный центр у альдегида более выражен (что больше нравится Nu) так как у него один электродонорный радикал, в отличие от кетона, у которого их два (они гасят Сδ+ своими электронами).
Образование полуацеталей и ацеталей в реакциях AN со спиртами:

Механизм:
*ацетали устойчивы у кетонов с электродонорными заместителями
Роль кислотного катализа – активация оксо-группы (т.е. усиление электрофильного центра Сδ+ до С+).
Образование гидратных форм – в реакциях гидратации (присоединение воды). Так как это реакция нуклеофильного замещения AN гидратации больше подвержены альдегиды, с электроакцепторными заместителями.
Билет 14 ?
Кислотность желудочного сока. Общая, активная и потенциальная кислотность.
Кислотность желудочного сока обуславливается pН среды желудка, в норме он должен быть в пределах pH=1,5-2
Активную кислотность желудочного сока обеспечивает главный неорганический компонент – соляная кислота (норма 20-40 т.е.).
Потенциальная кислотность обуславливается наличием в желудочном соке слабых кислот, таких как лимонная, яблочная, молочная, пировиноградная, масляная и др., которые не отдают свой протон в кислой среде.
Общая кислотность – суммарное содержание всех кислот (норма 40-60 т.е.).
Титриметрические единицы (т.е.) – это объем (в мл) 0.1э раствора NaOH необходимого для нейтрализации 100 мл желудочного сока.
Для того чтобы найти кислотность желудочного сока, его титруют раствором гидроксида натрия известной концентрации в присутствии двух индикаторов.
Первый переход окраски (черный квадратик) – это точка титрования свободной кислотности (которая определяется сильной кислотой - соляной),
НCl + NaОН → НОН + NaCl
Когда соляная кислота полностью прореагировала, в желудочном соке остались только слабые кислоты (которые на первой стадии не должны оттитровываться), они задают рН
Аминокислоты. Классификация. Химические свойства как гетерофункциональных соединений. α-Аминокислоты. Классификация α-аминокислот, входящих в состав белков. Биполярная структура, образование хелатных соединений.
Аминокислоты – гетерофункциональные органические соединения, в молекуле которых одновременно содержатся карбоксильная группа (-СООН) и аминогруппа (-NH2).
Классификация по взаимному расположению функциональных групп
Аминокислоты амфолиты, так как проявляют и кислотные, и основные свойства:
В роли основания (реакции по аминогруппе):
1) Образование оснований Шиффа (замещенного имина):
2) N-алкилирование:
3) N-ацилирование:
В роли кислоты (реакции по карбоксильной группе):
1) Образование сложных эфиров:
Также эти две группы могут взаимодействовать друг с другом:
А) Внутримолекулярная дегидратация (отщепление воды) с образованием лактамов – если функциональные группы расположены на достаточном расстоянии друг от друга:
Б) Межмолекулярная дегидратация с образованием пептидных связей – если функциональные группы расположены у одного углерода:
Как все полифункциональные соединения, аминокислоты легко образуют хелатные комплексы с ионами большинства металлов. Широкое применение в медицине имеют комплексы кальция и магния с глицином, используемые, как легко усвояемые источники этих элементов. Реакция с солями Cu2+ в щелочной среде – биуретовая реакция, с образованием фиолетовой окраски:
α-Аминокислоты – гетерофункциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу у одного и того же атома углерода. Кристаллические, растворимые в воде вещества, многие имеют сладкий вкус.
Заменимые -аминокислоты — аминокислоты, синтезирующиеся в организме в достаточном количестве (Ala, Asp, Asn, Glu, Gln, Gly, Pro, Ser).
Незаменимые -аминокислоты — аминокислоты, не синтезирующиеся в организме; должны поступать с пищей (Val, Leu, Ile, Met, Phe, Trp, Lys, Thr).
Биологические функции α-аминокислот:
— структурные компоненты белков;
— один из основных источников энергии в организме;
— биорегуляторы и предшественники многих биорегуляторов
— лекарственные препараты
Классификация:
1) по типу радикала
2) по полярности радикала
У неионогенных аминокислот при физиологических условиях (рН ≈ 7) радикал находится в неионизированном состоянии (например, в тирозине гидроксильная группа находится в диссоциированном виде только в щелочной среде, при рН = 7 она не ионизирована).
У ионогенных аминокислот при физиологических условиях (рН ≈ 7) радикал находится в ионизированном состоянии — несет положительный или отрицательный заряд.
3) по кислотно-основным свойствам:
Биполярная структура – аминокислоты в растворах содержатся в виде биполярного иона (би-два, полюс - заряд) или по-другому цвиттер-иона
Изоэлектрическая точка pI – это такое значение pH, при котором аминокислота будет находится в виде биполярного иона.
1. Для нейтральных (один кислотный и один основный центр) аминокислот pI ≈ 5-6 (слабокислая среда, почти нейтральная). В зависимости от рН среды нейтральная аминокислота может существовать трех разных формах — катионной, диполярного иона и анионной форме:
2. Для кислых (-СООН 2 группы и 1 группа -NH2) аминокислот pI < 7 (кислая среда, для закрытия второго -COO- протоном):
-
Для основных (-NH2 2 группы и 1 группа -СOOH) аминокислот pI > 7 (щелочная среда, для отнятия протона у -NH3+):
задача
Билет 33
Агрегативная и седиментационная устойчивость дисперсных систем. Коагуляция. Порог коагуляции.
Агрегативная устойчивость
дисперсных систем –– устойчивость частиц дисперсной фазы к агрегации, т.е. устойчивость к их объединению. Агрегатная устойчивость крови обеспечивается гидратными оболочками на поверхности клеточных мембран (так плазмолемма эритроцитов и тромбоцитов заряжена отрицательно), что препятствует их слипанию между собой.
Дополнительный фактор агрегативной устойчивости крови является ДЭС (двойной электрический слой) на границе клетка-плазма, благодаря которому поверхность клетки приобретает заряд. (так плазмолемма эритроцитов и тромбоцитов заряжена отрицательно)
Седиментационная устойчивость дисперсных систем –– устойчивость частиц дисперсной фазы к оседанию под действием гравитации. Седиментационная устойчивость крови связана с непрерывным движением крови по кровяному руслу за счет деятельности сердца и стенок сосудов.
Измерение СОЭ (скорость оседания эритроцитов) – метод клинического анализа крови, для определения седиментационной устойчивости в лабораторных условиях.
Коагуляция – объединение мелких дисперсных частиц в большие по размеру агрегаты. Свертывание, сгущение.
Скрытая коагуляция — визуально не обнаруживаемый процесс коагуляции.
Явная коагуляция — визуально обнаруживаемый процесс коагуляции в не стабилизированной дисперсной системе, проявляемый в изменении окраски, появлении мути, образовании хлопьев и осадков.
Порог коагуляции –– минимальная концентрация электролита-коагулянта, при которой скрытая коагуляция переходит в явную.
Билет 18