ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 22.11.2023
Просмотров: 135
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Пиролиз деароматизированного вакуумного газойля проводили при температуре 820°С, времени контакта 0,5 с и разбавлении сырья водяным паром 80%. Следует отметить, что пиролиз исходного вакуумного газойля при более мягких условиях (температура 800 °С, время контакта 0,4 с, разбавление водяным паром 100%) сопровождался сильным коксованием реактора.
Длительный опыт работы на промышленной установке с применением подготовленного сырья не обнаружил каких-либо затруднений.
Для подготовки вакуумного газойля в качестве сырья пиролиза требуется более глубокопротекающий гидрокаталитический процесс. Фирмой «Linde A G» разработан катализатор, обладающий свойством селективного крекинга и гидрирования полициклических ароматических и гетероциклических углеводородов при минимальном насыщении моноароматических соединений. В продуктах реакции содержится фракция, выкипающая выше 340°С (60% на сырье), слабо изомеризованная и содержащая 35% алканов и до 40% нафтеновых углеводородов. При пиролизе этой фракции выход этилена достигает 28—30% бутадиена-1,3 — 6—7%. Процесс фирмы «Linde A G» успешно эксплуатируется на части печей этиленовой установки завода «Reinische Olefinwerke» с применением подготовленного вакуумного газойля. Разработкой процессов селективной подготовки вакуумного газойля интенсивно занимается ряд ведущих зарубежных фирм — «Union Oil», «Lummus», BASF.
1.2 Механизм превращения углеводородов в процессе пиролиза
Пиролиз в промышленных условиях осуществляется при давлениях, близких к атмосферному или несколько превышающих атмосферное, и при температурах порядка 1000—1150 К. В таких условиях реакции разложения углеводородов протекают в газовой фазе в форме свободных радикалов. Далее рассмотрен химизм основных реакций (осуществляющихся в радикальной форме) как первой, так и второй условных стадий.
РЕАКЦИИ СВОБОДНЫХ УГЛЕВОДОРОДНЫХ РАДИКАЛОВ
Образование свободных радикалов. Свободные радикалы могут образоваться в процессах термического разложения из молекул исходного углеводорода, чаще всего при разрыве связи С—С, например при пиролизе этана:
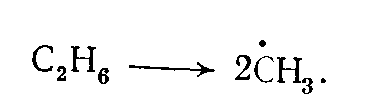
Практически разрывом связи С—Н в качестве первичного акта пиролиза можно пренебречь. Энергия разрыва связей С—С и С—Н в молекулах алканов не одинакова для всех однородных связей и несколько изменяется в зависимости от строения молекулы и положения в ней связи. В молекулах олефинов и ароматических углеводородов связи С—С и С—Н, соседние с двойной связью, значительно прочнее, чем таковые в молекулах алканов, а такие же связи в положении через одну от двойной (сопряженные связи, или связи в β-положении) сильно ослаблены по сравнению с такими же связями в молекулах алканов.
Радикалы могут образовываться не только при мономолекулярных, но и при бимолекулярных реакциях из молекул олефинов в реакциях диспропорционирования либо из молекул алканов и олефинов в реакциях, обратных диспропорционированию, например

Чем ниже температура и выше давление в реакционной системе, тем выше соотношение скоростей би- и мономолекулярного маршрутов образования радикалов. При некоторых условиях (низкая температура) образование радикалов по бимолекулярной реакции проходит с большей скоростью, чем по мономолекулярному процессу.
Соотношение энергий разрыва различных связей С—С и С—Н в молекулах реагирующих углеводородов определяет скорость реакций радикалов по тем или иным направлениям количество образующихся различных радикалов и в итоге состав продуктов реакции.
Ниже рассмотрены основные реакции радикалов, протекающие в реакторах пиролиза.
Реакции замещения (отрыва атома водорода), например
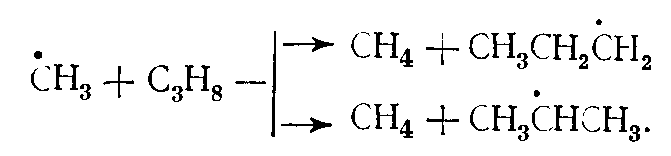
В зависимости от соотношения величин энергии активации отрыва атомов водорода, занимающих в молекуле разное положение, скорость отрыва этих атомов различна, что определяет структуру образующихся радикалов и в дальнейшем — состав продуктов распада молекул. Так, в результате взаимодействия радикала с пропаном могут образоваться радикалы • С3Н7, отличающиеся положением свободной валентности:
Реакции присоединения. Радикалы могут присоединяться к молекулам ненасыщенных углеводородов по кратной связи, например
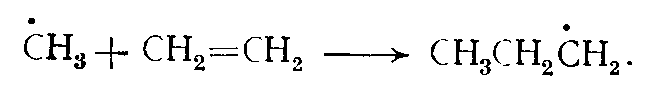 Реакции распада. Практически исключительное направление распада радикалов наблюдается по связи, находящейся в β-положении относительно атома углерода, обладающего свободной валентностью. В результате распада образуется молекула ненасыщенного углеводорода и радикал меньшей молекулярной массы, чем исходный, в частности, Н•. Например:
Реакции распада. Практически исключительное направление распада радикалов наблюдается по связи, находящейся в β-положении относительно атома углерода, обладающего свободной валентностью. В результате распада образуется молекула ненасыщенного углеводорода и радикал меньшей молекулярной массы, чем исходный, в частности, Н•. Например: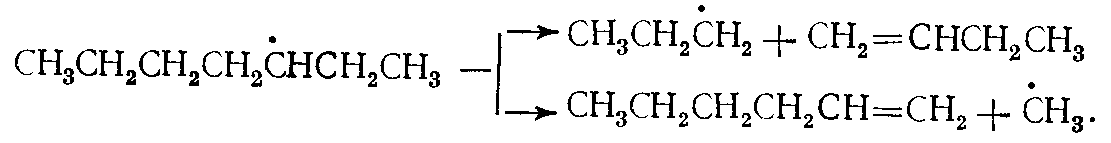
Реакции изомеризации. Изомеризация радикала представляет собой внутримолекулярный отрыв атома водорода активным атомом углерода, обладающим свободной валентностью:
Реакции изомеризации протекают через промежуточное состояние—циклические активированные комплексы:
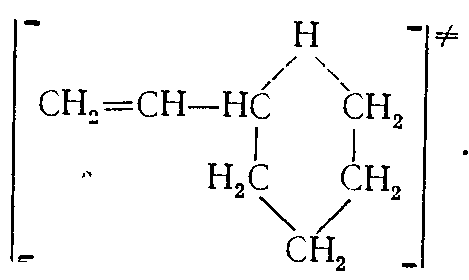
Легче всего образуются шестичленные, труднее — пяти- и семичленные активированные комплексы. Образование активированных комплексов, содержащих циклы с другим числом углеродных атомов, затруднено. Поэтому для радикалов с неразветвленной углеродной цепью вероятен переход свободной валентности от n-го (по счету) к (п+4), (п+5) и (п+6) атомам углерода.
Реакции рекомбинации. Это реакции присоединения двух радикалов, например
Энергия активации реакции близка к нулю, но в случае рекомбинации двух атомов водорода и, возможно, атома водорода и радикала СН3 рекомбинация происходит только в результате тройного столкновения, причем роль третьей сталкивающейся частицы заключается в отводе части энергии, выделяющейся при образовании связи.
Реакции диспропорционирования. Диспропорционирование (перераспределение водорода) происходит в результате взаимодействия двух молекул олефинов или двух радикалов, например
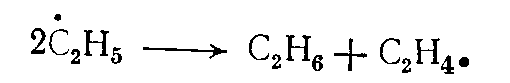 (1)
(1)Энергия активации этих реакций также близка к нулю. Но так как концентрации радикалов при термическом пиролизе обычно значительно меньше, чем углеводородных молекул, скорости реакций рекомбинации и диспропорционирования и роль их в образовании конечных продуктов (в реакционном объеме) обычно невелика.
Алканы. Термическое разложение алканов является чисто радикально-цепным процессом и протекает согласно механизму Раиса — Герцфельда — Косякова. Пиролиз одного из простейших представителей алканов — пропана включает следующие основные реакции:
Инициирование цепи
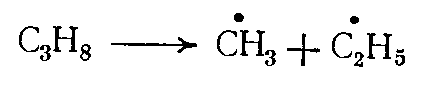 (2)
(2)Развитие цепи:
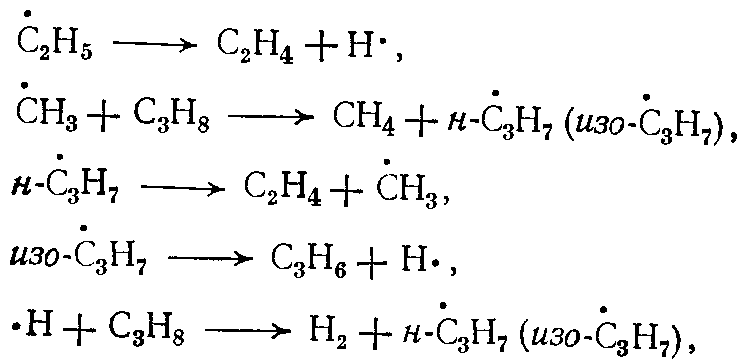 (3)
(3)Обрыв цепи
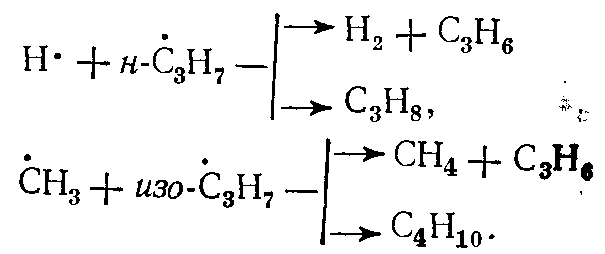 (4)
(4)При пиролизе любых насыщенных нециклических углеводородов нормального или изомерного строения стадией зарождения цепи является распад на два радикала с разрывом связи С—С:
При пиролизе алканов изостроения наиболее вероятен разрыв связи С—С между двумя третичными атомами, затем между вторичным и третичным атомами, еще менее вероятен разрыв связи между первичным и третичным атомами и, наконец, наименее вероятен разрыв связи между двумя вторичными атомами углерода. Образовавшиеся радикалы, большие чем •СН3 и •С2Н5, как правило, распадаются с разрывом ослабленной связи С—С, находящейся в β-положении к атому С, обладающему свободной валентностью.
Если возможны два направления распада алкильного радикала нормального строения с образованием алкильных радикалов разной молекулярной массы, то с большей скоростью происходит распад с образованием большего радикала, который, в свою очередь, может подвергаться дальнейшему распаду. Распад радикала с отрывом атома водорода, если в структуре радикала имеется связь С—С в β-положении, в условиях пиролиза практически незначителен. Если такой связи в радикале нет (изопропил- и изобутил-радикалы), то разрывается связь С—Н у атома С, соседнего с атомом углерода, обладающим свободной валентностью, например, разложение изо-С3Н7 в схеме.
В результате разрыва связи С—С алкилрадикала в β-положении к ненасыщенному атому С получается этилен (или более высокомолекулярный олефин, например пропилен, изобутен и т. д.) и меньший алкилрадикал, который, в свою очередь, подвергается дальнейшему разложению аналогичным путем, до тех пор, пока не образуются радикалы •СН3 или •С2Н5 и Н•. Радикал •С2Н5 в значительной степени также разлагается на С2Н4 и Н•, но частично реагирует, как правило, с молекулой исходного вещества:
Радикалы •СН3 и Н• реагируют аналогично. При этом вероятность отрыва атома водорода у первичного, вторичного и третичного атомов С не одинакова.
Относительные скорости реагирования названных радикалов с отрывом первичного I (приняты за единицу), вторичного II и третичного III атомов водорода в зависимости от температуры реакции приведены ниже:
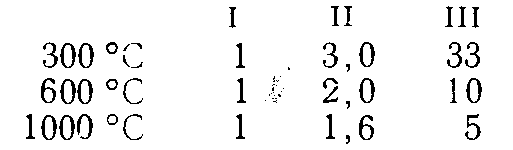
Получающиеся при этом вторичные и третичные алкил-радикалы распадаются с образованием олефина (соответственно с прямой или разветвленной цепочкой в молекуле) и меньшего радикала. Первичные радикалы в случае пиролиза н-алканов дают этилен и меньший радикал; меньшие радикалы распадаются далее, как показано выше.
В схеме реакций пиролиза алканов учитывают изомеризацию первичных радикалов во вторичные через промежуточные, преимущественно шестичленные циклы. Реакции изомеризации эндотермичны (20—30 кДж/моль), следовательно, с повышением температуры равновесная концентрация вторичных радикалов снижается, что способствует увеличению скорости образования этилена.
Циклоалканы. Из циклоалканов в состав сырья для промышленного пиролиза входят только циклопентан, циклогексан и их алкилзамещенные. Основные продукты разложения циклопентана — этилен и пропилен, а при значительной степени разложения циклопентана образуется циклопентадиен. Реакция протекает преимущественно по радикально-цепному механизму. Вначале, когда концентрация радикалов невелика, циклопентан образует бирадикал, который быстро реагирует по одному из двух направлений:
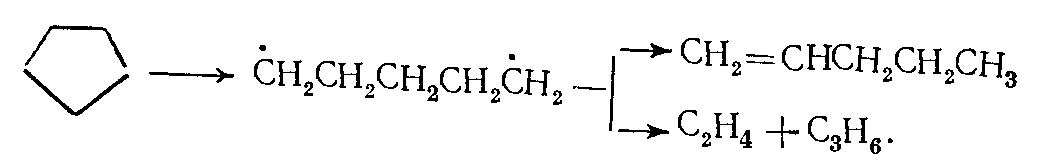 (7)
(7)Образовавшийся пентен-1 распадается на этил- и аллилрадикалы:
Когда в ходе реакции получается достаточно высокая концентрация радикалов, циклопентан вступает с ними во взаимодействие; например
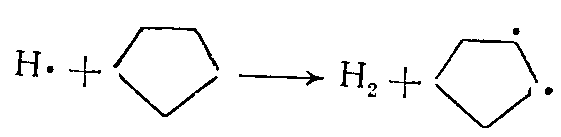 (9)
(9)Дальнейшую схему разложения можно представить следующим образом:
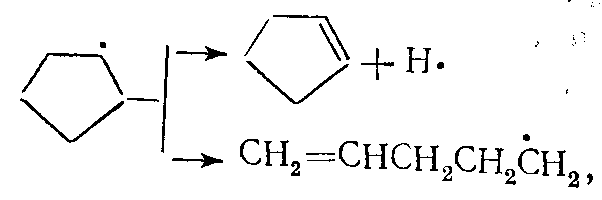
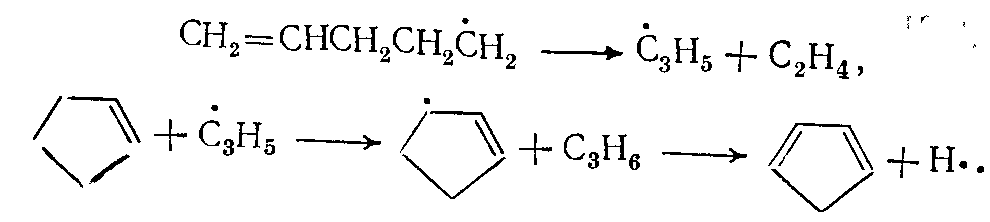 (10)
(10)Распад циклогексана осуществляется в начале реакции по аналогичной схеме также с образованием бирадикала:
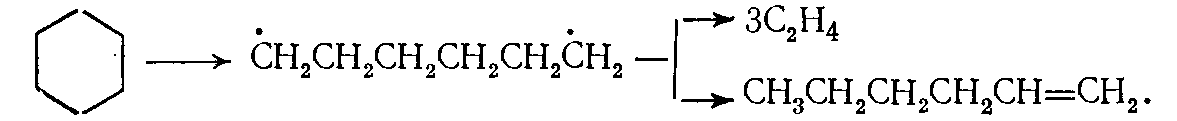 (11)
(11)В ходе реакции при распаде гексена-1 по радикально-цепному механизму (в основном, по правилу β-распада) образуются алкилрадикалы и атомы водорода, ведущие цепь превращений циклогексана:
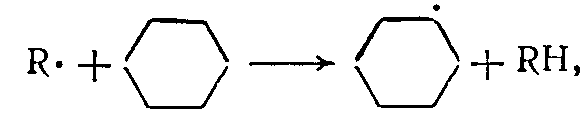
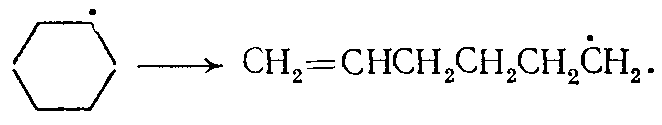 (12)
(12)Первичный радикал С6Н11• либо сразу распадается, либо изомеризуется (из положения 1 в положение 4) во вторичный радикал С6Н11•, который также распадается:
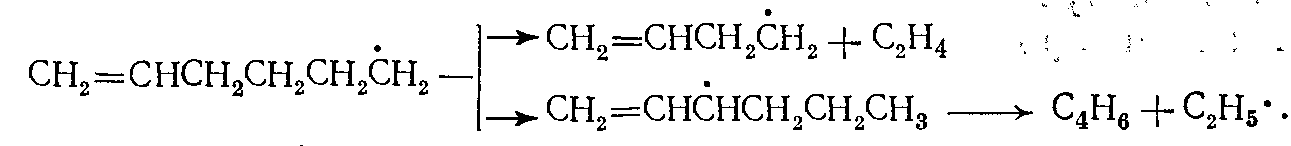 (13)
(13)Радикал С4Н7• распадается, по-видимому, с равной вероятностью по двум направлениям:
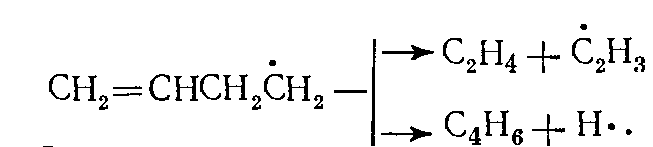 (14)
(14)Радикал •С2Н3 распадается в дальнейшем на ацетилен и Н• или, взаимодействуя с молекулой углеводорода, образует этилен. В отличие от циклопентана циклогексан не дает при разложении заметных количеств циклогексадиена; реакция дегидрирования его с образованием бензола также практически не идет, но наряду с этиленом образуется бутадиен-1,3.
При разложении метилциклогексана и метилциклопентана предпочтительной первичной реакцией является отрыв радикала –СН3. Образовавшиеся циклопентил- и циклогексил-радикалы разлагаются далее по приведенным выше схемам.
Однако при пиролизе метилциклопентана образуются и некоторые количества изобутена, следовательно, в условиях достаточно высокой степени разложения могут идти следующие реакции:
здесь R — активный радикал СН3• или атомарный водород. Аналогично при разложении метилциклогексана может образоваться наряду с этиленом изопрен или 1,3-пентадиен:
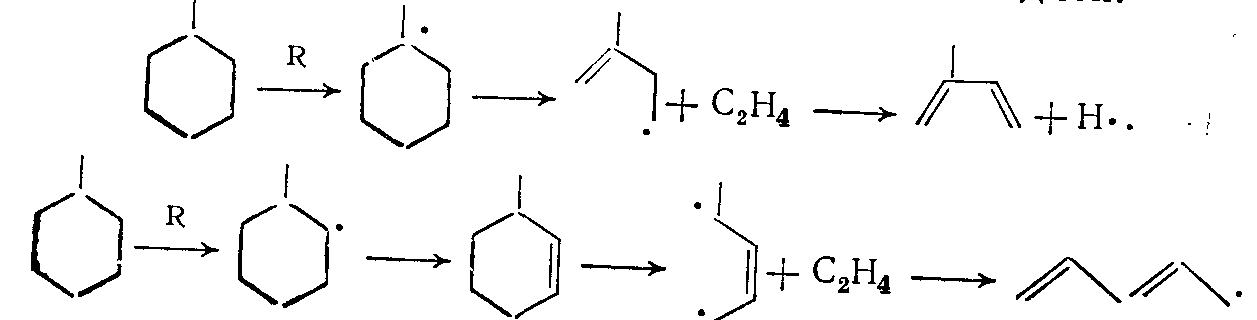 (16)
(16)Цикланы с боковой цепочкой, имеющей два или более атома углерода, распадаются в начальной стадии реакции па связи С—С между первым и вторым от нафтенового кольца атомом углерода. В меньшей степени происходит разрыв связи С—С между нафтеновым кольцом и боковой цепью с дальнейшим разложением образовавшихся радикалов по известным схемам.
Олефины и бутадиен-1,3. Олефины, как правило, в качестве сырья пиролиза не применяют. Однако низшие олефины и бутадиен-1,3 образуются на ранней стадии реакции пиролиза в значительных количествах, при этом также в небольших количествах получаются высшие олефины — С5 и выше. Например, основными продуктами разложения этилена являются водород, метан, ацетилен, бутадиен-1,3, бензол и кокс. В меньших количествах получаются этан, пропилен, углеводороды С3Н4 (пропин и пропадиен) и др.
Наиболее вероятной реакцией зарождения цепи разложения этилена является диспропорционирование:
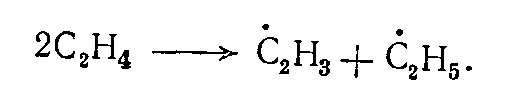
В присутствии активных радикалов •Н и •СН3 в зоне пиролиза зарождение цепи происходит в основном в результате взаимодействия их с этиленом:
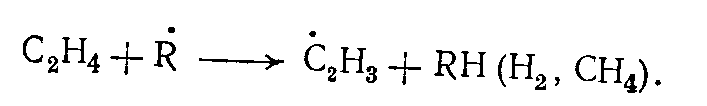
Основные продукты образуются по следующей схеме
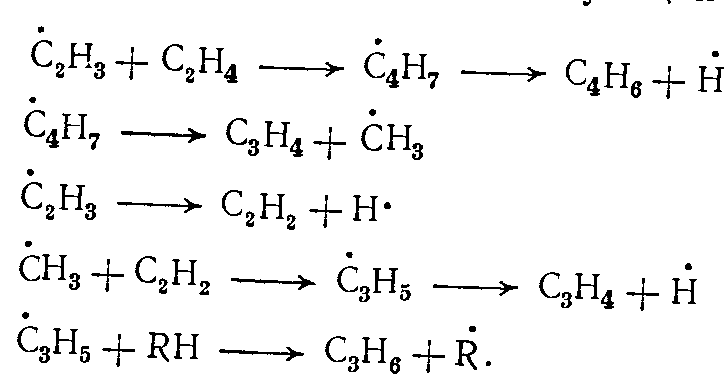 (18)
(18)Для разложения олефинов более высокомолекулярных, чем этилен, предложена общая схема. Зарождение цепи происходит либо в результате разложения исходного олефина по связи С—С в β-положении к двойной связи, либо в результате отрыва атома водорода радикалами •Н или •СН3 в β-, γ- и т. д. положении к двойной связи с образованием алкенильных и алкильных радикалов. Наряду с отрывом атома водорода радикалы, и с наибольшей вероятностью атомарный водород, могут присоединяться к исходному олефину по месту двойной связи с образованием алкилрадикалов.
Распад образующихся алкил- и алкенилрадикалов происходит по связям С—С, расположенным в β-положении к активному атому С. Если таких связей радикал не имеет, разрывается связь С—Н в β-положении к активному атому С с образованием диена. Если же в радикале имеется единственная связь С—С в β-положении к активному атому С, одновременно усиленная α-положением к двойной связи, разрыв ее равно вероятен разрыву связи С—Н, расположенной в β-положении к активному атому С.
К числу первичных ненасыщенных продуктов пиролиза, получающихся в заметных количествах, относится бутадиен-1,3. Как показывают экспериментальные данные, бутадиен-1,3 на дальнейших стадиях подвергается разложению с преимущественным получением водорода, метана и этилена.
Инициирование цепи в случае пиролиза бутадиена-1,3 как исходного вещества осуществляется, по-видимому, при разложении бутадиена-1,3 на радикалы •С2Н3 с последующим разложением их на ацетилен и атомарный водород. В дальнейшем реакция идет путем либо отрыва атома водорода от бутадиена-1,3 с последующим образованием бутенина, либо присоединения атома водорода с разложением по схеме, указанной выше.[2]
Образование жидких продуктов.
Основным компонентом жидких продуктов пиролиза являются ароматические и алкил-ароматические углеводороды. В составе жидких продуктов пиролиза имеются также алкены, в том числе значительное количество диенов и циклодиенов. Присутствуют в некотором количестве и алканы, представляющие собой в основном непрореагировавшие компоненты сырья пиролиза.
Ароматические углеводороды образуются на поздней стадии термического разложения, когда в зоне реакции имеются в достаточной концентрации низшие олефины — этилен и пропилен. Одним из важнейших маршрутов образования ароматических углеводородов является путь через радикалы •С2Н3, образующиеся из этилена и бутадиена – 1,3:
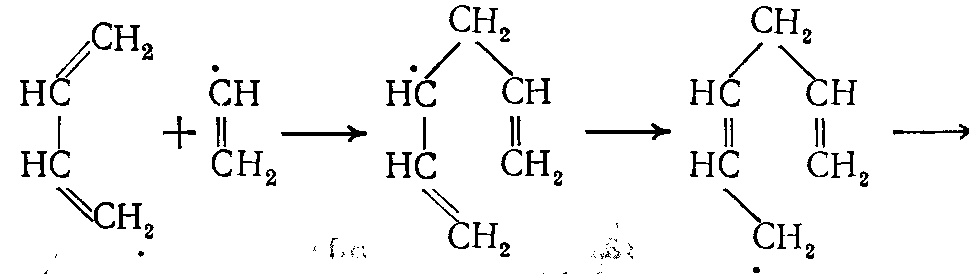
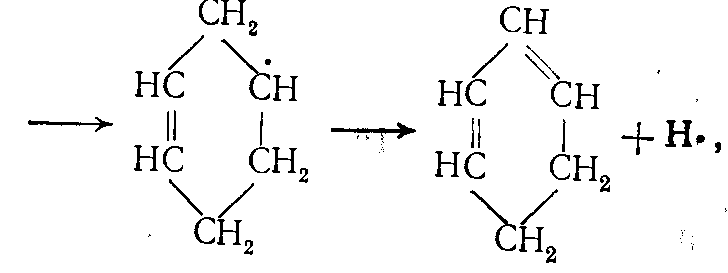 (19)
(19)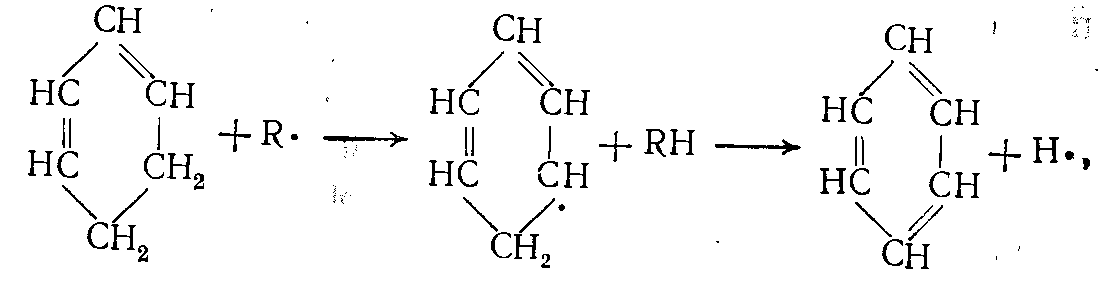 (20)
(20)здесь R• — радикалы Н• или •СН3.
Толуол получается в результате начального присоединения радикала
•СН3 к бутадиену-1,3: