Файл: Zантn 5302 Заманауи аналитикалы химияны теориялы негіздері пнінен Дрістер жинаы шымкент, 2023 растырушылар философия докторы (PhD) х.. к., Шертаева Н. Т. Заманауи аналитикалы химияны теориялы негіздері.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.11.2023
Просмотров: 289
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
қарама қайшылықтарды ескере отырып, ерітінділерді, еріткіштен, еріген заттан және қатынасы белгілі шекте өзгере алатын, олардың өзара әрекеттесу өнімдерінен тұратын гомогендік жүйелер ретінде қарастырған жөн. Негізі ерітінділер – ауыспалы құрамның көп құрауышты бір фазалы жүйелері.
Еріген зат және еріткіштің өзара әрекеттесуі өнімінің табиғаты едәуір мөлшерде бастапқы құрауыштардың табиғатымен, сонымен қатар сыртқы жағдайлармен анықталады. Ақырында бұл қосылу (сольватация), иондану және диссоциация, ассоциация және алмасу тәрізді әрекеттесу реакцияларының өтуі нәтижесінде түзілетін бөлшектер болуы мүмкін. Қосылған иондар, иондық жұптар, молекулалар, ассоциаттар қосылу өнімдері болуы мүмкін;
Су молекуласының химиялық құрамы өте қарапайым. Алайда бұл ең алдымен оның молекуласының айтарлықтай үлкен дипольдік сәтімен, су молекуласында донорлық-акцепторлық байланыстың түзілуіне, сонымен қатар сутекті байланыстардың түзілуіне қатысатын қозғалмалы сутек атомдарының түзілуіне қатысуға қабілетті, бір уақытта қолжетімді бос электрондық жұптардың болуымен байланысты.
Көрсетілген факторлар су молекулалары түрлі өзара әрекеттестіктерге аса қабілеттілігімен ерекшеленеді, соның ішінде күшті электрлік-теріс атомдарға (F, O, N, Cl) ие сутекті байланыстардың диполь-дипольдік, ион-дипольдік және донорлық-акцепторлық түзілулерімен ерекшеленеді. Нәтижесінде су жеке молекулалар түрінде мүлдем болмайды. Сұйық күйінде әр молекула дұрыс тетраэдр түзе отырып, шамамен төрт көршілес
молекулаланың айналасында болады.
Бұл ретте молекулалар арасындағы байланыстар бір атомнан басқа оттектің атомына О — Н сызығы бойынша бағытталаған. Мұндай бірнеше «ассоциаттан» кристалды құрылымның нақты типіне сәйкес келетін су молекулаларының едәуір ретті орналасуымен агрегаттар түзіледі. Мұндай агрегаттар тұрақтылықпен ерекшеленбейді, олар бір жерлерде ыдырап, екінші жерлерде түзіледі, бірақ үнемі болады. Олардың табиғатына байланысты бір көзқарас жоқ. Кейбір зерттеушілер жылтылдақ шоғырлар (кластерлер) деп есептейді, басқалары – мұз тәрізді құрылымдар немесе мұз және кварц құрылымды агрегат қоспасы деп есептейді.
Қатты денеге қарағанда, суда байқалған реттілік қарастырылатын молекула қашықтығының артуына қарай жойылады. Жалпы басқа бірқатар сұйықтықтар тәрізді су үшін де қашықтықта болмайтын, жақын арадағы реттілік тән. Бір нәрсе анық: суда молекула аралық сутекті байланыстар оның едәуір құрылымдық реттелуіне әкеледі.
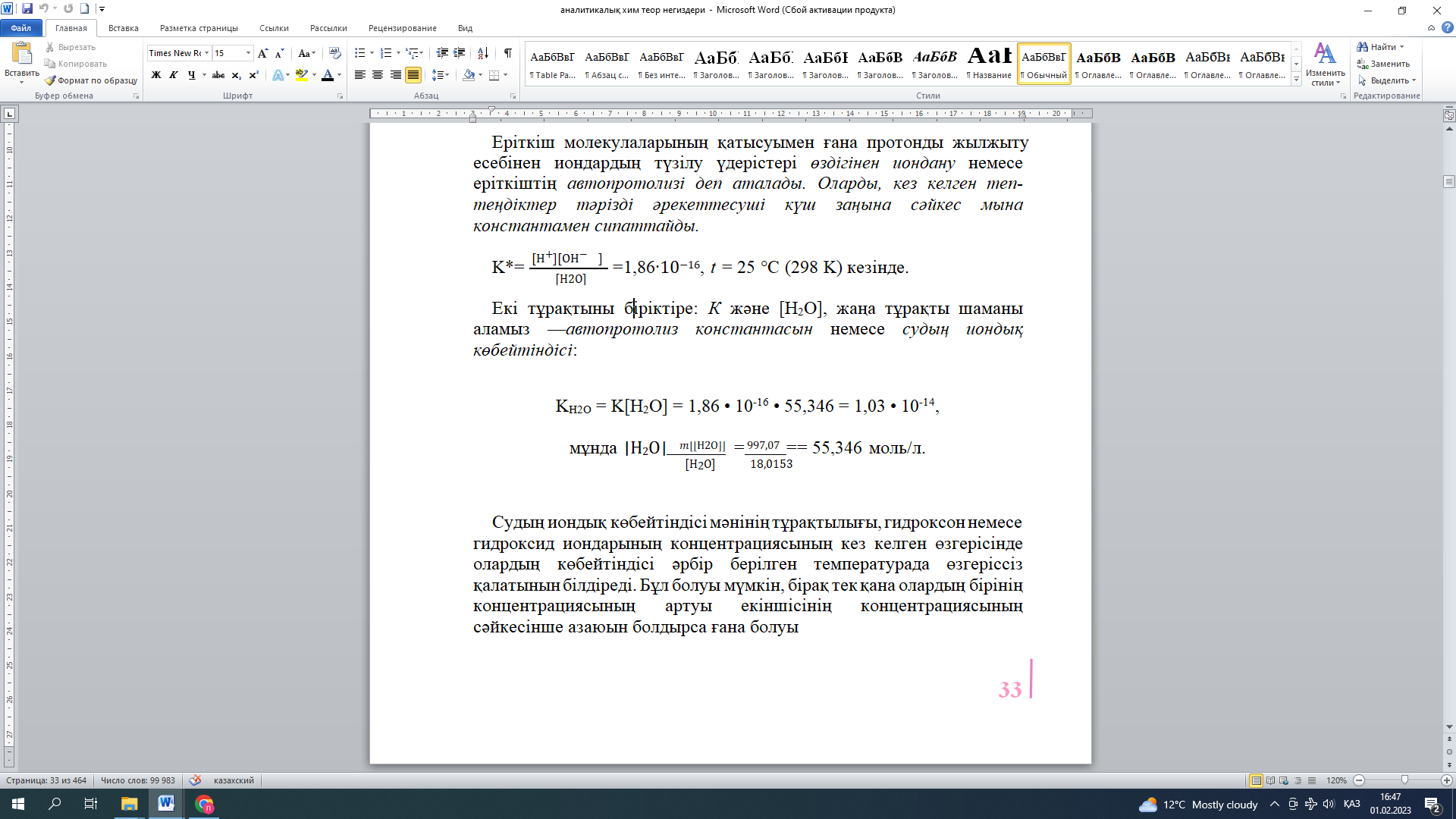
Екі тұрақтыны біріктіре: Кжәне [H2O], жаңа тұрақты шаманы аламыз —автопротолизконстантасыннемесе судыңиондықкөбейтіндісі:
KH2O = K[H2O] = 1,86 • 10-16 • 55,346 = 1,03 • 10-14,
мұнда [Н2О]????[[Н2О]] =997,07== 55,346 моль/л.
[Н2О] 18,0153
Судың иондық көбейтіндісі мәнінің тұрақтылығы, гидроксон немесе
гидроксид иондарының концентрациясының кез келген өзгерісінде олардың көбейтіндісі әрбір берілген температурада өзгеріссіз қалатынын білдіреді. Бұл болуы мүмкін, бірақ тек қана олардың бірінің концентрациясының артуы екіншісінің концентрациясының сәйкесінше азаюын болдырса ғана болуы мүмкін. Мысалы, суға 0,01М дейін концентрациялы күшті бір негізді қышқылды қосу гидроксид-иондарының концентрациясы 25 °С (298 К) кезінде 10-12 моль/л дейін азаюына әкеледі.
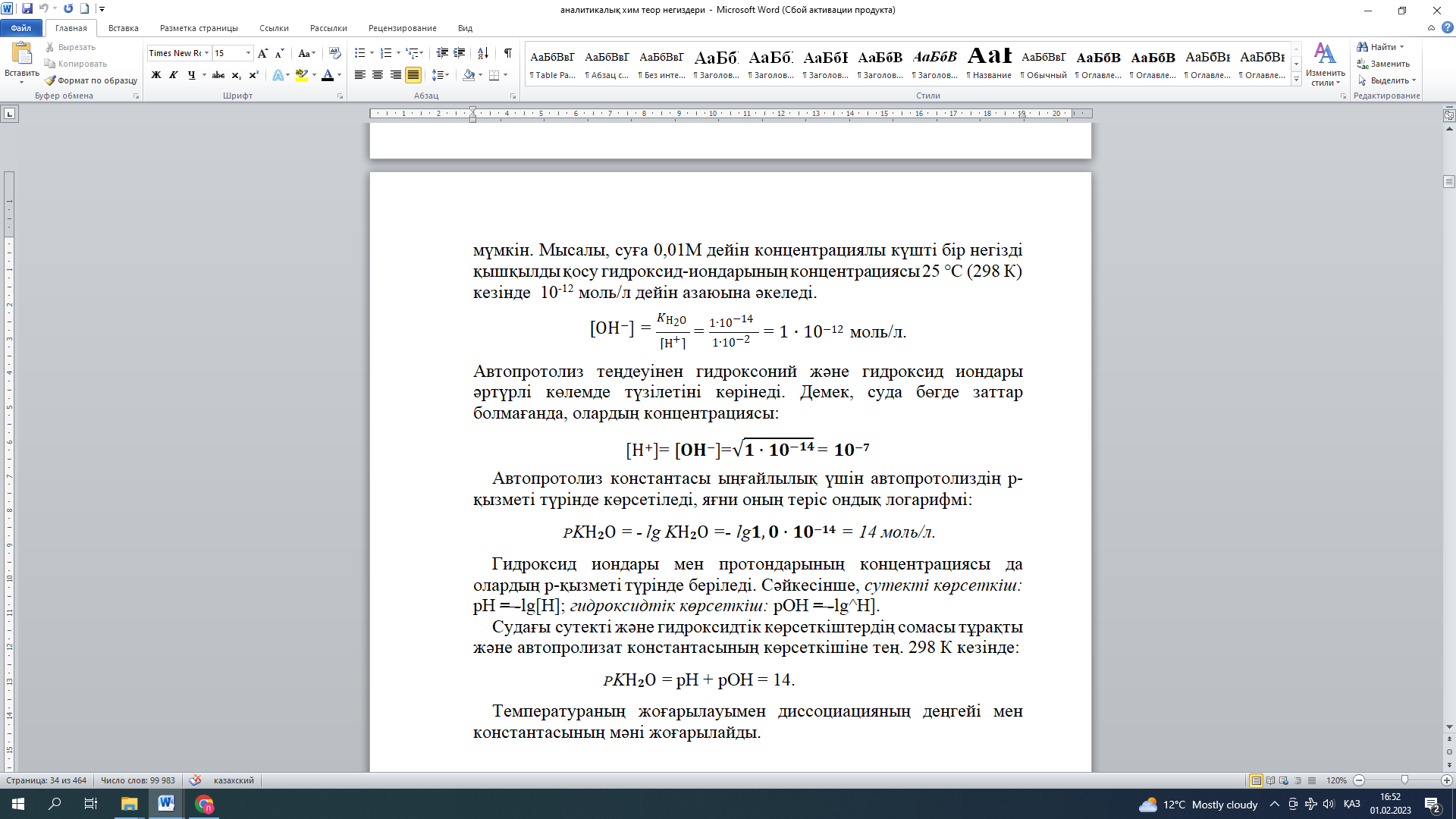
Автопротолиз теңдеуінен гидроксоний және гидроксид иондары әртүрлі көлемде түзілетіні көрінеді. Демек, суда бөгде заттар болмағанда, олардың концентрациясы:

[Н+]= [????????−]=√???? ∙ ????????−???????? = ????????−????
Автопротолиз константасы ыңғайлылық үшін автопротолиздің р- қызметі түрінде көрсетіледі, яғни оның теріс ондық логарифмі:
PKН????О =-lgKН????О =-lg????, ???? ∙ ????????−???????? =14моль/л.
Гидроксид иондары мен протондарының концентрациясы да олардың р-қызметі түрінде беріледі. Сәйкесінше, сутекті көрсеткіш:рН= -lg[H]; гидроксидтіккөрсеткіш:рОН = -lg^H].
Судағы сутекті және гидроксидтік көрсеткіштердің сомасы тұрақты және автопролизат константасының көрсеткішіне тең. 298 К кезінде:
PKН????О =pH + pOH = 14.
Температураның жоғарылауымен диссоциацияның деңгейі мен константасының мәні
жоғарылайды.
4. Гетерогенді тепе-теңдік
Баяу ерігіш қосылыстардың тұнбалану және олардың еру реакцияларын аналитикалық химияда иондар мен олардың бөлінуін анықтау үшін кеңінен қолданады. Бұдан басқа, оларды грави- және титриметрияда сандық анықтау үшін қолданады.
Бұл реакцияларда суда аз еритін күшті электролиттің кристалдары мен ерітіндідегі оның иондарының арасында тепе-теңдік орнатылады. Қаныққан ерітінді мен тұнбадан тұратын жүйе гетерогендік (біртекті емес) жүйе деп аталады.
Суда аз еритін күшті электролиттің қаныққан сулы ерітіндісінде қатты заттардың кристалдары мен (тұнба) ерітіндіде болатын оның иондары арасында тепе-теңдік орнайды. Мысалы,
AgCl (тв.) ⇄ Ag++ Cl−
Бұл жағдайда, екі қарама-қарсы үдеріс болады. Күміс хлоридінің кристалдары құрылған күміс иондары мен хлорид иондары су дипольдарымен тұнбаның бетінен ажырап, ерітіндіге тұнбаның бетімен соқтығысып, онда қалатын, гидратталған иондар түрінде өтеді.
Келтірілген тепе-теңдікті көрсететін өрнек келесі түрге ие:
[Ag+][ Cl−]= ???????? (AgCl),
мұндағы [Ag+]және[ Cl−] — қаныққан ерітіндідегі сәйкес иондардың тепе-тең концентрациялары, моль/л; KS(AgCl) — күміс хлоридінің ерігіштігінің көбейтіндісі.
Осылайша, ерігіштік көбейтіндісі- берілген температурадағы азеритінкүштіэлектролиттіңоныңқаныққанерітіндісіндегікатиондарыменаниондарыныңмолярлықконцентрациясыныңкөбейтіндісі.Жақша ішіне қосылыс формуласын көрсетіп, оны KS таңбасымен белгілейді. Әрбір аз еритін қосылыс үшін KS шамасы тұрақты температура кезінде тұрақты болады және ионның концентрациясына тәуелсіз болады. Ерігіштік көбейтіндісі үшін өрнекті жазу барысында, әр ионның концентрациясы, оған молекуладағы осы иондардың санына тең деңгейде кіретіндігін ескеру қажет. Мысалы,
Ks (Ag2S ) =
Еріген зат және еріткіштің өзара әрекеттесуі өнімінің табиғаты едәуір мөлшерде бастапқы құрауыштардың табиғатымен, сонымен қатар сыртқы жағдайлармен анықталады. Ақырында бұл қосылу (сольватация), иондану және диссоциация, ассоциация және алмасу тәрізді әрекеттесу реакцияларының өтуі нәтижесінде түзілетін бөлшектер болуы мүмкін. Қосылған иондар, иондық жұптар, молекулалар, ассоциаттар қосылу өнімдері болуы мүмкін;
Су молекуласының химиялық құрамы өте қарапайым. Алайда бұл ең алдымен оның молекуласының айтарлықтай үлкен дипольдік сәтімен, су молекуласында донорлық-акцепторлық байланыстың түзілуіне, сонымен қатар сутекті байланыстардың түзілуіне қатысатын қозғалмалы сутек атомдарының түзілуіне қатысуға қабілетті, бір уақытта қолжетімді бос электрондық жұптардың болуымен байланысты.
Көрсетілген факторлар су молекулалары түрлі өзара әрекеттестіктерге аса қабілеттілігімен ерекшеленеді, соның ішінде күшті электрлік-теріс атомдарға (F, O, N, Cl) ие сутекті байланыстардың диполь-дипольдік, ион-дипольдік және донорлық-акцепторлық түзілулерімен ерекшеленеді. Нәтижесінде су жеке молекулалар түрінде мүлдем болмайды. Сұйық күйінде әр молекула дұрыс тетраэдр түзе отырып, шамамен төрт көршілес
молекулаланың айналасында болады.
Бұл ретте молекулалар арасындағы байланыстар бір атомнан басқа оттектің атомына О — Н сызығы бойынша бағытталаған. Мұндай бірнеше «ассоциаттан» кристалды құрылымның нақты типіне сәйкес келетін су молекулаларының едәуір ретті орналасуымен агрегаттар түзіледі. Мұндай агрегаттар тұрақтылықпен ерекшеленбейді, олар бір жерлерде ыдырап, екінші жерлерде түзіледі, бірақ үнемі болады. Олардың табиғатына байланысты бір көзқарас жоқ. Кейбір зерттеушілер жылтылдақ шоғырлар (кластерлер) деп есептейді, басқалары – мұз тәрізді құрылымдар немесе мұз және кварц құрылымды агрегат қоспасы деп есептейді.
Қатты денеге қарағанда, суда байқалған реттілік қарастырылатын молекула қашықтығының артуына қарай жойылады. Жалпы басқа бірқатар сұйықтықтар тәрізді су үшін де қашықтықта болмайтын, жақын арадағы реттілік тән. Бір нәрсе анық: суда молекула аралық сутекті байланыстар оның едәуір құрылымдық реттелуіне әкеледі.

Екі тұрақтыны біріктіре: Кжәне [H2O], жаңа тұрақты шаманы аламыз —автопротолизконстантасыннемесе судыңиондықкөбейтіндісі:
KH2O = K[H2O] = 1,86 • 10-16 • 55,346 = 1,03 • 10-14,
мұнда [Н2О]????[[Н2О]] =997,07== 55,346 моль/л.
[Н2О] 18,0153
Судың иондық көбейтіндісі мәнінің тұрақтылығы, гидроксон немесе
гидроксид иондарының концентрациясының кез келген өзгерісінде олардың көбейтіндісі әрбір берілген температурада өзгеріссіз қалатынын білдіреді. Бұл болуы мүмкін, бірақ тек қана олардың бірінің концентрациясының артуы екіншісінің концентрациясының сәйкесінше азаюын болдырса ғана болуы мүмкін. Мысалы, суға 0,01М дейін концентрациялы күшті бір негізді қышқылды қосу гидроксид-иондарының концентрациясы 25 °С (298 К) кезінде 10-12 моль/л дейін азаюына әкеледі.
Автопротолиз теңдеуінен гидроксоний және гидроксид иондары әртүрлі көлемде түзілетіні көрінеді. Демек, суда бөгде заттар болмағанда, олардың концентрациясы:

[Н+]= [????????−]=√???? ∙ ????????−???????? = ????????−????
Автопротолиз константасы ыңғайлылық үшін автопротолиздің р- қызметі түрінде көрсетіледі, яғни оның теріс ондық логарифмі:
PKН????О =-lgKН????О =-lg????, ???? ∙ ????????−???????? =14моль/л.
Гидроксид иондары мен протондарының концентрациясы да олардың р-қызметі түрінде беріледі. Сәйкесінше, сутекті көрсеткіш:рН
Судағы сутекті және гидроксидтік көрсеткіштердің сомасы тұрақты және автопролизат константасының көрсеткішіне тең. 298 К кезінде:
PKН????О =pH + pOH = 14.
Температураның жоғарылауымен диссоциацияның деңгейі мен константасының мәні
жоғарылайды.
4. Гетерогенді тепе-теңдік
Баяу ерігіш қосылыстардың тұнбалану және олардың еру реакцияларын аналитикалық химияда иондар мен олардың бөлінуін анықтау үшін кеңінен қолданады. Бұдан басқа, оларды грави- және титриметрияда сандық анықтау үшін қолданады.
Бұл реакцияларда суда аз еритін күшті электролиттің кристалдары мен ерітіндідегі оның иондарының арасында тепе-теңдік орнатылады. Қаныққан ерітінді мен тұнбадан тұратын жүйе гетерогендік (біртекті емес) жүйе деп аталады.
Ерігіштік көбейтіндісі
Суда аз еритін күшті электролиттің қаныққан сулы ерітіндісінде қатты заттардың кристалдары мен (тұнба) ерітіндіде болатын оның иондары арасында тепе-теңдік орнайды. Мысалы,
AgCl (тв.) ⇄ Ag++ Cl−
Бұл жағдайда, екі қарама-қарсы үдеріс болады. Күміс хлоридінің кристалдары құрылған күміс иондары мен хлорид иондары су дипольдарымен тұнбаның бетінен ажырап, ерітіндіге тұнбаның бетімен соқтығысып, онда қалатын, гидратталған иондар түрінде өтеді.
Келтірілген тепе-теңдікті көрсететін өрнек келесі түрге ие:
[Ag+][ Cl−]= ???????? (AgCl),
мұндағы [Ag+]және[ Cl−] — қаныққан ерітіндідегі сәйкес иондардың тепе-тең концентрациялары, моль/л; KS(AgCl) — күміс хлоридінің ерігіштігінің көбейтіндісі.
Осылайша, ерігіштік көбейтіндісі- берілген температурадағы азеритінкүштіэлектролиттіңоныңқаныққанерітіндісіндегікатиондарыменаниондарыныңмолярлықконцентрациясыныңкөбейтіндісі.Жақша ішіне қосылыс формуласын көрсетіп, оны KS таңбасымен белгілейді. Әрбір аз еритін қосылыс үшін KS шамасы тұрақты температура кезінде тұрақты болады және ионның концентрациясына тәуелсіз болады. Ерігіштік көбейтіндісі үшін өрнекті жазу барысында, әр ионның концентрациясы, оған молекуладағы осы иондардың санына тең деңгейде кіретіндігін ескеру қажет. Мысалы,
Ks (Ag2S ) =