Файл: Современные образовательные технологии (кейс метод) на уроках химии.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 30.11.2023
Просмотров: 169
Скачиваний: 5
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Приложение 6 Соли - пигменты художественных красок
| Техническое наз-вание соли или название краски | соль | цвет | примечания |
| Мел Гипс | CaCO3 CaSO4.2H2O | Белый Белый | Входит в состав ху-дожественных грунтов и клеевых красок |
| Свинцовые белила | 2PbCO3.Pb(OH)2 | Белый | Один из древнейших пигментов, темнеет под действием H2S |
| Бланфикс (бари-товые постоян-ные белила) | BaSO4 | Белый | Промышленный выпуск налажен в 1830 году |
| Цинковая желтая | ZnCrO4 | Желтый | Получена Л. Вокленом в 1809 году |
| Баритовая желтая | BaCrO4 | Желтый | Получена Л. Вокленом в 1809 году |
| Азурит (горная синяя) | 2CuCO3.Cu(OH)2 | Синий | В природе часто встре-чается с малахитом |
| Берлинская ла-зурь (прусская синяя, милора) Вивианит (охра синяя) | Fe4[Fe(CN)6]3 Fe3(PO4)2.8H2O | Синий Синий | Под действием щело-чей разрушаются с об-разованием оксида же-леза. Неприменимы во фресковой живописи. |
| Швейнфуртская зелень | Cu(CH3COO)2. 3Cu(AsO2)2 | Зеленый | Во 2 половине 19 века применялась в качестве инсектицида. |
| Малахит (горная зелень) Ярь – медянка | CuCO3.Cu(OH)2 Cu(CH3COO)2. 3Cu(OH)2 | Зеленый Зеленый | В живописи широко применялись в стари-ну, сейчас практически не используются |
| Темный кобальт | Co3(PO4)2 | Фиолетовый | Получена М. Сальве-татом в 1859 году |
Урок по химии по теме
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ ЯВЛЕНИЯ
8 класс
Тип кейса: обучающий
Задание:
Содержание кейса
В одном из пособий для трудовой школы по химии (1927 год) было дано задание: "Проследите со всею внимательностью все явления, которые происходят в то время, когда "ставится" самовар. Запишите, какие из этих явлений вы отнесете к физическим и какие - к химическим, начиная от наливания в самовар воды и закладки углей, не забыв зажигания спички и явлений, происходящих при этом, и кончая заваркой чая, наливанием его в стакан и растворением сахара. Обратите внимание, во что превратится уголь, не получилось ли радужных полос на медной крышке самовара около кувшина (внутренней трубы самовара)". Дайте ответ и вы.
-
Разберите данную ситуацию, проведите ее анализ. -
Какие явления называются физическими? -
Какие явлениями называются химическими? -
Составьте список последовательных действий при чаепитии. -
Какие из перечисленных вами действий при чаепитии относятся к физическим, а какие – к химическим явлениям?
Информационный материал
Всё, что нас окружает: и живая, и неживая природа, находится в постоянном движении и непрерывно изменяется: движутся планеты и звёзды, идут дожди, растут деревья. И человек, как известно из биологии, постоянно проходит какие-либо стадии развития. Перемалывание зёрен в муку, падение камня, кипение воды, молния, свечение лампочки, растворение сахара в чае, движение транспортных средств, молнии, радуги – это примеры физических явлений.
И с веществами (железо, вода, воздух, соль и др.) происходят разнообразные изменения, или явления. Вещество может быть кристаллизировано, расплавлено, измельчено, растворено и вновь выделено из раствора. При этом его состав останется тем же.
Так, сахарный песок можно измельчить в порошок настолько мелкий, что от малейшего дуновения он будет подниматься в воздух, как пыль. Сахарные пылинки можно разглядеть лишь под микроскопом. Сахар можно разделить ещё на более мелкие части, растворив его в воде. Если же выпарить из раствора сахара воду, молекулы сахара снова соединяться друг с другом в кристаллы. Но и при растворении в воде, и при измельчении сахар остаётся сахаром.
В природе вода образует реки и моря, облака и ледники. При испарении вода переходит в пар. Водяной пар – это вода в газообразном состоянии. При воздействии низких температур (ниже 0˚С) вода переходит в твёрдое состояние – превращается в лёд. Мельчайшая частичка воды – это молекула воды. Молекула воды является и мельчайшей частичкой пара или льда. Вода, лёд и пар не разные вещества, а одно и то же вещество (вода) в разных агрегатных состояниях.
Подобно воде, и другие вещества можно переводить из одного агрегатного состояния в другое.
Характеризуя то или другое вещество как газ, жидкость или твёрдое вещество, имеют в виду состояние вещества в обычных условиях. Любой металл можно не только расплавить (перевести в жидкое состояние), но и превратить в газ. Но для этого необходимы очень высокие температуры. Во внешней оболочке Солнца металлы находятся в газообразном состоянии, потому что температура там составляет 6000˚С. А, например, углекислый газ путём охлаждения можно превратить в «сухой лёд».
Явления, при которых не происходит превращений одних веществ в другие, относят к физическим явлениям.
Физические явления могут привести к изменению, например, агрегатного состояния или температуры, но состав веществ останется тем же.
Со всеми предметами, которые нас окружают, происходят различные изменения.
Если нагреть медную пластину на воздухе, она потеряет свой блеск и покроется налётом черного цвета, который можно легко соскоблить. Повторяя этот процесс много раз, можно всю медь превратить в чёрный порошок, этот порошок называется оксид меди. Оксид меди – это новое вещество, которое обладает новыми свойствами. И при охлаждении чёрный порошок снова не станет медью.
Лента металла магния, если её поджечь, горит с ярким, ослепительным светом. Получается новое вещество – оксид магния.
Возьмём стеклянную трубку и будем продувать воздух через раствор извести – известковую воду. Жидкость станет мутной, потому что в ней образуется белый порошок, похожий на мел. Постепенно этот порошок осядет на дно сосуда. Этот осадок является новым веществом, которое образовалось из растворённой в воде извести и углекислого газа.
Если нагреть сахар в пробирке, мы увидим, как он плавится и постепенно приобретает коричнево-бурый цвет с выделением едкого запаха. На стенках пробирке появятся капельки воды, несмотря на то, что сахар был совершенно сухим. В конце опыта сахар превратится в вещество чёрного цвёта, безвкусное и нерастворимое в воде – это уголь.
При горении древесины происходит выделение воды и углекислого газа. Мы не можем этого видеть, но если провести ряд экспериментов это станет очевидным. Если поднести горящую спичку к перевёрнутому стакану, на стенках стакана изнутри осядут капельки воды.
Что же общего в описанных явлениях? Во всех случаях из одних веществ получаются другие вещества. Все рассмотренные нами явления – это примеры химических явлений.
Химическими явлениями называются такие явления, при которых из одних веществ образуются другие вещества. Химические явления называют химическими реакциями.
В рамках проведения курсов повышения квалификации учителей химии по программе ««Проектирование и реализация системы обеспечения достижения обучающимися планируемых результатов освоения химии в условиях реализации федерального государственного образовательного стандарта основного общего образования по химии» были разработаны кейсы по курсу химии 8-11 классов.
Несинова Мария Владимировна МБОУ «Густомойская СОШ»
Льговского района
Ноздрина Юлия Владимировна МКОУ «Ванинская СОШ»
Октябрьского района
Урок по химии по теме
ПОЛУЧЕНИЕ КИСЛОРОДА
8 класс
Тип кейса: обучающий
Задание:
Содержание кейса
Та история простая…
Джозеф Пристли, как- то раз
окись ртути нагревая,
обнаружил странный газ.
Газ без цвета, без названья.
Ярче в нем горит свеча.
А не вреден для дыханья?
(Не узнаешь у врача!)
Новый газ из колбы вышел –
никому он не знаком.
Этим газом дышат мыши
под стеклянным колпаком.
Человек им тоже дышит.
Джозеф Пристли быстро пишет:
«Воздух делится на части».
(Эта мысль весьма нова).
Здесь у химика от счастья
и от воздуха отчасти
(от его важнейшей части)
закружилась голова…
Кошка греется на крыше.
Солнца луч в окошко бьет.
Джозеф Пристли с ним две мыши
Открывают КИСЛОРОД.
Задания:
Проанализируйте стихотворение и ответьте на вопросы.
1. Какой газ обнаружил Д. Пристли, нагревая оксид ртути?
2. Опишите его физические свойства.
3. Почему способ получения кислорода методом Д. Пристли в данное время потерял актуальность?
4. Назовите способы получения кислорода в настоящее время.
5.Назовите составные части воздуха.
6. Заполните таблицу.
Информационный материал
Открытие кислорода.
В конце XVIII в. английский ученый Д. Пристли занимался нагреванием разных веществ, собирая солнечные луч при помощи увеличительного стекла. Когда он накаливал таким образом оксид ртути (II) HgO - в приборе, и
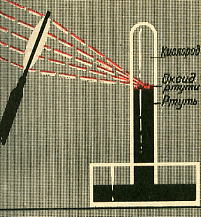 зображенном на рисунке, выделилось много газа. Сначала Д. Пристли подумал, что это воздух. Но когда он опустил в сосуд с собранным газом горящую свечу, то увидел нечто необычное. "Меня поразило,- писал Д. Пристли, - больше, чем я мог выразить, что свеча в этом газе горела замечательно блестящим пламенем".
зображенном на рисунке, выделилось много газа. Сначала Д. Пристли подумал, что это воздух. Но когда он опустил в сосуд с собранным газом горящую свечу, то увидел нечто необычное. "Меня поразило,- писал Д. Пристли, - больше, чем я мог выразить, что свеча в этом газе горела замечательно блестящим пламенем".Д. Пристли поместил одну мышь в сосуд с обыкновенным воздухом, а другую в такой же сосуд с полученным им газом. Первая мышь быстро задохнулась, а вторая в это время еще чувствовала себя хорошо и оживленно двигалась. Д. Пристли и сам пробовал дышать полученным газом и нашел, что им дышится легко и приятно.
Характеристика элемента.
Химический знак элемента - О, относительная атомная масса равна 16.
Кислород - самый распространенный химический элемент на поверхности земного шара. В свободном состоянии (в виде простого вещества) содержится в воздухе, в связанном - в воде Н