ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 327
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
В качестве приборов для разложения пробы при высоких температурах в последнее время всё шире используются специальные микроволновые печи. Использование микроволнового нагревания вместо традиционного термического позволяет ускорить процесс разложения пробы в 10-20 раз.
ГЛАВА 9
9.1. Общая характеристика и классификация
Всякий раз, когда химик сталкивается с необходимостью анализа сложного объекта, в котором наряду с интересующим его соединением содержится много других веществ, и, кроме того, концентрация этого соединения очень мала, перед ним обязательно встают следующие проблемы. Во-первых, как добиться того, чтобы посторонние вещества не мешали определению? Во-вторых, можно ли повысить концентрацию вещества в исследуемом объекте? Для решения подобных проблем в аналитической химии используют разнообразные методы разделения и концентрирования.
Разделение- любой процесс или операция, в результате которых компоненты, составляющие исходную смесь, отделяются один от другого. Процесс, в котором нужные компоненты выделяют в самостоятельную фазу или часть фазы, называется выделением.
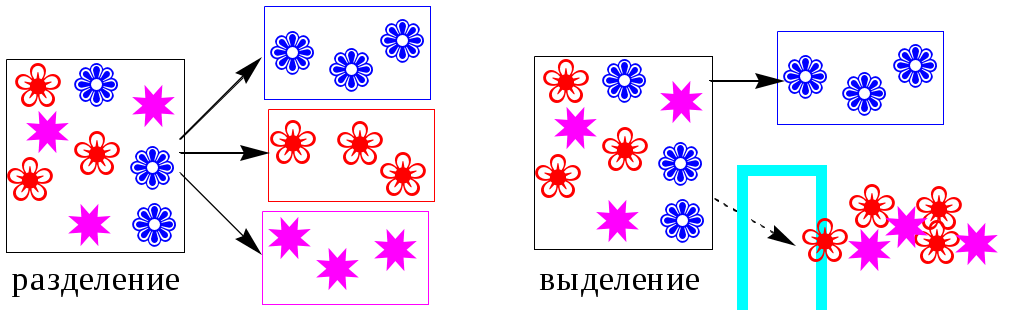
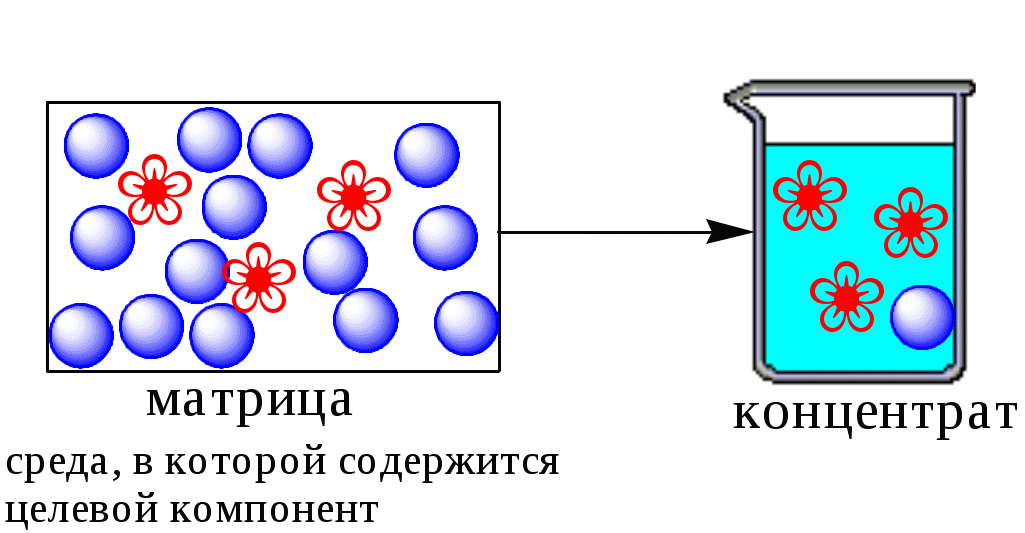
Концентрирование - процесс или операция повышения содержания определяемого вещества по отношению к матрице или матричным компонентам.
Концентрирование является частным случаем разделения. В основе этих операций лежат, как правило, одни и те же процессы. Различие между ними заключается в целях проведения. Цель разделения - упрощение способов определения интересующего нас вещества, цель концентрирования - снижение предела обнаружения (определения) вещества.
Для количественной характеристики эффективности разделения и концентрирования используют, соответственно, коэффициент разделения и коэффициент концентрирования. Рассмотрим, например, процесс разделения веществ, основанный на их различном распределении между двумя фазами. Отношение общих концентраций вещества в одной и второй фазах называется коэффициентом распределения (D).
Коэффициент разделения (KA/B) - это отношение коэффициентов распределения двух веществ.
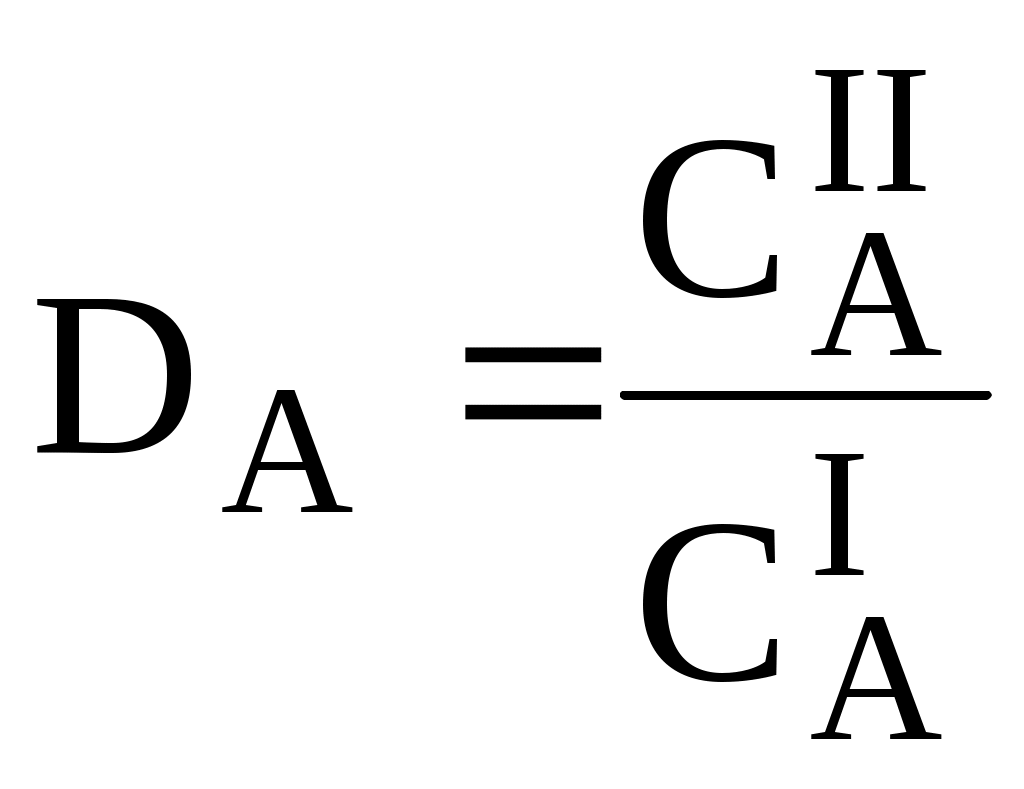
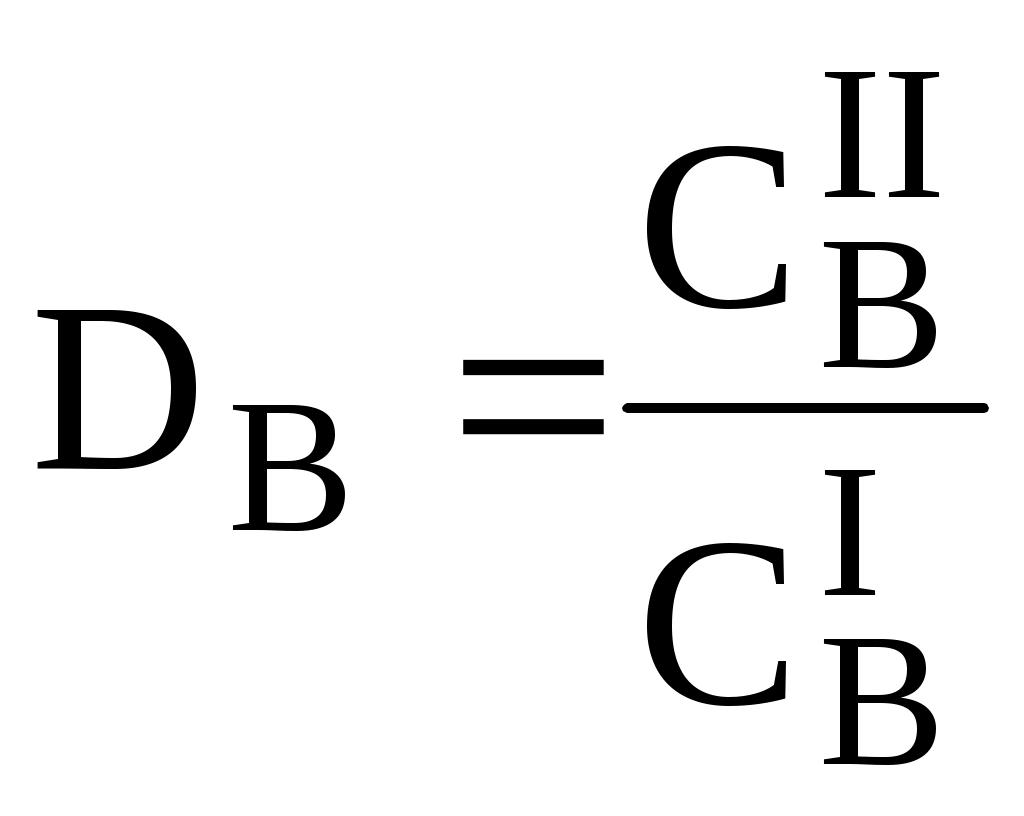
Разделение считается эффективным, если значение KA/B велико, а произведение DADB близко к 1.
Коэффициент концентрирования – величина, показывающая во сколько раз изменяется отношение абсолютных количеств микро - и макрокомпонента в концентрате по сравнению с исследуемой матрицей.
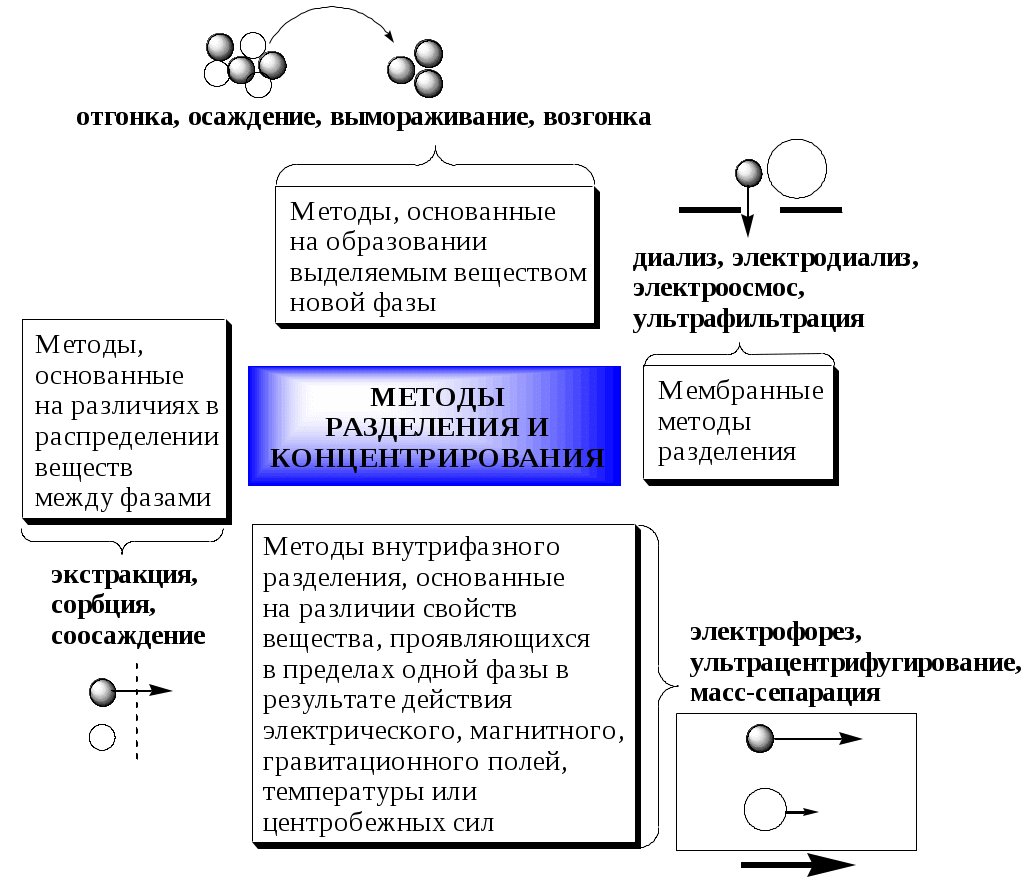
В настоящее время известны десятки различных методов разделения и концентрирования веществ. Единой и общепринятой их классификации нет. Обычно в качестве основного классификационного критерия используют наличие и характер фазовых переходов.
Методы разделения, основанные на различном межфазном распределении веществ, в которых одна из фаз является подвижной, а другая - неподвижной и процесс переноса вещества между ними происходит многократно, называются хроматографическими. Хроматографические процессы могут протекать в системе жидкость-жидкость (жидкость-жидкостная хроматография), жидкость - твёрдое вещество (адсорбционная хроматография, ионообменная хроматография и др.), газ - жидкость (газожидкостная хроматография) и т.д.
9.2. Жидкость - жидкостная экстракция
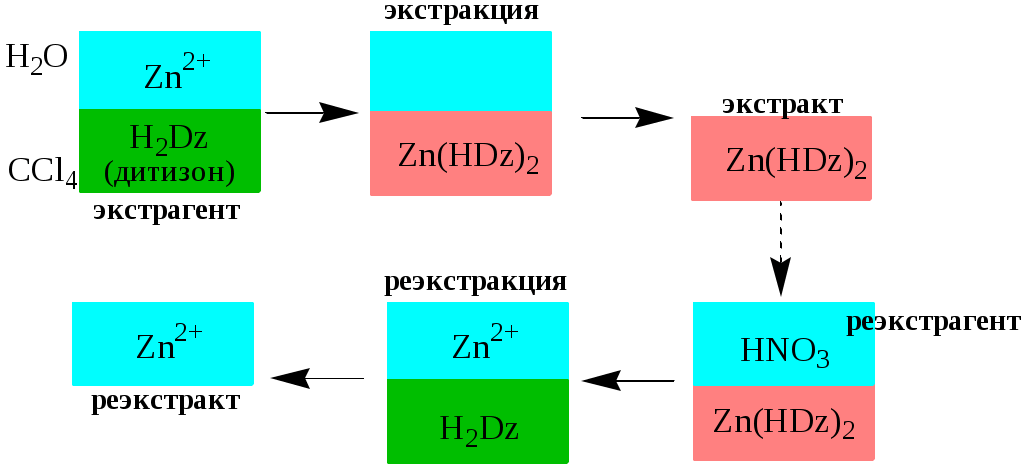
Жидкость-жидкостная экстракция - метод разделения и концентрирования веществ, основанный на их различном распределении между двумя несмешивающимися жидкими фазами, обычно между водой и несмешивающимся с ней органическим растворителем.
Жидкая фаза (органический растворитель или их смесь), в которую переходит вещество, например, из водной фазы называется экстрагентом. Если экстракция обусловлена образованием новых химических соединений, то экстрагентом обычно называют реагент, при взаимодействии с которым образуется экстрагируемое соединение. Отделённая органическая фаза, содержащая вещество, экстрагированное из водной фазы, называется экстрактом. Процесс обратного извлечения вещества из экстракта в водную фазу называется реэкстракцией
. Раствор, используемый для извлечения вещества из экстракта, называется реэкстрагентом. Отделённая водная фаза, которая содержит вещества, извлечённые из экстракта в результате реэкстракции, называется реэкстрактом.
9.2.1. Количественные характеристики экстракционного равновесия
Экстракционное равновесие описывается с помощью закона распределения Нернста.
При постоянной температуре третий компонент, добавленный к системе, состоящей из двух несмешивающихся или ограниченно смешивающихся жидкостей, распределяется между ними в определённом постоянном для данной температуры соотношении.
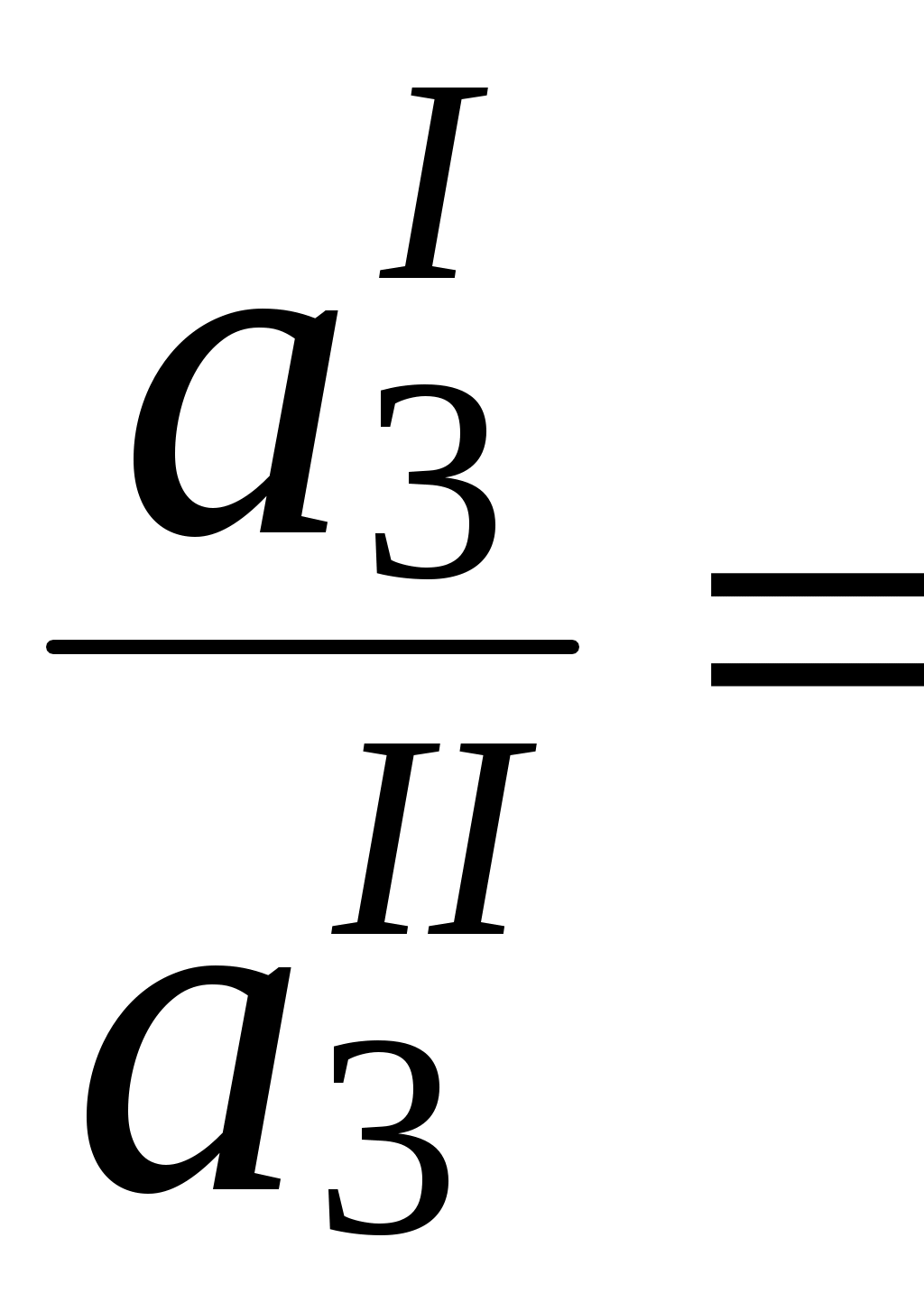 K0 - термодинамическая константа экстракции
K0 - термодинамическая константа экстракцииНа практике для описания экстракционного равновесия используют:
константа распределения (P0),
коэффициент распределения (D),
степень однократной экстракции (R),
константа экстракции (Kex).
Константа распределения - это отношение равновесной концентрации строго определённой формы вещества в органической фазе к равновесной концентрации этой же формы в водной фазе.
Коэффициент распределения - это отношение общей концентрации всех форм существования экстрагируемого вещества в органической фазе к общей концентрации всех его форм, находящихся в водной фазе.
Например, при экстракции слабой кислоты из водной фазы неполярным органическим растворителем
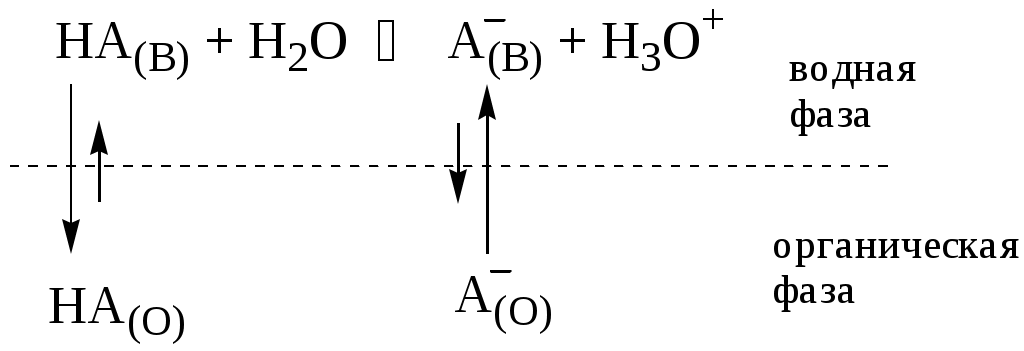
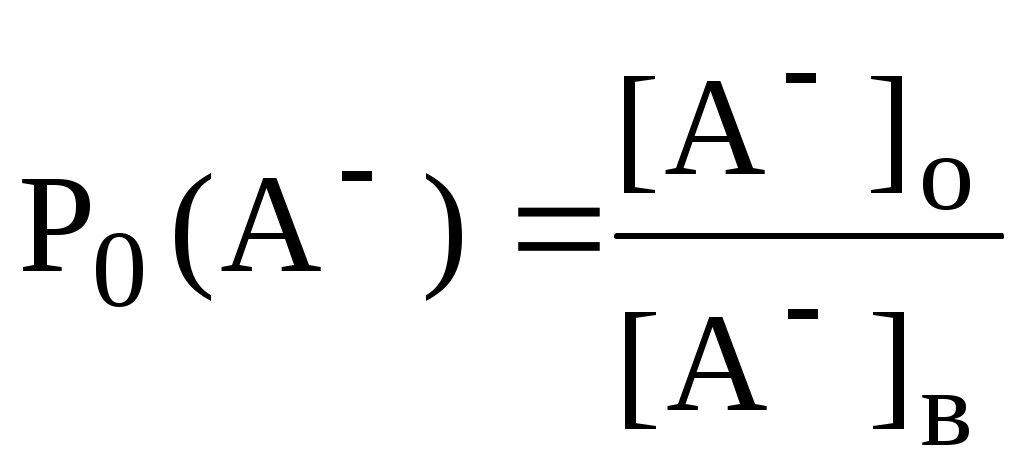
Степень однократной экстракции - доля вещества от его начального количества, экстрагируемая в фазу органического растворителя за одну экстракцию при данных условиях.
Если в процессе экстракции протекает химическая реакция, то для характеристики экстракционного равновесия используют константу экстракции. Например
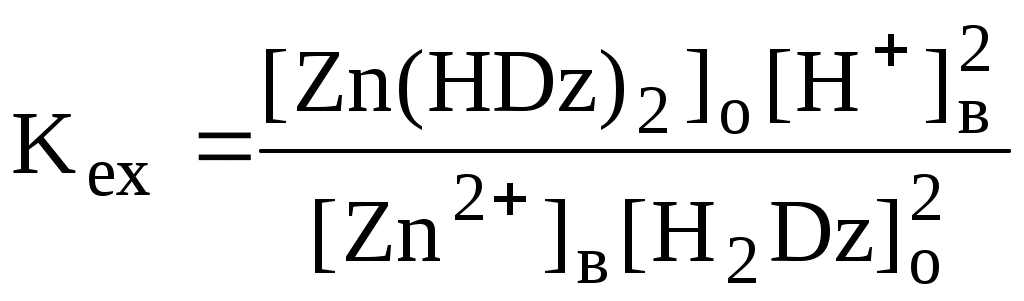
9.2.2. Экстракционные системы и экстрагенты
Все экстракционные системы можно разделить на 2 группы

В первом типе экстракционных систем разделение происходит в результате разности энергий сольватации и гидратации экстрагирующегося вещества. В органическую фазу переходят вещества, которые плохо гидратируются в водных растворах. Обычно это незаряженные соединения с крупными неполярными молекулами. Наличие гидрофильных групп в молекуле вещества уменьшает его способность экстрагироваться неполярным органическим растворителем, в то время как крупные углеводородные остатки увеличивают эту способность.
В гомологическом ряду с увеличением числа атомов углерода (n) способность вещества экстрагироваться неполярным растворителем повышается, причём lgP0 линейно зависит от n (рис. 9.1).
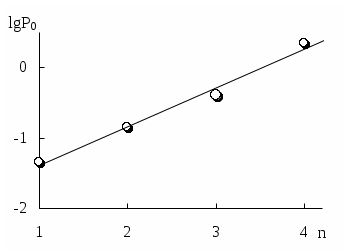
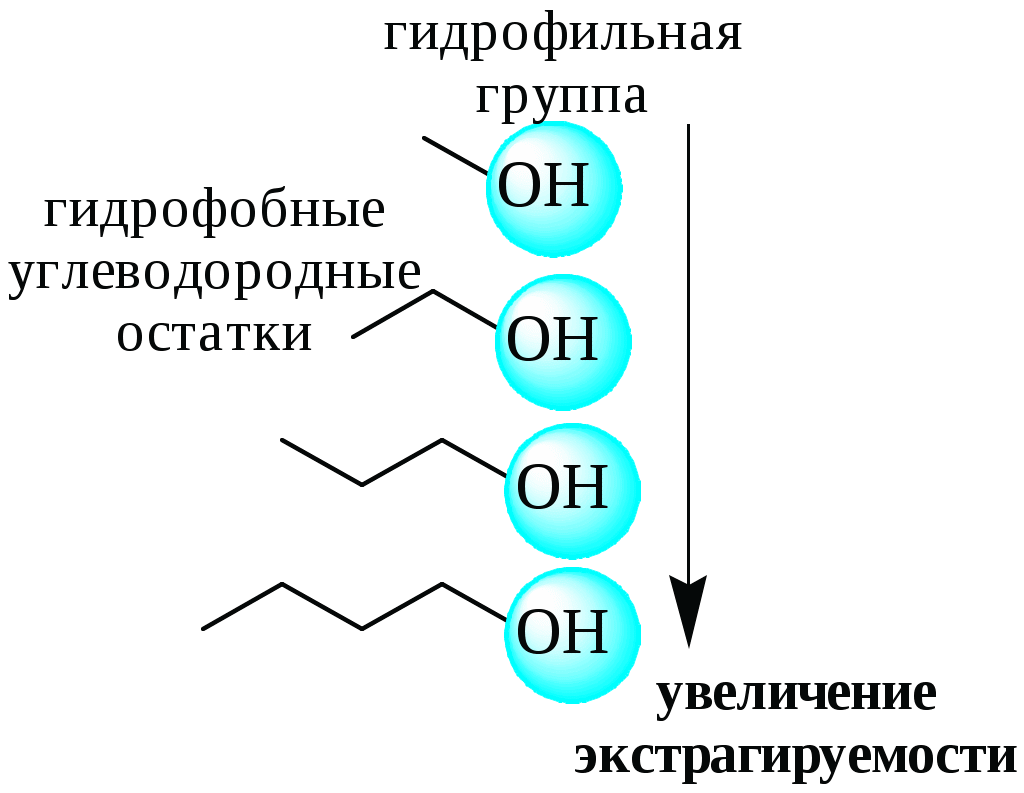
Рис. 9.1. Изменение экстрагируемости в гомологическом ряду н-алканолов в системе хлороформ-вода
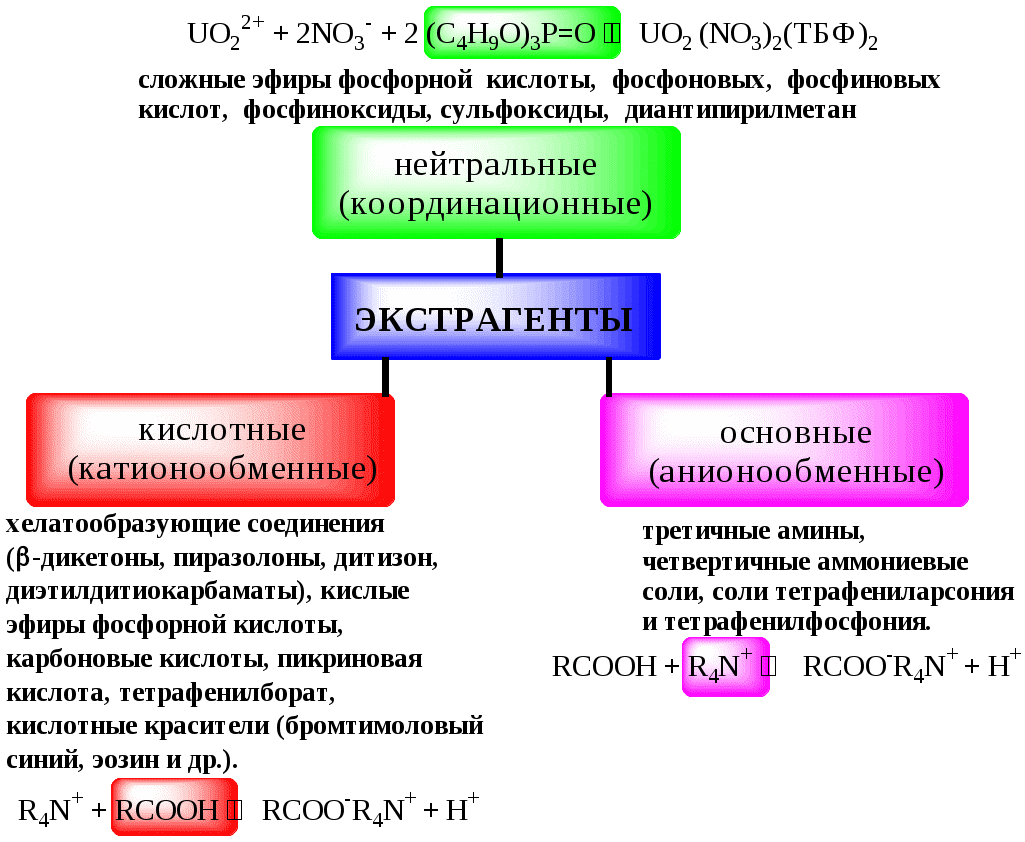
В основе реакционной экстракции лежит взаимодействие вещества с экстрагентом с образованием соединения, которое экстрагируется лучше, чем исходное вещество. В зависимости от кислотно-основных свойств экстракционные реагенты обычно разделяют на
9.2.4. Влияние различных факторов на процесс экстракции
Основными факторами, влияющими на процесс экстракции, являются:
природа экстрагируемого вещества и экстрагента,
температура,
рН,
соотношение объёмов водной и органической фаз,
методика проведения экстракции