ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.12.2023
Просмотров: 119
Скачиваний: 3
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Государственное образовательное учреждение
Читинская государственная медицинская академия
Л.П. Никитина, А.Ц. Гомбоева, Н.С. Кузнецова
БИОХИМИЯ
АЗОТИСТЫЙ ОБМЕН
В НОРМЕ И ПРИ ПАТОЛОГИИ
Под редакцией проф. Б.С. Хышиктуева
Чита, 2009
Л.П. Никитина
А.Ц. Гомбоева
Н.С. Кузнецова
Данное пособие предназначено для студентов медицинских вузов. В нем достаточно лаконично, доступным языком излагаются сведения о различных азотсодержащих соединениях, в первую очередь, об аминокислотах, нуклеотидах и их биополимерах – белках, нуклеиновых кислотах.
Оглавление
| Список сокращений . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | ||
| Введение. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | ||
| Глава 1. Классификация и общность ролей азотсодержащих соединений . . | | ||
| Глава 2. Метаболизм аминокислот . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | ||
| | 2.1. Гидролитическая стадия катаболизма полипептидов . . . . . . . . . . | | |
| | 2.2. Судьба аминокислот в клетке . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | |
| | 2.2.1. Варианты неспецифических преобразований . . . . . . . . . . . . . . . | | |
| | | 2.2.1.1. Реакции декарбоксилирования . . . . . . . . . . . . . . . . . . . . . . . . . | |
| | | 2.2.1.2. Лишение аминокислоты аминогруппы . . . . . . . . . . . . . . . . . . | |
| | | 2.2.1.3. Особенности метаболизма циклических аминокислот . . . . . | |
| | | 2.2.1.4. Судьба продуктов распада аминокислот . . . . . . . . . . . . . . . . . | |
| | 2.3. Анаболизм аминокислот . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | |
| | 2.4. Особенности обмена отдельных аминокислот . . . . . . . . . . . . . . . . | | |
| Тесты к главам 1, 2 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | ||
| Глава 3. Метаболизм нуклеотидов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | ||
| | 3.1. Классификация и номенклатура нуклеотидов . . . . . . . . . . . . . . . . | | |
| | 3.2. Особенности строения, биологическая роль нуклеиновых соединений . . . . . | | |
| | | 3.2.1. Функции мононуклеотидов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | |
| | | 3.2.2. Значение динуклеотидов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | |
| | | 3.2.3. Полинуклеотиды . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | |
| | | 3.2.3.1. Виды РНК . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | |
| | | 3.2.3.2. Варианты ДНК . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | |
| | | 3.2.3.3. Физико-химические и биологические свойства сложных нуклеотидов | |
| | 3.3. Катаболическая фаза обмена нуклеиновых структур . . . . . . . . . . | | |
| | | 3.3.1. Распад нуклеопротеинов в ЖКТ и тканях . . . . . . . . . . . . . . . . . | |
| | | 3.3.2. Специфические пути преобразованийнуклеозидов . . . . . . . . . | |
| | | 3.3.2.1. Конечный продукт обмена пуринов – мочевая кислота . . . | |
| | | 3.3.2.2. Схема разрушений пиримидиновых колец . . . . . . . . . . . . . . | |
| | 3.4. Пути синтеза мононуклеотидов . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | |
| | | 3.4.1. Генез пуриновых нуклеотидов . . . . . . . . . . . . . . . . . . . . . . . . . . | |
| | | 3.4.2. Образование пиримидиновых циклов . . . . . . . . . . . . . . . . . . . . | |
| | | 3.4.3. Подготовка мононуклеотидов к полимеризации . . . . . . . . . . . . | |
| | 3.5. Патология обмена пуриновых соединений . . . . . . . . . . . . . . . . . . . | | |
| Тесты к главе 3 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | ||
| Глава 4. Синтез азотсодержащих биополимеров . . . . . . . . . . . . . . . . . . . . . . . | | ||
| | 4.1. Общие принципы реакций . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | |
| | 4.2. Репликация ДНК . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | |
| | 4.3. Транскрипция РНК . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | |
| | 4.4. Генерирование полинуклеотидов . . . . . . . . . . . . . . . . . . . . . . . . . . . | | |
| | 4.5. Регуляция биосинтеза азотсодержащих биополимеров . . . . . . . . . | | |
| | 4.6. Причины нарушений генеза нуклеиновых кислот и белков . . . . . | | |
| | 4.7. Принципы профилактики и терапии наследственных болезней . . | | |
| Тесты к главе 4 . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | ||
| Ответы на тесты . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .. | | ||
| Список литературы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | ||
| Приложение . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | ||
| Словарь генетических терминов . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . | | ||
| | | | |
| | | | |
| | | | |
Список сокращений
АДФ – аденозинтрифосфат
АлАТ – аланинаминотрансфераза
АМФ – аденозинмонофосфат
АО – антиоксидант
АРЗ – антирадикальная защита
АсАТ – аспартатаминотрансфераза
АТФ – аденозинтрифосфат
ВЖК – высшая жирная кислота
ГАМК – гамма–аминомасляная кислота
ГГФРТ – гипоксантингуанинфосфорибозилтрансфераза
ГДФ – гуанозиндифосфат
ГМФ – гуанозинмонофосфат
ГНГ – глюконеогенез
ГФ – глицеролфосфатид(ы)
ГЧЭ – гормончувствительный элемент
гя–РНК – гетерогенная ядерная рибонуклеиновая кислота
ДГАФ –дигидроксиацетонфосфат
ДОФА – ди(гидр)оксифенилаланин
ЖКТ – желудочно-кишечный тракт
ИМФ – инозинмонофосфат
и–РНК – информационная рибонуклеиновая кислота
КоА – коэнзим ацилирования
НАД+ – никотинамидадениндинуклеотид
НАД+Ф – никотинамидадениндинуклеотидфосфат
НТФ – нуклеозидтрифосфат
ОА – оксалоацетат
ОМФ – оритидинмонофосфат
ПВК – пировиноградная кислота
ПФП – пентозофосфатный путь
РНДФ – рибонуклеозиддифосфат
РМНФ – рибонуклеозидмонофосфат
РНК – рибонуклеиновая кислота
р–РНК – рибосомальная рибонуклеиновая кислота
РНТФ – рибонуклеозидтрифосфат
СТГ – соматотропный гормон
ТГФК – тетрагидрофолиевая кислота
ТДФ – тиаминдифосфат
ТМФ – тимидинмонофосфат
т–РНК – транспортная рибонуклеиновая кислота
УМФ – уридинмонофосфат
УТФ – уридинтрифосфат
ФАД – флавинадениндинуклеотид
ФАФС – фосфоаденозинфосфосульфат
ФМН – флавинмононуклеотид
ФРПФ – фосфорибозилпирофосфат
ц–АМФ – циклический аденозинмонофосфат
ЦДФ – цитидиндифосфат
ЦМФ – цитидинмонофосфат
ЦТК – цикл трикарбоновых кислот
ЭТЦ – электроно-транспортная цепь
H – гистон
SAM – S-аденозилметионин
Введение
Судьба находящихся в клетках веществ имеет следующие альтернативы: основная часть молекул используется как строительный, рецепторный, каталитический, регуляторный материал; другая же, распадаясь, служит энергоисточником для жизнедеятельности. Основными биоэлементами органических соединений служат C, H, O, N, S, P и чтобы легче было обеспечивать выполнение, точнее разделение вышеперечисленных функций, природа предложила следующий вариант. Вещество, состоящее лишь из атомов С, Н, О – хороший энергоисточник, из-за наличия электроотрицательного О содержит непрочные полярные связи, что облегчает дегидрирование, а позднее обеспечивает транспорт Н
+ и в ЭТЦ, окислительное фосфорилирование.
Включение атомов азота, способных за счет неподеленной электронной пары принимать протоны, т.е. обладать свойствами основания, приводит к качественному изменению выполняемых функций. Аминосодержащие молекулы организм не способен использовать в качестве источников энергии, они служат для других целей.
Глава 1. Классификация и общность ролей
азотсодержащих соединений
Среди подобного рода веществ можно обнаружить ациклические и циклические (гомо–, гетеро–). В первых двух группах атомы N встречаются в виде аминогрупп. Если же азот входит в состав колец, то образуются гетероциклы (пиррол, пиридин, пиримидин) или конденсированные (индол, пурин) структуры. По наличию в их составе функциональных групп различают (табл.1.1):
I. амины – содержат аминогруппу;
II. соединения со смешанными функциями:
а) аминоспирты – кроме амино–, имеют гидроксильную группу;
б) аминокислоты – дополнительно включают карбоксильную группу.
Последняя подгруппа в организме используется самостоятельно (аминокислоты, ди-, три-, полипептиды) (см. Приложение, табл. 1, 2, схема 1) или служит для синтеза биологически важных веществ (глутатион, карнитин, креатин, сфингозин). Аминоспирты, являясь полярными, обычно хорошо растворимыми структурами, присоединяясь к гидрофобам, способны резко менять их свойства, делая амфифилами [будучи компонентами (холин, этаноламин, сфингозин) многих липидов – глицеро-, сфингофосфатидов.
Таблица 1.1.
Классификация азотсодержащих мономеров и их примеры
| Функциональ- ные группы | Ациклические | Циклические | ||
| Гомо- | Гетеро- (производные пиррола, имидазола, пиридина, пиримидина) | Конденсированные (производные пурина, индола) | ||
| Амины (аминогруппа) | Путресцин Кадаверин | Фенилэтил-амин | Гистамин | Аденин |
| Аминоспирты (амино-, гидроксигруппы) | Этаноламин Сфингозин | Тирамин Дофамин Норадреналин | Пиридоксамин Урацил Тимин | Серотонин Триптамин Гуанин |
| Аминокислоты (амино- и карбоксигруппы) | Аланин Глутамат Лизин | Фенилаланин | Гистидин | Триптофан |
В то же время наличие лишь аминогруппы не обеспечивает полного сходства функций среди подобного класса соединений. Представители этой группы могут быть продуктами распада более сложных соединений, обладать высокой биологической активностью (медиатор или гормон – гистамин, дофамин) или участвовать в основном процессе обеспечения продолжения рода – делении клеток и сохранении необходимой для этого информации (аденин). Мало того обе группы тесно связаны между собой: аминокислоты служат субстратами в синтезе пуринов и пиримидинов, а последние отвечают за аминокислотную последовательность в белках.
Отсюда их метаболизм рассматривают практически вместе. Среди гетероциклов, кроме описанных пуринов и пиримидинов, имеются производные пиррола (гем), в генезе которых особая роль принадлежит аминокислоте глицину, что также служит связующим звеном и позволяет присоединить гем к азотсодержащим структурам.
Общность азотсодержащих соединений подчеркивается следующим понятием: азотистый баланс, которое учитывает количество поступающих и, соответственно, выделяющихся из организма веществ, включающих атомы азота. Различают следующие виды: положительный азотистый баланс, когда величины пришедшего с пищей азота преобладает над потерянными. В норме этот вариант встречается у детей, особенно в период интенсивного роста, при половом созревании, у беременных, у выздоравливающих после тяжелой болезни. Обратная ситуация – отрицательный азотистый баланс, для которого характерно преобладание выделения азотсодержащих соединений над их поступлением, наблюдается в острую фазу многих недугов, при голодании, у раковых больных, в старческом возрасте, при лучевой терапии и т.д. Для здорового взрослого человека характерно азотистое равновесие. Считают, что для его поддержания требуется поступление белков с пищей из расчета 0,8 г протеинов на 1 кг массы тела в сутки.
Глава 2. Метаболизм аминокислот
Основная масса аминокислот поступает в организм человека в составе пищевых белков, которые в ЖКТ гидролизуются под действием эндо (пепсин, трипсин, химотрипсин, эластаза) и экзо (карбокси-, амино-, дипептидазы) протеаз (2.1). Высвободившиеся аминокислоты всасываются и разносятсяпо кровотоку в клетки, где используются в реакциях полимеризации, преобразуясь в ди-, три-, олиго-, полипептиды и по большей части белки, выполняющие пластическую, транспортную, каталитическую, рецепторную, регуляторную, зрительную, дыхательную, сократительную, иммунную и др. функции. Катаболизм аминокислот альтернативен. Распад части этих соединений носит специфический характер. Большинство же разрушаетс, лишаясь в начале или амино-, или карбоксильной группы. Получившиеся после декарбоксилирования амины (гистамин, тирамин, дофамин и др.) являются биологически активными соединениями. Дезаминирование проходит двумя способами: первый – переаминирование – фактический обмен функциональными группами между амино- и α-кетокислотой с получением новых амино- и α-кетокислот. Второй вариант представляет отщепление свободного NН3, который в растворе цитозоля проявляет свойства основания, обуславливая опасность развития алкалоза. В клетках присутствуют различные кислые вещества, способные фактически его нейтрализовать (буферные системы, α-кетокислоты). Образовавшиеся при этом соли аммония, глутамин доставляются в печень, где используются для синтеза мочевины (орнитиновый цикл):
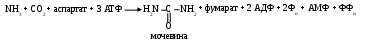
Окончательный продукт обезвреживания – мочевина – током крови доставляется в почки, откуда экскретируется в составе мочи.
Для большинства аминокислот анаболическая фаза заключается в их поступлении в организм (незаменимые), заменимые же способны синтезироваться из различных соединений, в первую очередь, из α-кетокислот, метаболитов гликолиза, ЦТК .
Кроме включения в белки аминокислоты могут подвергаться самым различным преобразованиям (2.4), повреждения в которых приводят к развитию патологий (приобретенных и наследственных) («Патохимия насл. заболеваний»).
2.1. Гидролитическая стадия катаболизма полипептидов
В зависимости от происхождения аминокислоты (см. Приложение, табл.1.) делят на экзогенные и эндогенные. Первые поступают в организм обычно с белковой пищей.