ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.12.2023
Просмотров: 125
Скачиваний: 3
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
В ротовой полости с помощью механической обработки обеспечивается выход содержимого из клеток пищевых продуктов в просвет ЖКТ. Химические преобразования протеинов начинаются с их денатурации, вызванной соляной кислотой желудка, что делает доступным пептидные связи молекул субстратов для действия ферментов (табл. 2.1.). Кроме того, это соединение вызывает резкое снижение кислотности (до рН= 1,5-2) в полости желудка у взрослого человека, что регулирует нормальную работу сфинктера, который обычно находится в сокращенном состоянии и открывается лишь при возникновении разницы рН по обе стороны. Следовательно, пища, поступившая в желудок, определенный промежуток времени остается в нем, создавая чувство насыщения.
Сильно кислая среда в полости этого органа разрушает мембраны клеток микробов, стерилизуя пищевой комок. Поэтому при сниженной секреции соляной кислоты начинает размножаться микрофлора, вызывая брожение (наличие молочной кислоты в желудочном содержимом позволяет подтвердить этот симптом). В подобных условиях сфинктер не открывается, пища залеживается, также способствуя брожению.
Основными структурными компонентами мембран клеток являются липиды и белки, то чтобы их сохранить, протеазы и липазы, вырабатываемые органами пищеварительной системы, синтезируются в виде зимогенов - своих неактивных форм. Их активация осуществляется уже в полости ЖКТ.
В просвете желудка медленно под влиянием НСl образуется из пепсиногена первая затравочная порция пепсина, который сам активирует (аутокатализ) путем частичного протеолиза последующие порции фермента (табл. 2.1).
Таблица 2.1.
Ферменты гидролиза белков в ЖКТ
| Происхождение | Представитель | Аминокислоты, образующие разрываемую пептидную связь |
| Главные клетки желудка Клетки поджелудочной железы Энтероциты тонкой кишки |  Пепсиноген пепсин Пепсиноген пепсин  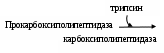 Т  рипсиноген Трипсин рипсиноген ТрипсинЭнтерокиназа Аминополипептидаза Дипептидаза | Ароматические аминокислоты Ароматические аминокислоты Нейтральные алифатические и аминокислоты С-концевая пептидные связи, ароматические а/к, аргинин, лизин Лейцин, лизин, аргинин N-концевые пептидные связи, лизин, аргинин |
Подобный процесс с протеазами поджелудочного сока проходит в двенадцатиперстной кишке: за созревание трипсина отвечает энтерокиназа, а активированный энзим стимулирует химотрипсиноген, проэластазу, прокарбоксипептидазу.
В зависимости от того, на каком участке полипептида ферменты рвут пептидные связи, их делят на эндо- и экзопептидазы. Любой белок — это неветвящаяся нить только с двумя концами. Отсюда, чтобы ускорить работу энзимов, отщепляющих аминокислоты, требуется увеличить число концов, от которых они могут отрываться. Поэтому гидролиз протеинов начинают эндопептидазы, которые разрушают связи, расположенные в середине цепей, что приводит к образованию более коротких пептидов и облегчают работу экзопептидаз.
Так как радикалы аминокислот, составляющих нить белка, различны по строению, то соответственно требуется присутствие энзимов, обладающих относительной специфичностью, которая определяется природой аминокислоты, участвовавшей в образовании пептидной связи. В таблице 2.1 приведены примеры, характеризующие подобные явления. Обращает на себя внимание, что и пепсин желудка, и химотрипсин поджелудочного сока гидролизуют амидные связи, возникшие при участии ароматических аминокислот; отсюда при снижении функции желудка способность к их разрыву сохраняется и не мешает дальнейшему перевариванию, которое обычно продолжают экзопептидазы, отщепляющие аминокислоты с концов цепей (карбоксипептидаза с С-конца, аминопептидаза с N-конца). Заканчивается процесс гидролизом пептидной связи в дипептиде, на которую действует одноименный энзим энтероцита тонкой кишки.
Освободившиеся аминокислоты путем облегченной диффузии всасываются в тонком кишечнике. Для предотвращения потерь этих соединений в мембранах энтероцитов существуют системы активного транспорта (транслоказа + АТФ), которые включаются при смещении градиента концентрации к нулю. Всосавшиеся аминокислоты попадают или в лимфатические сосуды, или по воротной вене в печень.
Тонкий кишечник не стерилен, поэтому часть продуктов гидролиза подвергается действию ферментов кишечной микрофлоры (гниению). Вещества, образующиеся при этом, могут быть газами (СО2, NН3, Н2S, CН4), что провоцирует метеоризм; нелетучими соединениями с неприятным запахом (скатол, индол из триптофана, путресцин и кадаверин из лизина), способными также всасываться, как и аминокислоты и попадать в печень, а через портокавальные анастомозы – в нижнюю полую вену и в общий кровоток. Если этих соединений образовалось немного, а гепатоциты функционально здоровы, то последние легко инактивируют поступившие продукты гниения.
У человека, особенно у новорожденного, в зависимости от проницаемости стенки кишечника могут всасываться небольшие пептиды, даже белки, обладающие антигенными свойствами, способные провоцировать иммунные реакции.
Что касается судьбы аминокислот в печени, то можно выделить три направления их использования: большая часть отправляется в общий кровоток, меньшая используется для собственных нужд. Если количество оказавшихся в гепатоцитах аминокислот избыточно, то логично их отложить в запас. Но накопление подобных низкомолекулярных структур в клетке грозит ростом осмотического давления, поэтому они начинают участвовать в полимеризации, т.е. в синтезе полипептидов. Образуются белки, в первую очередь, альбумины, различные фракции глобулинов, которые тоже не задерживаются в печени, а отправляются в кровоток, где выполняют многочисленные функции (транспортную, гомеостатические: нормализация рН, онкотического давления).
-
Судьба аминокислот в клетке
Пул аминокислот в цитоплазме клеток складывается в основном из преодолевших плазмолемму подобных соединений, получившихся при гидролизе экзогенных (пищевых) или эндогенных (тканевых); малая доля может образоваться из других соединений, чаще, из альфа-кетокислот. Клетка использует аминокислоты, в первую очередь, в качестве мономеров в реакциях полимеризации. Из этих азотсодержащих соединений синтезируются дипептиды (карнозин, ансерин — антиоксиданты мышечной ткани), трипептид (глутатион — один из универсальных антиоксидантов). Любой полипептид вследствие уникальности своей первичной структуры в процессе синтеза требует присутствия дополнительного участника — матрицы (иРНК). Олигопептиды, имеющие своеобразную аминокислотную последовательность, получаются путем частичного протеолиза более крупных биополимеров (схема).
Небольшая доля аминокислот может находить применение в специфических путях использования: в синтезе азотистых оснований (этаноламина, холина), пуриновых и пиримидиновых нуклеотидов; из триптофана, вступившего в кинурениновый путь распада, в конечном итоге образуются НАД+ и НАД+Ф; фенилаланин и тирозин в щитовидной железе преобразуются в тироидные гормоны, в меланоцитах из этих аминокислот

получаются защитные пигменты — меланины, а ферменты хромафинных клеток превращают их в катехоламины (дофамин, норадреналин, адреналин); глицин — обязательный участник в синтезе гема, пуриновых оснований, парных жёлчных кислот, креатина и т.д.
Обычно, как замечено выше азотсодержащие соединения не служат в клетках энергоисточниками. Однако при следующих условиях аминокислоты могут использоваться с энергетической целью: а) при переедании белков; б) во время дефицита липидов и углеводов в пище (при частичном или полном голодании); в) при заболеваниях, сопровождающихся нарушениями в использовании с этими целями основных энергоисточников (при сахарном диабете).
Варианты неспецифических преобразований аминокислот
Каждая аминокислота, естественно подвергается специфическому распаду. Но вследствие общности строения для этих соединений характерны неспецифические фазы катаболизма, начало которых имеет альтернативу: каждая аминокислота включает обязательно две функциональные группы, отсюда разрушение может начаться или с декарбоксилирования, или лишения аминогруппы. Небольшой процент циклических аминокислот преобразуется идентично ПВК.
Реакции декарбоксилирования
Схему этой реакции можно представить в следующем виде:
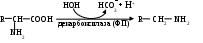
Продукты подобного преобразования — амины (см. Приложение, табл. 2), довольно разнообразны по функциям (табл. 2.1). Большая часть из них обладает высокой биологической активностью, являясь гормонами, нейромедиаторами. Присутствие в исходном субстрате дополнительной функциональной группы (-ОН, -СООН) придает соединению иные свойства. После декарбоксилирования гидроксиаминокислоты серина образуется этаноламин — компонент различных фосфолипидов; аспартат в этом случае дает β-аланин, который включается, например, в НSКоА, карнозин, ансерин.
Биологически активные амины действуют кратковременно и быстро разрушаются специфическими аминооксидазами (МАО, ДАО и т.д.):
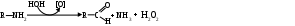
Отщепившийся от аминокислоты углекислый газ способен взаимодействовать с водой цитоплазмы с образованием угольной кислоты, которая под влиянием внутриклеточных буферных систем может превратиться в свои соли, также создав подобную бикарбонатную систему.
Таблица 2.1
Происхождение аминов и их функции
| Аминокислота | Ее амин | Роль |
| Глутаминовая кислота | Гамма-аминомасляная кислота (ГАМК) | Медиатор |
| Аспарагиновая кислота | бета-аланин | Компонент карнозина, ансерина — антиоксидантов или НSКоА |
| Фенилаланин | Фенилэтиламин | Нейромедиатор |
| Тирозин | Тирамин | Нейромедиатор |
| Диоксифенилаланин (ДОФА) | Дофамин | Нейромедиатор, гормон |
| Триптофан | Триптамин | Нейромедиатор, гормон |
| 5-окситриптофан | 5-окситриптамин (серотонин) | Гормон, медиатор |
| Гистидин | Гистамин | Медиатор боли, воспаления |
| Серин | Этаноламин | Компонент глицерофосфатидов - этаноламинфосфатидов |
| Цистеин | Цистеамин | Радиопротектор |
Возможен иной исход декарбоксилирования: углекислый газ связывается с биотином (коферментом декарбоксилазы), образуется карбоксибиотин. В таком виде это соединение служит источником карбоксильной группы, т. е. используется в процессах карбоксилирования (например, в получении из ПВК оксалоацетата; синтез ацилов ВЖК начинается с карбоксилирования ацетил-КоА в малонил-КоА и т.д.).
Варианты лишения аминокислоты аминогруппы
Описано несколько механизмов реакций дезаминирования азотсодержащих соединений (гидролитическое, окислительное, восстановительное, внутримолекулярное и т. д.) (см. Приложение, табл.3). Часть из них не характерна для аминокислот (гидролитическому подвергаются пуриновые и пиримидиновые основания), восстановительное и вышеописанный вариант дезаминирования регистрируются в полости кишечника, где протекают под действием ферментов гнилостной микрофлоры. В окислительном дезаминировании участвует НАД+, отсюда понятно, что редокс–потенциал окисляемого субстрата должен быть более электроотрицательным, т. е. подобной реакции подвергаются, в первую очередь, кислые аминокислоты (глутаминовая и аспарагиновая кислоты).
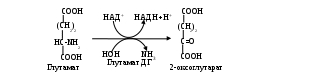
О
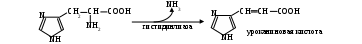 ригинально лишается аминогруппы гистидин:
ригинально лишается аминогруппы гистидин:Подобный способ дезаминирования называется внутримолекулярным. Большинство же аминокислот теряет аминогруппу при взаимодействии с α-кетокислотой. Происходит взаимный обмен функциональными группами: из аминокислоты получается α-кетокислота, а исходная α-кетокислота становится аминокислотой (см. Приложение, табл. 4). Ферменты, катализирующие реакцию, принадлежат к аминотрансферазам, а процесс называется переаминированием, или трансаминированием. В общем виде он выглядит так:
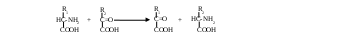
О
 собая роль в данной реакции принадлежит коферменту - активной форме витамина В6 (фосфопиридоксаль фосфопиридоксамин) (см. Приложение, табл. 4). Из всех аминофераз наибольшей активностью обладают АлАТ и АсАТ, колебания в скорости катализируемых ими реакций используются в целях диагностики, в основном, болезней миокарда и печени. Если патологический процесс повреждает мембрану гепатоцитов, и их содержимое попадает в общий кровоток, то в первую очередь, регистрируется рост активности АлАТ. Когда происходят сходные альтерации в клетках сердечной мышцы, в крови повышается активность АсАТ.
собая роль в данной реакции принадлежит коферменту - активной форме витамина В6 (фосфопиридоксаль фосфопиридоксамин) (см. Приложение, табл. 4). Из всех аминофераз наибольшей активностью обладают АлАТ и АсАТ, колебания в скорости катализируемых ими реакций используются в целях диагностики, в основном, болезней миокарда и печени. Если патологический процесс повреждает мембрану гепатоцитов, и их содержимое попадает в общий кровоток, то в первую очередь, регистрируется рост активности АлАТ. Когда происходят сходные альтерации в клетках сердечной мышцы, в крови повышается активность АсАТ.