ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.12.2023
Просмотров: 481
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Тема. Застосування електролізу
Мета уроку: ознайомити учнів з технічним застосуванням електролізу; навчити їх застосовувати закон електролізу Фарадея під час розв'язання задач.
Тип уроку: урок вивчення нового матеріалу.
План уроку
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Застосування електролізу для одержання чистих металів
Електролітичні процеси класифікуються в такий спосіб:
Актуальність електролізу пояснюється тим, що багато речовин одержують саме в такий спосіб. Наприклад, такі метали, як нікель, натрій, чистий водень та інші, одержують тільки цим методом.
У промисловості алюміній і мідь у більшості випадків одержують саме шляхом електролізу. Перевага цього способу у відносній дешевизні й простоті.
2. Знайомимося з гальваностегією
Гальванотехніка — галузь прикладної електрохімії, що займається процесами нанесення металевих покриттів на поверхню як металевих
, так і неметалевих виробів при проходженні постійного електричного струму через розчини їхніх солей.
Гальванотехніка ділиться на гальваностегію та гальванопластику.
За допомогою електролізу можна покрити металеві предмети шаром іншого металу. Цей процес називається гальваностегією.
Особливе технічне значення мають покриття важкоокисни-ми металами, зокрема нікелювання й хромування, а також сріблення й золочення, що часто застосовуються для захисту металів від корозії. Для одержання потрібних покриттів предмет ретельно очищають, добре знежирюють і поміщають як катод в електролітичну ванну, що містить сіль того металу, яким бажають покрити предмет. Для більш рівномірного покриття корисно застосовувати як анод дві пластини, поміщаючи предмет між ними.
На рисунку показані алмазні диски, виготовлені методом гальваностегії.



Фігурки з олова, покриті міддю:

3 Вивчаємо гальванопластику
За допомогою електролізу можна не тільки покрити предмети шаром того чи іншого металу, але й виготовити їхні рельєфні металеві копії (наприклад, монет, медалей). Цей процес був винайдений російським фізиком й електротехніком, членом Російської Академії наук Борисом Семеновичем Якобі (1801 —1874) у 40-х роках XIX століття, і називається він гальванопластикою. Для виготовлення рельєфної копії предмета спочатку роблять зліпок з якого-небудь пластичного матеріалу, наприклад, з воску. Цей зліпок натирають графітом і занурюють в електролітичну ванну як катод, де на ньому й осаджується шар металу. Такий метод застосовується в поліграфії під час виготовлення друкованих форм.
На рисунку показано кілька рельєфних копій, отриманих за допомогою гальванопластики.

Питання до учнів у ході викладу нового матеріалу
? Які особливості проходження електричного струму в рідинах можна використовувати для одержання чистих металів?

Електромагнітні явища. Електричний струм
? Як можна захистити метали від корозії?
? Наведіть приклади металів, які можна одержувати електролітичним способом.
? У який спосіб можна покривати різні вироби шаром дорогоцінного металу?
ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
1. Якісні питання
2. Навчаємося розв'язувати задачі
Розв'язок. Масу шару нікелю, отриманого за час t, одержимо із закону електролізу: m= kIt. З іншого боку, цю саму масу можна виразити через площу пластинки і товщину шару нікелю: m =pSh.
Прирівнявши обидва вирази для маси, одержуємо: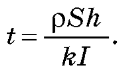 Перевіривши одиниці величин і підставивши числові значення, одержуємо t = 5900 є = 1 год 40 хв.
Перевіривши одиниці величин і підставивши числові значення, одержуємо t = 5900 є = 1 год 40 хв.

КирикЛ. А. · «Усі уроки фізики. 9 клас»
Розв'язок. Відповідно до закону збереження енергії витрати електроенергії дорівнюють роботі електричного струму при електролізі: A = UIt. Скористаємося також законом електролізу:
m = kit. Розділивши перший вираз на другий, одержуємо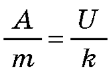 ,
,
звідки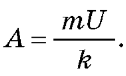 Оскільки A = 5Pt, де P — потужність кожної
Оскільки A = 5Pt, де P — потужність кожної
з ламп, одержуємо час світіння ламп:
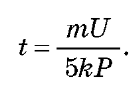
Перевіривши одиниці величин і підставивши числові значення, одержуємо: t = 2,4 106 є, тобто близько 670 годин. Таким чином, лампи могли б світити день і ніч майже 28 діб.
Що ми дізналися на уроці
Домашнє завдання
рів1 — № 11.7; 11.8; 11.9; 11.25. рів2 — № 11.26; 11.27; 11.28; 11.41.
рів3 — № 11.42, 11.43; 11.44.
Урок 27/33
Тема. Лабораторна робота № 9 «Дослідження явища електролізу» Мета уроку: експериментально перевірити виконання закону електролізу.
Тип уроку: урок контролю й оцінювання знань.
Обладнання: електролітична ванна з водним розчином мідного купоросу (CuSO4) і мідними електродами, джерело струму, секундомір, амперметр, ваги з важком, фільтрувальний папір, ключ, з'єднувальні проводи.
РЕКОМЕНДАЦІЇ ЩОДО ПРОВЕДЕННЯ ЛАБОРАТОРНОЇ РОБОТИ

Домашнє завдання
Урок 28/34
Тема. Електричний струм у газах
Мета уроку: роз'яснити учням фізичну природу електропровідності газів.
Тип уроку: урок вивчення нового матеріалу.
План уроку
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Іонізація газів
Гази, на відміну від металів та електролітів, складаються з електрично нейтральних атомів і молекул і за нормальних умов не містять вільних носіїв струму (електронів і йонів). За звичайних умов гази є діелектриками.
Однак в окремих випадках можна помітно підвищити електропровідність газу. Достатньо, наприклад, піднести полум'я сірника до зарядженого електроскопа, як він відразу ж розряджається. З цього досліду доводить висновок, що під дією полум'я повітря втрачає свої ізоляційні властивості, тобто в ньому з'являються вільні заряди. Повітря, як і інші гази, можна зробити електропровідним, діючи на нього ультрафіолетовим, рентгенівським і радіоактивним випромінюванням.
Для відривання електрона від атома необхідна визначена енергія, що називається енергією йонізації.
^ Іонізація газів — відривання від їхніх атомів чи молекул електронів.
Протилежним процесу йонізації газів є процес рекомбінації — возз'єднання протилежно заряджених частинок у нейтральні молекули.
Іонізатор щомиті створює в просторі між електродами певне число йонів і електронів. Стільки ж іонів і електронів, з'єднуючись між собою, утворюють нейтральні атоми. Така динамічна рівновага існує доти, поки між електродами немає електричного поля. Як тільки між електродами буде створене поле, відразу ж на частинки, що несуть заряди різного знака, почнуть діяти сили, спрямовані в протилежні боки. Тому, нарівні з безладним рухом, заряджені частинки будуть переміщатися в напрямку дії на них електричного поля. Це спрямований рух частинок під дією електричного поля й являє собою струм у газі.
^ Процес протікання електричного струму через газ називають газовим розрядом.
2. Несамостійний і самостійний розряди
Іонізація газу може відбуватися під впливом різних зовнішніх впливів (сильне нагрівання газу, рентгенівське чи радіоактивне випромінювання, космічне випромінювання, бомбардування електронами або йонами, що швидко рухаються), що називаються зовнішніми йонізаторами.
Існує 2 види газового розряду: несамостійний і самостійний.
Якщо електропровідність газу виникає під дією іонізаторів, а з видаленням останнього зникає, то має місце несамостійний розряд.
^ Газовий розряд, який можна спостерігати тільки за наявності зовнішнього іонізатора, називають несамостійним газовим розрядом.
За певних умов струм у газах може проходити і без зовнішнього іонізатора.
Мета уроку: ознайомити учнів з технічним застосуванням електролізу; навчити їх застосовувати закон електролізу Фарадея під час розв'язання задач.
Тип уроку: урок вивчення нового матеріалу.
План уроку
| Контроль знань | 5 хв | 1. Рухом яких заряджених частинок створюєть- ся струм у рідинах? 2. У чому полягає відмінність провідності елек- тролітів від провідності металів? 3. Сформулюйте закон електролізу. 4. Який фізичний зміст має електрохімічний еквівалент? |
| Демонстрації | 5 хв | Фрагменти відеофільму «Електроліз і його промислове застосування». |
| Вивчення нового матеріалу | 25 хв | 1. Застосування електролізу для одержання чистих металів. 2. Знайомимося з гальваностегією. 3. Вивчаємо гальванопластику |
| Закріплення вивченого матеріалу | 10 хв | 1. Контрольні питання. 2. Навчаємося розв'язувати задачі |
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Застосування електролізу для одержання чистих металів
Електролітичні процеси класифікуються в такий спосіб:
-
одержання неорганічних речовин (водню, кисню, хлору, лугів тощо); -
одержання металів (літій, натрій, калій, берилій, магній, цинк, алюміній, мідь тощо); -
очищення металів (мідь, срібло тощо); -
одержання металевих сплавів; -
одержання гальванічних покриттів; -
одержання органічних речовин; -
нанесення плівок за допомогою електрофорезу.
Актуальність електролізу пояснюється тим, що багато речовин одержують саме в такий спосіб. Наприклад, такі метали, як нікель, натрій, чистий водень та інші, одержують тільки цим методом.
У промисловості алюміній і мідь у більшості випадків одержують саме шляхом електролізу. Перевага цього способу у відносній дешевизні й простоті.
2. Знайомимося з гальваностегією
Гальванотехніка — галузь прикладної електрохімії, що займається процесами нанесення металевих покриттів на поверхню як металевих
, так і неметалевих виробів при проходженні постійного електричного струму через розчини їхніх солей.
Гальванотехніка ділиться на гальваностегію та гальванопластику.
За допомогою електролізу можна покрити металеві предмети шаром іншого металу. Цей процес називається гальваностегією.
Особливе технічне значення мають покриття важкоокисни-ми металами, зокрема нікелювання й хромування, а також сріблення й золочення, що часто застосовуються для захисту металів від корозії. Для одержання потрібних покриттів предмет ретельно очищають, добре знежирюють і поміщають як катод в електролітичну ванну, що містить сіль того металу, яким бажають покрити предмет. Для більш рівномірного покриття корисно застосовувати як анод дві пластини, поміщаючи предмет між ними.
На рисунку показані алмазні диски, виготовлені методом гальваностегії.



Фігурки з олова, покриті міддю:

3 Вивчаємо гальванопластику
За допомогою електролізу можна не тільки покрити предмети шаром того чи іншого металу, але й виготовити їхні рельєфні металеві копії (наприклад, монет, медалей). Цей процес був винайдений російським фізиком й електротехніком, членом Російської Академії наук Борисом Семеновичем Якобі (1801 —1874) у 40-х роках XIX століття, і називається він гальванопластикою. Для виготовлення рельєфної копії предмета спочатку роблять зліпок з якого-небудь пластичного матеріалу, наприклад, з воску. Цей зліпок натирають графітом і занурюють в електролітичну ванну як катод, де на ньому й осаджується шар металу. Такий метод застосовується в поліграфії під час виготовлення друкованих форм.
На рисунку показано кілька рельєфних копій, отриманих за допомогою гальванопластики.

Питання до учнів у ході викладу нового матеріалу
? Які особливості проходження електричного струму в рідинах можна використовувати для одержання чистих металів?

Електромагнітні явища. Електричний струм
? Як можна захистити метали від корозії?
? Наведіть приклади металів, які можна одержувати електролітичним способом.
? У який спосіб можна покривати різні вироби шаром дорогоцінного металу?
ЗАКРІПЛЕННЯ ВИВЧЕНОГО МАТЕРІАЛУ
1. Якісні питання
-
Чи можуть під час дисоціації утворитися йони якого-небудь одного знака? Чому? -
Чому не можна доторкатися до неізольованих електричних проводів голими руками? -
Для чого під час нікелювання як анод ставлять нікелеву пластинку? Чи буде відкладатися нікель з розчину нікелевої солі, якщо нікель на аноді замінити яким-небудь іншим металом? -
Чому для гальванічного покриття виробу найчастіше вживають нікель і хром?
2. Навчаємося розв'язувати задачі
-
За допомогою електролізу зробили нікелювання пластинки площею 200 см2. Електроліз робили за сили струму 2 А. Товщина шару нікелю 0,02 мм. Протягом якого часу відбувався електроліз? Електрохімічний еквівалент нікелю 3 · 10-7 кг/Кл, його густина 8900 кг/м3.
Розв'язок. Масу шару нікелю, отриманого за час t, одержимо із закону електролізу: m= kIt. З іншого боку, цю саму масу можна виразити через площу пластинки і товщину шару нікелю: m =pSh.
Прирівнявши обидва вирази для маси, одержуємо:
-
За допомогою електролізу, що відбувався за напруги 5 В, одержали 4 кг алюмінію. Який час світили б 5 енергозберігаючих ламп потужністю по 18 Вт за рахунок цієї енергії? Електрохімічний еквівалент алюмінію дорівнює 0,93 · 10-7 кг/Кл.

КирикЛ. А. · «Усі уроки фізики. 9 клас»
Розв'язок. Відповідно до закону збереження енергії витрати електроенергії дорівнюють роботі електричного струму при електролізі: A = UIt. Скористаємося також законом електролізу:
m = kit. Розділивши перший вираз на другий, одержуємо
звідки
з ламп, одержуємо час світіння ламп:
Перевіривши одиниці величин і підставивши числові значення, одержуємо: t = 2,4 106 є, тобто близько 670 годин. Таким чином, лампи могли б світити день і ніч майже 28 діб.
-
За сили струму 5 А за 10 хв в електролітичній ванні виділився цинк масою 1,017 г. Визначте електрохімічний еквівалент цинку. -
Під час електролізу розчину мідного купоросу за 1 год виділилася мідь масою 500 г. Визначте силу струму в колі. Електрохімічний еквівалент міді дорівнює 3,29 · 10-7 кг/Кл.
Що ми дізналися на уроці
-
Гальванотехніка — галузь прикладної електрохімії, що займається процесами нанесення металевих покриттів на поверхню як металевих, так і неметалевих виробів при проходженні постійного електричного струму через розчини їхніх солей. -
Гальваностегією називається процес покриття металевих предметів шаром іншого металу за допомогою електролізу. -
Гальванопластикою називають процес виготовлення рельєфних металевих копій за допомогою електролізу.
Домашнє завдання
-
Підр.: § 20. -
Зб.:
рів1 — № 11.7; 11.8; 11.9; 11.25. рів2 — № 11.26; 11.27; 11.28; 11.41.
рів3 — № 11.42, 11.43; 11.44.
Урок 27/33
Тема. Лабораторна робота № 9 «Дослідження явища електролізу» Мета уроку: експериментально перевірити виконання закону електролізу.
Тип уроку: урок контролю й оцінювання знань.
Обладнання: електролітична ванна з водним розчином мідного купоросу (CuSO4) і мідними електродами, джерело струму, секундомір, амперметр, ваги з важком, фільтрувальний папір, ключ, з'єднувальні проводи.
РЕКОМЕНДАЦІЇ ЩОДО ПРОВЕДЕННЯ ЛАБОРАТОРНОЇ РОБОТИ
-
За допомогою ваг визначте масу катода m1. -
Зберіть електричне коло, використовуючи прилади, показані на рисунку.

-
Опустіть електроди у ванну з розчином, замкніть ключ й одночасно ввімкніть секундомір, установивши силу струму в колі 2 А. Через 15 хв розімкніть коло. Катод акуратно промокніть фільтрувальним папером. -
Визначте масу катода m2після електролізу.
-
 Обчисліть масу міді m, яка виділилася на електроді.
Обчисліть масу міді m, яка виділилася на електроді. -
Визначте заряд q, що пройшов за час електролізу через електроліт. -
Знову опустіть електрод у ванну з розчином, замкніть ключ й одночасно ввімкніть секундомір. -
Повторіть вимірювання маси катода ще 4 рази через кожні 5 хвилин, обчислюючи щоразу масу міді, що виділилася на електроді, і заряд, що пройшов за цей час через електроліт.
-
Знайдіть на графіку середню точку, запишіть значення m та q . Обчисліть значення електрохімічного еквівалента міді. -
Запишіть у зошиті для лабораторних робіт висновок: що ви вимірювали і який отримали результат.
Домашнє завдання
-
Підр.: §§ 19, 20. -
Зб.: № 11.45, 11.46; 11.47.
Урок 28/34
Тема. Електричний струм у газах
Мета уроку: роз'яснити учням фізичну природу електропровідності газів.
Тип уроку: урок вивчення нового матеріалу.
План уроку
| Контроль знань | 5 хв | 1. Яка природа носіїв заряду в електролітах? 2. Що таке електролітична дисоціація? 3. Що таке електроліз? Сформулюйте закон електролізу. 4. Які вам відомі застосування електролізу? |
| Демонстрації | 7 хв | 1. Іонізація газів. 2. Несамостійний заряд. 3. Самостійний розряд у газах. |
| Вивчення нового матеріалу | 25 хв | 1. Іонізація газів. 2. Несамостійний і самостійний розряди. 3. Іонізація електронним ударом |
| Закріплення вивченого матеріалу | 8 хв | 1. Контрольні питання. 2. Навчаємося розв'язувати задачі |
ВИВЧЕННЯ НОВОГО МАТЕРІАЛУ
1. Іонізація газів
Гази, на відміну від металів та електролітів, складаються з електрично нейтральних атомів і молекул і за нормальних умов не містять вільних носіїв струму (електронів і йонів). За звичайних умов гази є діелектриками.
Однак в окремих випадках можна помітно підвищити електропровідність газу. Достатньо, наприклад, піднести полум'я сірника до зарядженого електроскопа, як він відразу ж розряджається. З цього досліду доводить висновок, що під дією полум'я повітря втрачає свої ізоляційні властивості, тобто в ньому з'являються вільні заряди. Повітря, як і інші гази, можна зробити електропровідним, діючи на нього ультрафіолетовим, рентгенівським і радіоактивним випромінюванням.
Для відривання електрона від атома необхідна визначена енергія, що називається енергією йонізації.
^ Іонізація газів — відривання від їхніх атомів чи молекул електронів.
Протилежним процесу йонізації газів є процес рекомбінації — возз'єднання протилежно заряджених частинок у нейтральні молекули.
Іонізатор щомиті створює в просторі між електродами певне число йонів і електронів. Стільки ж іонів і електронів, з'єднуючись між собою, утворюють нейтральні атоми. Така динамічна рівновага існує доти, поки між електродами немає електричного поля. Як тільки між електродами буде створене поле, відразу ж на частинки, що несуть заряди різного знака, почнуть діяти сили, спрямовані в протилежні боки. Тому, нарівні з безладним рухом, заряджені частинки будуть переміщатися в напрямку дії на них електричного поля. Це спрямований рух частинок під дією електричного поля й являє собою струм у газі.
^ Процес протікання електричного струму через газ називають газовим розрядом.
2. Несамостійний і самостійний розряди
Іонізація газу може відбуватися під впливом різних зовнішніх впливів (сильне нагрівання газу, рентгенівське чи радіоактивне випромінювання, космічне випромінювання, бомбардування електронами або йонами, що швидко рухаються), що називаються зовнішніми йонізаторами.
Існує 2 види газового розряду: несамостійний і самостійний.
Якщо електропровідність газу виникає під дією іонізаторів, а з видаленням останнього зникає, то має місце несамостійний розряд.
^ Газовий розряд, який можна спостерігати тільки за наявності зовнішнього іонізатора, називають несамостійним газовим розрядом.
За певних умов струм у газах може проходити і без зовнішнього іонізатора.