Файл: Отчет по лабораторной работе 3 По дисциплине Термодинамика и кинетика.docx
Добавлен: 11.12.2023
Просмотров: 104
Скачиваний: 7
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО НАУКИ И высшего ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра физической химии
Отчет по лабораторной работе №3
По дисциплине: Термодинамика и кинетика
(наименование учебной дисциплины согласно учебному плану)
Тема: Определение константы диссоциации слабого электролита кондуктометрическим методом
Автор: студент гр. ГНГ-21-2 ______________ Анненкова М.А.
(подпись) (Ф.И.О.)
Автор: студент гр. ГНГ-21-2 ______________ Дмитровская Д.П.
(подпись) (Ф.И.О.)
ОЦЕНКА: _____________
Дата: _________ 2023 г.
ПРОВЕРИЛ _______ _____________ /______________/
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2023 год
Цель работы: определить степень и константу диссоциации слабой кислоты путем измерения электропроводности раствора.
Сущность работы: электропроводность раствора электролита зависит от концентрации ионов в растворе и их подвижности. В растворах слабых электролитов концентрация ионов зависит от степени диссоциации. Получив зависимость электропроводности от концентрации электролита, вычисляют его степень диссоциации и константу диссоциации слабого электролита.
Оборудование и реактивы:
Кондуктометр; магнитная мешалка; химический стакан объемом 100 мл – 5 шт.; химический стакан объемом 50 мл – 1 шт.; химический стакан объемом 250 мл – 1 шт.; мерные колбы объемом 250 мл – 4 шт.; мерная пипетка объемом 50 мл – 1 шт.; мерная пипетка объемом 10 мл – 1 шт.; бюретка для титрования объемом 25 мл – 1 шт.; гидроксид натрия – раствор (концентрация указана на емкости с реактивом); слабая кислота – СН3СООН или НСООН – раствор (примерное значение концентрации указано на емкости с реактивом).
Ход работы:
I. Получение зависимости удельной электропроводности от содержания слабого электролита в растворе
1) Мерной пипеткой объемом 50 мл отбираем исходный раствор уксусной кислоты, помещаем его в мерную колбу № 1 на 250 мл, доводим до метки дистиллированной водой и перемешиваем;
2) Из колбы № 1 в колбу № 2 переносим при помощи мерной пипетки 50 мл раствора, доводим объем в колбе № 2 дистиллированной водой до метки и перемешиваем;
3) Повторяем с колбами № 3 и № 4;
4) Пробы приготовленных и исходного растворов отбираем в маркированные химические стаканы объемом 100 мл;
5) Измеряем удельную электропроводность приготовленных растворов слабой кислоты путем погружения электрода кондуктометра в стакан с раствором и заносим результаты в таблицу.
II. Анализ концентрации раствора слабой кислоты методом кондуктометрического титрования.
1) Отбираем аликвоту уксусной кислоты 10 мл в химический стакан объемом 250 мл;
2) В бюретку заливаем раствор гидроксида натрия и «зануляем» бюретку.
3) Ставим пробу на магнитную мешалку, помещаем в раствор якорь магнитной мешалки и погружаем в стакан электрод кондуктометра;
4) Доливаем в стакан для титрования дистиллированную воду до закрытия щели электрода раствором, включаем магнитную мешалку и фиксируем показания кондуктометра.
5) Приливаем гидроксид натрия из бюретки порциями по 1 мл, фиксируя после каждой порции щелочи значение электропроводности раствора.
6) Титрование продолжаем до получения изменения хода зависимости удельной электропроводности от объема щелочи, данные заносим в таблицу.
Экспериментальные данные:
Таблица 1. Исходные данные
| Наименование слабого электролита | муравьиная кислота |
| Химическая формула слабого электролита | HCOOH |
| Ориентировочное значение концентрации слабого электролита С0, 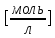 | 1 |
| Концентрация титранта (гидроксид натрия) СNaOH, 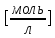 | 1 |
| Объем пробы слабого электролита, взятый для титрования Vа, [мл] | 10 |
Таблица 2. Зависимость удельной электропроводности от концентрации слабого электролита
| № колбы | Концентрация, 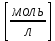 (по ориентировочному значению) | Удельная электропроводность ꭓ, 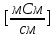 |
| 1 | С0 =0,5 | 6,099 |
| 2 | С1 = С0/5 =0,1 | 2,697 |
| 3 | С2 = С0/25 =0,02 | 1,166 |
| 4 | С3 = С0/125=0,004 | 0,4881 |
| 5 | С4 = С0/625 =0,0008 | 0,2048 |
Таблица 3. Данные для построения кривой кондуктометрического титрования
| № п/п | VNaOH, мл | Удельная электропроводность ꭓ, 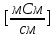 |
| 1 | 0 | 1,302 |
| 2 | 1 | 1,328 |
| 3 | 2 | 1,539 |
| 4 | 3 | 1,954 |
| 5 | 4 | 2,364 |
| 6 | 5 | 2,830 |
| 7 | 6 | 3,271 |
| 8 | 7 | 3,747 |
| 9 | 8 | 4,185 |
| 10 | 9 | 4,680 |
| 11 | 10 | 5,101 |
| 12 | 11 | 5,500 |
| 13 | 12 | 5,931 |
| 14 | 13 | 6,537 |
| 15 | 14 | 7,621 |
| 16 | 15 | 8,602 |
| 17 | 16 | 9,669 |
| 18 | 17 | 10,690 |
| 19 | 18 | 11,680 |
| 20 | 19 | 12,720 |
| 21 | 20 | 13,690 |
Обработка экспериментальных данных:
I. Определение точного значения концентрации слабого электролита

Vэ=12,6 мл
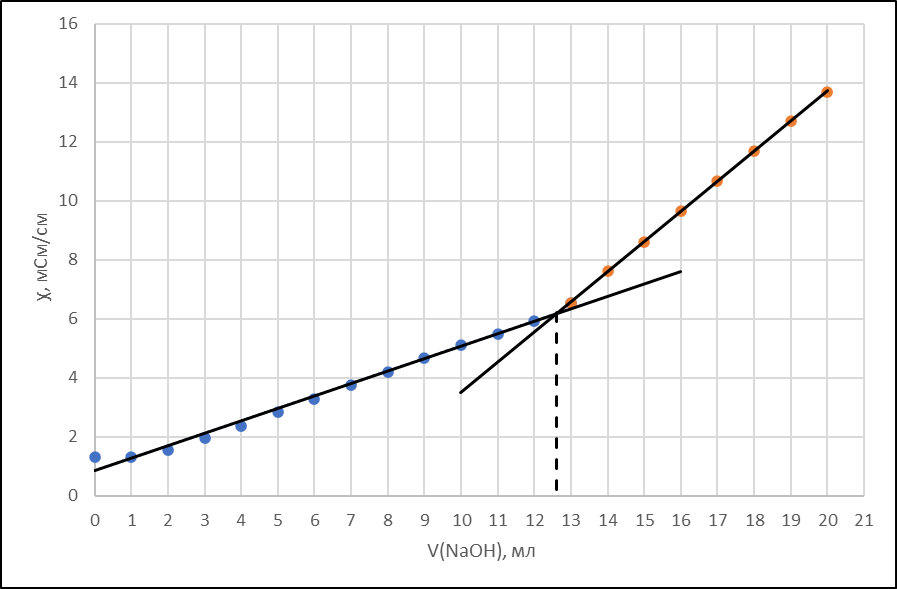
Рисунок 1 - Кривая кондуктометрического титрования
Исходя из графика кривой, делаем вывод, что эквивалентный объем
Vэ = 12,6 мл.
Точное значение концентрации слабого электролита вычислим по формуле:
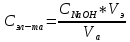 ,
,где: VЭ – эквивалентный объем щелочи, определенный по кривой титрования, [мл]; СNaOH – концентрация раствора щелочи,
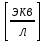 ; Va – объем аликвоты слабого электролита, [мл].
; Va – объем аликвоты слабого электролита, [мл].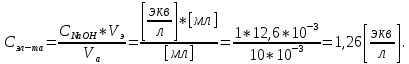
II. Определение константы и степени диссоциации слабого электролита.
1. Вычислим эквивалентную электропроводность каждого раствора по формуле:
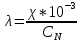
Приведу подробное вычисление для 1 первого раствора:
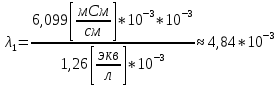
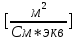 ;
;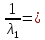 =
=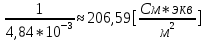 .
.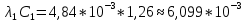
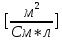 .
.2. Заполним таблицу, используя данные эксперимента
Таблица 4. Результаты вычислений
| Электролит | С, 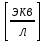 | ,  | λ, 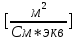 * *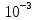 | 1/λ 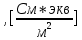 | λС 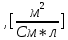 * 10-3 |
| HCOOH | 1,26 | 6,099 | 4,84 | 206,59 | 6,099 |
| 0,252 | 2,697 | 10,70 | 93,44 | 2,697 | |
| 0,0504 | 1,166 | 23,13 | 43,23 | 1,166 | |
| 0,01008 | 0,4881 | 48,42 | 20,65 | 0,488 | |
| 0,002016 | 0,2048 | 101,59 | 9,84 | 0,205 |
3. По данным таблицы построить графики зависимостей ꭓ= f(C)
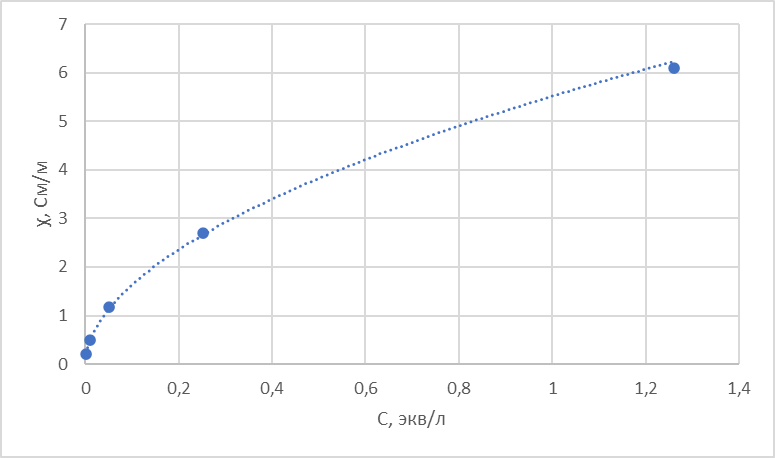
Рисунок 2 – График зависимости электропроводности от концентрации
4. По данным таблицы построить графики зависимостей 1/λ = f(λС)
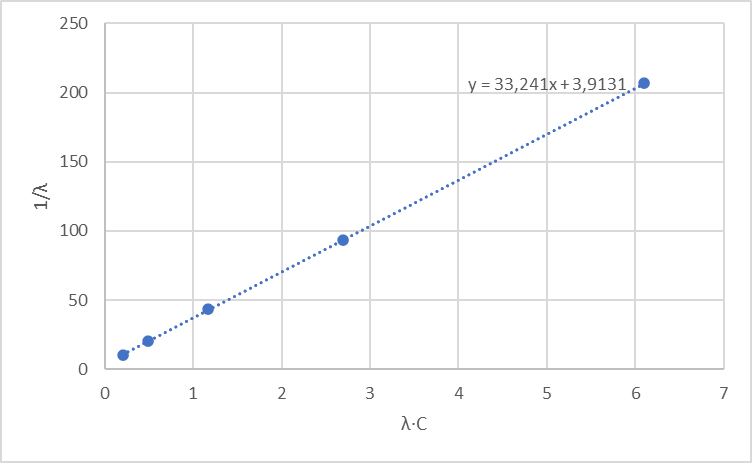
Рисунок 3 – График 1/λ = f(λС)
5. По графику 1/λ = f(λС) найдём 1/λ∞ посредством экстраполяции зависимости на ось ординат 1/λ и вычислим λ∞
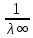 = 3,913
= 3,913 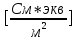 . Отсюда λ∞
. Отсюда λ∞ 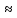 0,256
0,256  .
.6. Рассчитаем значение степени диссоциации по уравнению:
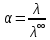 .
.Значение константы диссоциации по формуле
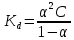
Пример вычисления для первой колбы:
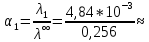 0,019
0,019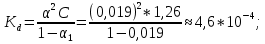
7. Результаты вычислений занесём в таблицу:
| Электролит | С,  | α | Kd*10-4 | Kd среднее, *10-4 |  Kd = (Kd среднее -Kd) Kd = (Kd среднее -Kd) |
| HCOOH | 1,26 | 0,019 | 4,6 | 4,68 | 0,08 |
| 0,252 | 0,042 | 4,6 | 0,08 | ||
| 0,0504 | 0,090 | 4,5 | 0,18 | ||
| 0,01008 | 0,189 | 4,4 | 0,28 | ||
| 0,002016 | 0,397 | 5,3 | 0,62 |