ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 10.01.2024
Просмотров: 188
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Тема V. Дисперсные системы. Растворы.
Задание 5.1. В определенном объеме раствора V л содержится m г вещества. Плотность раствора ρ (табл. V.1). Рассчитайте:
Процентную концентрацию ( %, масс.).
Молярность.
Нормальность.
Моляльность раствора.
Пример решения 5.1
Ι.3. Способы выражения концентрации вещества в растворе.
Молярная концентрация – это количество растворённого вещества в 1 л раствора.
 СМ раствора =
СМ раствора = 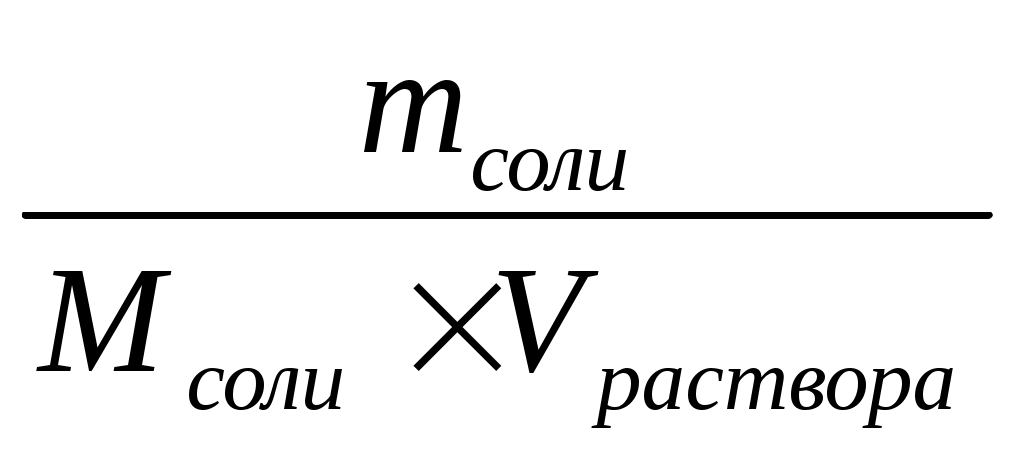
[СМ раствора] = [моль/л].
Молярная концентрация эквивалента (нормальность) – число моль – эквивалентов растворённого вещества в 1 л растворе.
Сн раствора =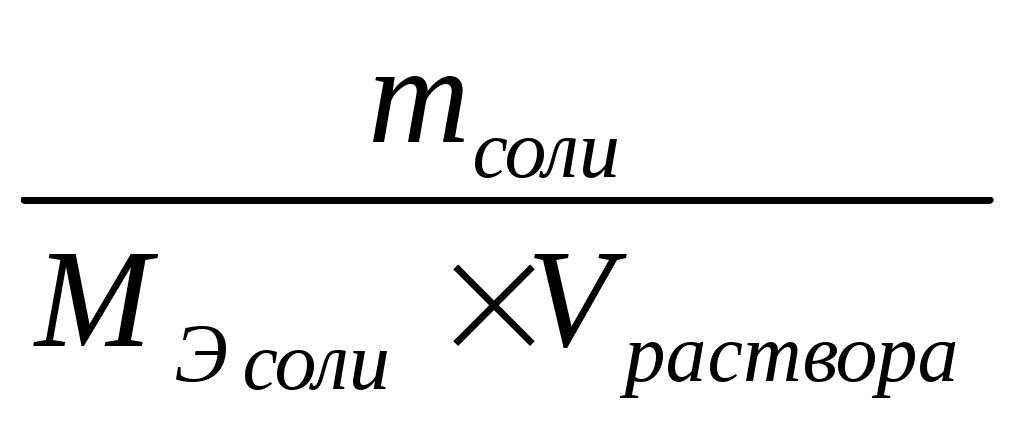
[Сн раствора] = [моль/л];
Mэ соли – молярная масса эквивалента соли (Ktn z +Anm), где n – число катионов в соли, (z+) – заряд катиона.
Mэ соли =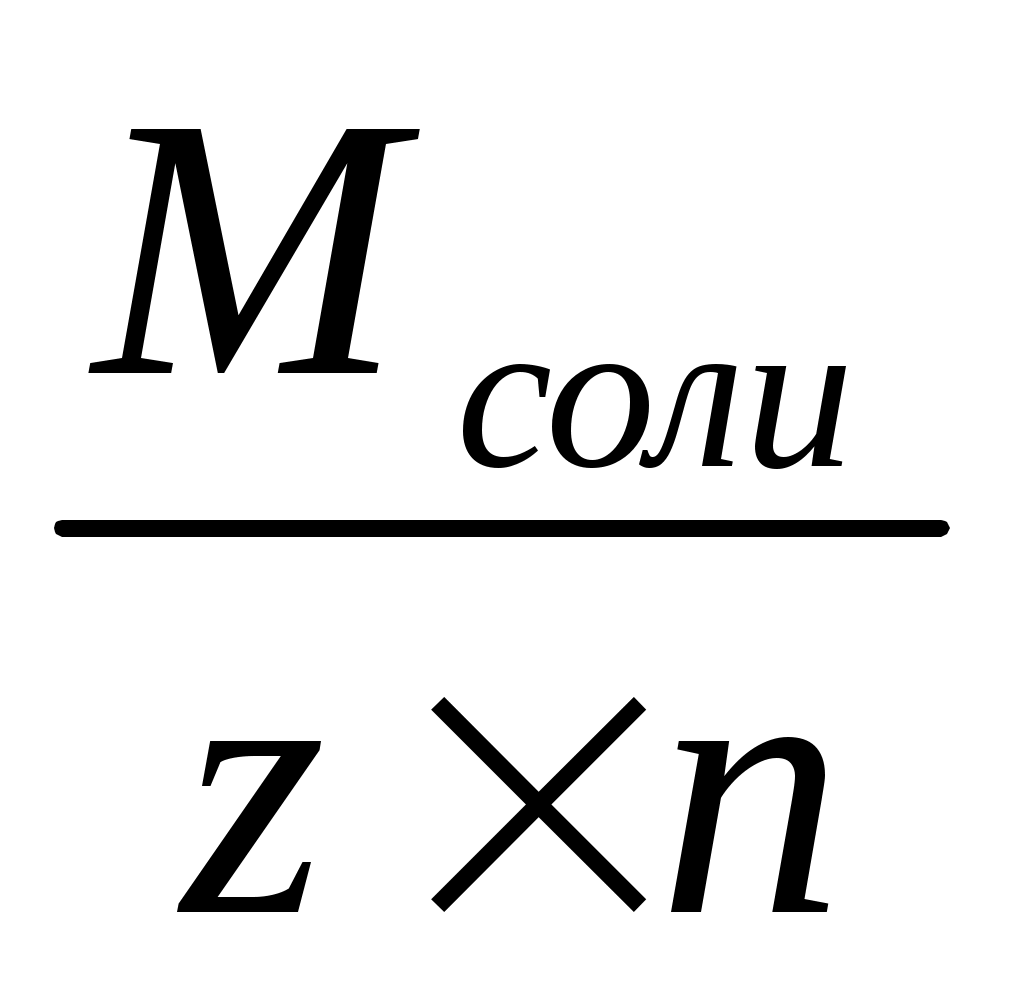
Моляльная концентрация – число моль растворённого вещества в 1 кг растворителя.
Сm раствора =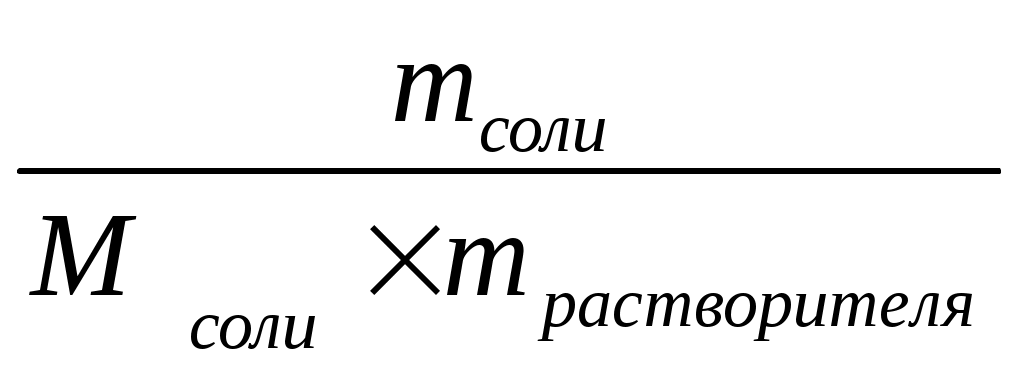
[Сm раствора] = [моль/кг];
m растворителя = (m раствора - m соли ) = (V раствора * ρ раствора - m соли)
Титр раствора – отношение массы растворённого вещества (г) к объёму (мл) раствора.
Т = m соли / V раствора;
[Т]=[г/мл].
Задание 5.2. Рассчитайте рН раствора кислоты или щелочи, если известна ее молярная концентрация сМ (моль/л) (табл. V.2).
Ионное произведение воды. Водородный показатель.
Вода – очень слабый амфотерный электролит. Процесс электролитической диссоциации воды можно выразить уравнениями:

Применим к равенству (1) закон действия масс. Получим:
 ,
,
где С – концентрации воды и ионов соответственно, Кдисс – константа диссоциации воды.
Т.к. константа диссоциации для воды является величиной постоянной, то произведение тоже постоянная величина, которая называется ионным произведением воды:
тоже постоянная величина, которая называется ионным произведением воды:
Kw =[H+].[OH-]=10-14 (При температуре 250С)
 .
.
Для простоты расчетов принято обозначать характер среды раствора десятичным логарифмом от концентрации ионов водорода [H+], взятым с обратным знаком. Этот обратный логарифм lg[H+] называется водородным показателем и обозначается рН:
pH=- lg[H+].
Соответственно:

Следовательно, водородный показатель рН принимает значения от 1 до 14: в кислой среде рН < 7; в щелочной среде рН > 7; в нейтральной среде pH=7.
Пример решения 5.2.
Вычислите рН раствора и [H+], [ОН-] раствора КОН, содержащего 0,056 г КОН в 100 мл раствора (α=1).
Решение:
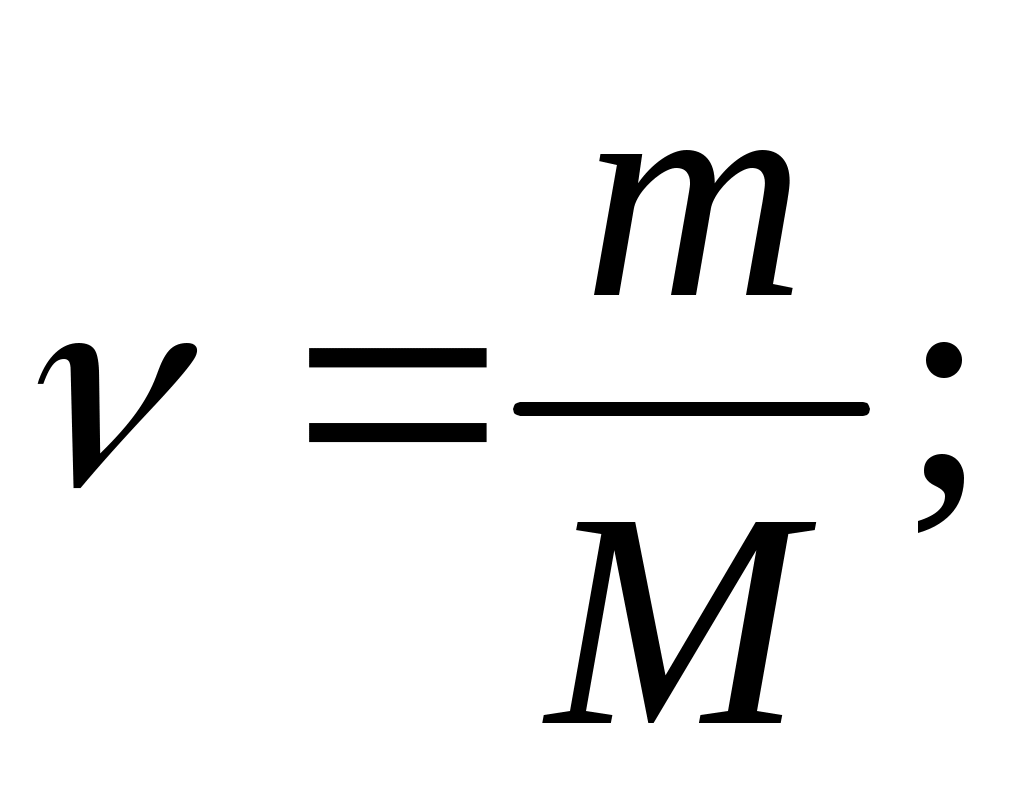
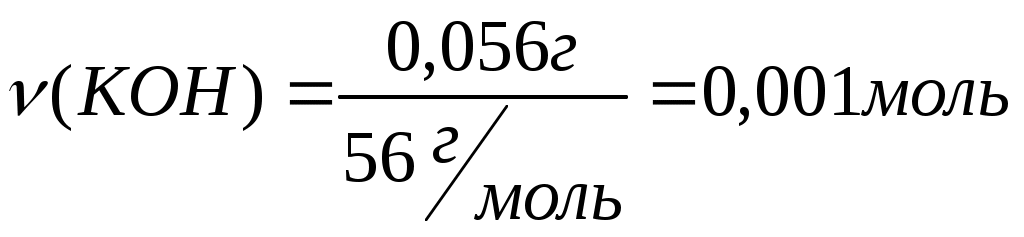
KOH→K++OH-
количество, ν 0,01 0,01 0,01 моль
Определяем концентрацию KOH и ионов OH-
В 100 мл раствора содержится– 0,001 моль КОН
В 1000 мл – х.
Х=0,01 моль
Из формулы (2) следует, что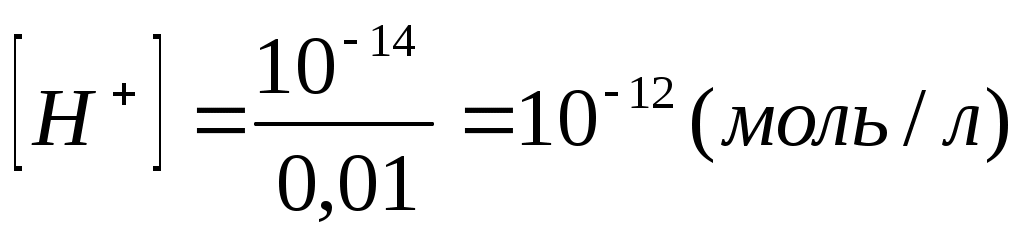
Из формулы (1) pH=-lg10-12=12.
Задание 5.3. Составить молекулярное и ионно-молекулярное уравнения реакций гидролиза 4-х солей и оценить рН раствора (табл. V.3):
Гидролиз солей
Электролиты – это вещества, которые распадаются в воде, в других полярных жидкостях или расплавах на частицы (ионы), способные проводить электрический ток.
Распад вещества на ионы под действием молекул растворителя называется электролитической диссоциацией. Вещества, молекулы которых хорошо распадаются на ионы, называются сильными электролитами. К ним относятся кислоты: HCl, H2SO4, HNO3, НI; основания: NaOH, KOH, LiOH, CsOH, Са(OH)2, Ва(OH)2; все соли: CuSO4, Li2CO3, K2S, FrCl, CsNO3, MnCO3, MnS, AgBr, PbCO3, FeF2, CuS, BaCO3 и др.
Слабые электролиты – это вещества, молекулы которых не полностью распадаются на ионы, т.е. в растворе могут присутствовать как ионы, так и не распавшиеся молекулы. К ним относится вода Н2О, кислоты: H2S, HF, H2CO3, H3PO4, H2SO3,CH3COOH, HCN, H2SiO3, HSCN, H2CrO4; основания: NH4OH и практически все гидроксиды p- и d-металлов, например: Cu(OH)2, Al(OH)3, Fe(OH)2, Fe(OH)3, Pb(OH)2, Cr(OH)3 и др.
Гидролизом соли называется взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и изменению рН раствора.
Вода диссоциирует на ионы Н+ и ОН-, находящиеся в равновесии с огромным числом недиссоциированных молекул, которые могут служить источником ионов, если это равновесие будет нарушено. Это нарушение может произойти в результате связывания одного из ионов воды с гидролизующимся веществом и привести к накоплению в растворе другого иона, вследствие чего раствор приобретает кислую или щелочную реакцию.
Типы солей
Гидролизу подвергаются только те соли, в состав которых входят или ионы слабой кислоты, или ионы слабого основания, т.е. 2-й, 3-й и 4-й типы солей.
Алгоритм написания уравнений гидролиза.
На примере гидролиза соли CuCl2.
Записать уравнение гидролиза по I ступени:
Запись:
I.CuCl2+HOH→
Слаб.Сильн.
осн-е к-та
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та
Cu2++ 2Cl-+H+OH-→
Слаб.
осн-е
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та

Cu2++ 2Cl-+H+OH-→
Слаб..
осн-е
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та

Cu2++ 2Cl-+H+OH-→ CuOH+ + 2Cl-+H+,
Слаб..
осн-е
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та

Cu2++ 2Cl-+H+OH-→ CuOH+ + 2Cl-+H+, pH < 7, среда кислая;
Слаб.
осн-е
Получили уравнение гидролиза в полном ионном виде.
Запись:
I. CuCl2+HOH→
осн-е к-та

Задание 5.1. В определенном объеме раствора V л содержится m г вещества. Плотность раствора ρ (табл. V.1). Рассчитайте:
Процентную концентрацию ( %, масс.).
Молярность.
Нормальность.
Моляльность раствора.
Пример решения 5.1
Ι.3. Способы выражения концентрации вещества в растворе.
Молярная концентрация – это количество растворённого вещества в 1 л раствора.
[СМ раствора] = [моль/л].
Молярная концентрация эквивалента (нормальность) – число моль – эквивалентов растворённого вещества в 1 л растворе.
Сн раствора =
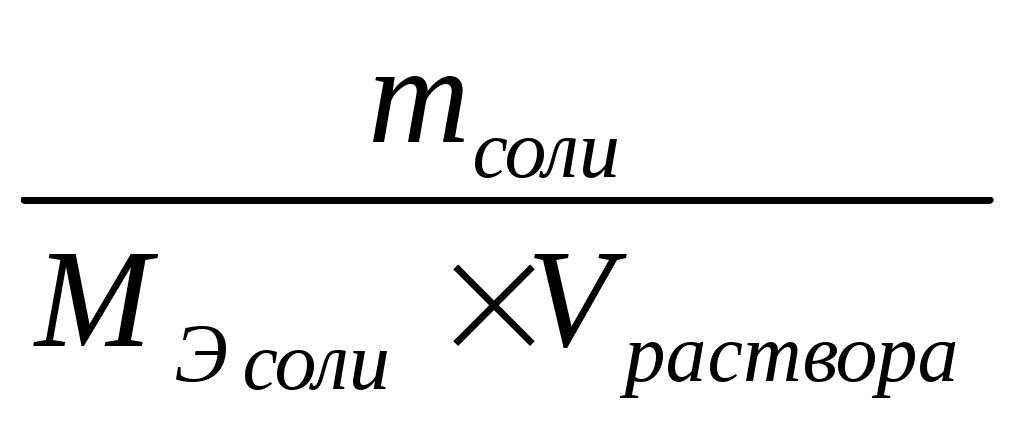
[Сн раствора] = [моль/л];
Mэ соли – молярная масса эквивалента соли (Ktn z +Anm), где n – число катионов в соли, (z+) – заряд катиона.
Mэ соли =
Моляльная концентрация – число моль растворённого вещества в 1 кг растворителя.
Сm раствора =
[Сm раствора] = [моль/кг];
m растворителя = (m раствора - m соли ) = (V раствора * ρ раствора - m соли)
Титр раствора – отношение массы растворённого вещества (г) к объёму (мл) раствора.
Т = m соли / V раствора;
[Т]=[г/мл].
Задание 5.2. Рассчитайте рН раствора кислоты или щелочи, если известна ее молярная концентрация сМ (моль/л) (табл. V.2).
Ионное произведение воды. Водородный показатель.
Вода – очень слабый амфотерный электролит. Процесс электролитической диссоциации воды можно выразить уравнениями:

Применим к равенству (1) закон действия масс. Получим:
 ,
, где С – концентрации воды и ионов соответственно, Кдисс – константа диссоциации воды.
Т.к. константа диссоциации для воды является величиной постоянной, то произведение
Kw =[H+].[OH-]=10-14 (При температуре 250С)
Для простоты расчетов принято обозначать характер среды раствора десятичным логарифмом от концентрации ионов водорода [H+], взятым с обратным знаком. Этот обратный логарифм lg[H+] называется водородным показателем и обозначается рН:
pH=- lg[H+].
Соответственно:
Следовательно, водородный показатель рН принимает значения от 1 до 14: в кислой среде рН < 7; в щелочной среде рН > 7; в нейтральной среде pH=7.
Пример решения 5.2.
Вычислите рН раствора и [H+], [ОН-] раствора КОН, содержащего 0,056 г КОН в 100 мл раствора (α=1).
Решение:
-
рН=-lg[H+], -
[OH-][H+]=10-14
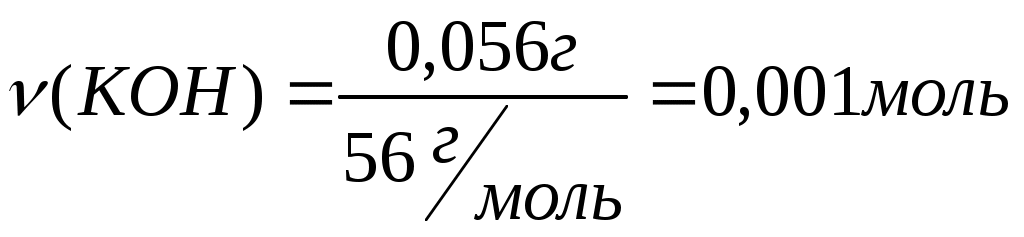
KOH→K++OH-
количество, ν 0,01 0,01 0,01 моль
Определяем концентрацию KOH и ионов OH-
В 100 мл раствора содержится– 0,001 моль КОН
В 1000 мл – х.
Х=0,01 моль
-
[OH-]=0,01 моль/л,
Из формулы (2) следует, что
Из формулы (1) pH=-lg10-12=12.
Задание 5.3. Составить молекулярное и ионно-молекулярное уравнения реакций гидролиза 4-х солей и оценить рН раствора (табл. V.3):
Гидролиз солей
Электролиты – это вещества, которые распадаются в воде, в других полярных жидкостях или расплавах на частицы (ионы), способные проводить электрический ток.
Распад вещества на ионы под действием молекул растворителя называется электролитической диссоциацией. Вещества, молекулы которых хорошо распадаются на ионы, называются сильными электролитами. К ним относятся кислоты: HCl, H2SO4, HNO3, НI; основания: NaOH, KOH, LiOH, CsOH, Са(OH)2, Ва(OH)2; все соли: CuSO4, Li2CO3, K2S, FrCl, CsNO3, MnCO3, MnS, AgBr, PbCO3, FeF2, CuS, BaCO3 и др.
Слабые электролиты – это вещества, молекулы которых не полностью распадаются на ионы, т.е. в растворе могут присутствовать как ионы, так и не распавшиеся молекулы. К ним относится вода Н2О, кислоты: H2S, HF, H2CO3, H3PO4, H2SO3,CH3COOH, HCN, H2SiO3, HSCN, H2CrO4; основания: NH4OH и практически все гидроксиды p- и d-металлов, например: Cu(OH)2, Al(OH)3, Fe(OH)2, Fe(OH)3, Pb(OH)2, Cr(OH)3 и др.
Гидролизом соли называется взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита и изменению рН раствора.
Вода диссоциирует на ионы Н+ и ОН-, находящиеся в равновесии с огромным числом недиссоциированных молекул, которые могут служить источником ионов, если это равновесие будет нарушено. Это нарушение может произойти в результате связывания одного из ионов воды с гидролизующимся веществом и привести к накоплению в растворе другого иона, вследствие чего раствор приобретает кислую или щелочную реакцию.
Типы солей
| основание | Кислота | |
| сильная | слабая | |
| сильное | 1-йтипсолей NaCl Ca(NO3)2 | 2-йтипсолей Na2CO3 KCN |
| слабое | 3-йтипсолей NH4Cl Al2(SO4)3 | 4-йтипсолей Al2S3 ZnCO3 |
| | | |
Гидролизу подвергаются только те соли, в состав которых входят или ионы слабой кислоты, или ионы слабого основания, т.е. 2-й, 3-й и 4-й типы солей.
| 1-йтипсолей | 2-йтипсолей | 3-йтипсолей | 4-йтипсолей | ||||
| Na | Cl | Na2 | CO3 | NH4 | Cl | Al2 | S3 |
| Сильное основание | Сильная кислота | Сильное основание | Слабая кислота | Слабое основание | Сильная кислота | Слабое основание | Слабая кислота |
| OH- | H+ | OH- | | | H+ | | |
| pH=7 | рН > 7, среда щелочная | | | рН < 7, среда кислая | pH≈7 | ||
| Гидролиз не идёт | Гидролиз идёт (по аниону) | Гидролиз идёт (по катиону) | Гидролиз идёт (и по катиону, и по аниону) | ||||
Алгоритм написания уравнений гидролиза.
На примере гидролиза соли CuCl2.
-
Определить к какому типу относится соль (каким основанием и какой кислотой образована). Сделать предположение о возможности протекания гидролиза данной соли.
| 3-йтипсолей | |
| Сu | Cl2 |
| Слабое основание | Сильная кислота |
| | H+ |
| | рН < 7, среда кислая |
| Гидролиз идёт (по катиону) | |
Записать уравнение гидролиза по I ступени:
Запись:
I.CuCl2+HOH→
Слаб.Сильн.
осн-е к-та
-
Записать соль в ионном (диссоциированном) виде. Поставить заряды ионов в молекуле воды.
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та
Cu2++ 2Cl-+H+OH-→
Слаб.
осн-е
-
Обозначить замкнутой линией взаимодействие ионов слабого электролита с противоположным по знаку ионом воды.
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та

Cu2++ 2Cl-+H+OH-→
Слаб..
осн-е
-
Записать прочное соединение (слабый электролит) образованное в результате взаимодействия ионов слабого электролита с противоположным по знаку ионом воды. Определить суммарный заряд полученного прочного соединения. Дописать оставшиеся частицы.
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та

Cu2++ 2Cl-+H+OH-→ CuOH+ + 2Cl-+H+,
Слаб..
осн-е
-
Определить pH среды. (Если в результате взаимодействия ионов слабого электролита с ионом воды образовались H+, то pH < 7, среда кислая; если в результате взаимодействия - образовались OH- , то рН > 7, щелочная среда).
Запись:
I. CuCl2+HOH→
Слаб.Сильн.
осн-е к-та

Cu2++ 2Cl-+H+OH-→ CuOH+ + 2Cl-+H+, pH < 7, среда кислая;
Слаб.
осн-е
Получили уравнение гидролиза в полном ионном виде.
-
Записать уравнение в сокращённом ионном виде: в обеих частях уравнения вычеркнуть подобные частицы.
Запись:
I. CuCl2+HOH→
осн-е к-та