Файл: Учебное пособие по химии для учащихся 10 классов, обучающихся в лицеях фдп рниму под редакцией проф. Теплова В. В.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.01.2024
Просмотров: 1182
Скачиваний: 9
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Государственное бюджетное образовательное учреждение высшего профессионального образования
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
имени Н.И. Пирогова
Министерства здравоохранения и социального развития Российской Федерации
УЧЕБНОЕ ПОСОБИЕ ПО ХИМИИ
для учащихся 10 классов, обучающихся в лицеях
ФДП РНИМУ
Москва 2011г
Государственное бюджетное образовательное учреждение высшего профессионального образования
РОССИЙСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ
МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
имени Н.И. Пирогова
Министерства здравоохранения и социального развития Российской Федерации
УЧЕБНОЕ ПОСОБИЕ ПО ХИМИИ
для учащихся 10 классов, обучающихся в лицеях
ФДП РНИМУ
под редакцией проф. Теплова В.В.
Москва 2011г
Авторы
Виноградова И.К. Васильева Л.М. Докторова Н.А.
Захарова В.Д. Игнатова Н.В. Корнеева Н.Н.
Овчаренко С.В. Семенова Н.С. Теплов В.В.
Утверждено Советом факультета довузовской подготовки РНИМУ
Глава 1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИИ
Атом – наименьшая частица химического элемента, являющаяся носителем его химических свойств. Атом – электронейтральная частица,состоящая из положительно заряженного ядра и отрицательно заряженныхэлектронов. Каждому элементу соответствует определённый вид атомов.
Молекула – наименьшая частица данного вещества, обладающая его основными химическими свойствами, способная к самостоятельному существованию и состоящая из одинаковых или различных атомов, соединённых в одно целое химическими связями.
Моль – единица измерения количества вещества. 1 моль содержит столько структурных элементов
, сколько атомов содержится в 12г изотопа углерода 12С (NA=6,02 1023 моль-1 – постоянная Авогадро). Структурными элементами могут быть атомы, молекулы, ионы, электроны и другие частицы.
Молярная масса (М г/моль) – масса 1 моль вещества.
М = m / n , где m -масса вещества (г),
а n - количество вещества ( моль ); n = m / М (моль).
Молярный объём газа( Vm ) – объём одного моль газа ( л/моль ).
Vm = V/n
Нормальные условия (н.у.)
давление Р=1,013 ∙ 105 Па; температура Т=273 К.
Уравнение Менделеева-Клапейрона: Р∙V = n ∙R ∙Т
где Р- давление( Па); V –объем(м 3) ; n -количество вещества(моль);
R= 8,314 Дж/моль∙К; Т -температура в К.
Абсолютная плотность газа – отношение массы газа к его объему:
ρ = m/V (г/л).
Относительная плотность газа 2 по газу 1 равна отношению молярных масс этих газов.
Например, относительная плотность азота по водороду:
Dводород = M(N2) / M(H2) = 28 / 2 = 14.
Объемная ( φ ) и молярная (χ ) доля газа в смеси φ = χ.
φ = V(газа) / V(газ. смеси) = χ = n(газа)/ n(газ. смеси)
Средняя молярная масса газовой смеси:
Мср. = χ1 ∙ М1 + χ 2 ∙ М2 + …. + χ i ∙ Мi
(1…..i – компоненты газовой смеси).
или Мср. = φ1∙ М1 + φ2∙ М2 + … φi ∙ М I .
Массовая доля – отношение массы вещества к массе смеси или раствора
ω= m(в-ва) / m(смеси).
1.1.Примеры решения задач
Пример 1. Масса 1л газа при н.у. равна 1,25г. Определить молярную массу газа и число его молекул в этом объеме.
Решение:
Для определения молярной массы газа нужно знать его массу и количество вещества: М=m/n; n = V(газа)/Vm
1) Количество вещества газа n = V(газа)/Vm= 1 / 22,4 = 0,0446 (моль).
2) Молярная масса газа М=m/n = 1,25 / 0,0446 = 28 (г/моль).
3) Найдем число молекул газа в 1л:
N(молекул)= n ∙ NA = 0,0446 ∙ 6,02 ∙ 1023 = 9,99 ∙ 1023 (молекул).
Ответ:_V__=_448_л_,_m__=_40_г._Пример_3'>Ответ:_М(газа)=28г/моль;_в_1л_(при_н.у.)_содержится_9,99_∙_10'>Ответ: М(газа)=28г/моль;
в 1л (при н.у.) содержится 9,99 ∙ 1023 молекул.
Пример 2. Определить объем, который при н.у. занимает 12,04 ∙ 1024 молекул водорода. Какова масса этого газа?
Решение:
Для определения объема газа нужно знать его количество вещества:
1) n(газа)= N(частиц)/ NA = 12,04 ∙ 10 24 / 6,02 ∙ 1023 = 20 (моль).
2) V(газа) = Vm ∙ n = 22,4 ∙ 20 = 448 (л).
3) Найдем массу водорода: m = n ∙ М = 20 ∙ 2 = 40 (г).
Ответ: V = 448 л , m = 40 г.
Пример 3. Какой объем занимает молекулярный кислород массой
1,6 г при температуре 300 С и давлении 3,2 ∙ 102 кПа?
Решение:
Из уравнения Менделеева-Клапейрона находим:
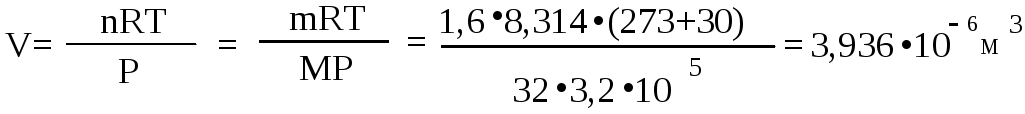
Ответ: V = 0,0003936 м3 = 0,3936л .
Пример 4. Плотность газа при н.у. равна 1,25 г/л. Определить его молярную массу и относительную плотность по водороду и воздуху.
Решение:
1) Найдем молярную массу газа:
М (газа ) = n ∙ Vm = 1,25 ∙ 22,4 = 28 (г/моль ).
2) Относительная плотность газа по водороду:
Dводород = М (газа ) / М (Н2 ) = 28 / 2 = 14.
3) Относительная плотность газа по воздуху:
Dвоздух = М (газа ) / 29 = 28 / 29 = 0,9655.
Ответ: М (газа)=28 г/моль; D(газа)водород = 14; D(газа)воздух =0,9655.
Пример 5. Определить состав газовой смеси ( в % % по объему), содержащей метан и этан, если ее относительная плотность по водороду равна 9,4.
Решение:
1) Найдем среднюю молярную массу газовой смеси :
Мср. (газ.смеси) =Dводород ∙ М (Н2) = 9,4 ∙ 2 = 18,8 (г/моль).
2) Пусть n(СН4) = х моль, тогда соответственно n(С2Н6) = (1-х) моль.:
Мср. (газ.смеси) = φ (СН4) ∙ М(СН4) + φ (С2Н6) ∙ М (С2Н6) или
Мср.(газ. смеси) = x∙М(СН4) + (1-х)∙М(С2Н6).
18,8 = х ∙16 + (1-х) ∙ 30 ;
18,8 = 16х + 30 - 30х = 30-14х ; 18,8 = 30 - 14 х ; 14х=11,2 ;
3) Отсюда: х = 0,8 = φ(СН4); а φ(С2Н6) = 1 – х = 0,2.
Ответ: М (газ.смеси) = 18,8 г/моль; φ (СН4) = 0,8 , φ (С2Н6) = 0,2.
Пример 6. Вычислить среднюю молярную массу и относительную плотность по воздуху газовой смеси, состоящей из 20% водорода , 50% метана и 30 % пропана (по объему).
Решение:
1) Найдем среднюю молярную массу газовой смеси:
Мср. (газ.смеси) = φ(Н2) ∙ М(Н2) + φ(СН4) ∙ М(СН4) + φ(С3Н8) ∙ М(С3Н8) = 0,2 ∙ 2 + 0,5 ∙ 16 + 0,3 ∙ 44 = 0,4 + 8 + 13,2 = 21,6 (г/моль).
2) Относительная плотность этой газовой смеси по воздуху:
Dвозд. = М (газ.смеси) / 29 = 21,6 / 29 = 0,7448.
Ответ: М (газ.смеси) = 21,6 г/моль;
D (газ.смеси)возд. = 0,7448.
Пример 7. Определить относительную плотность газа по гелию, если при температуре 27 0С и давлении 106,66 кПа газ массой 0,91 г занимает объем 760 мл.
Решение:
1) Используя уравнение Менделеева-Клапейрона, можно определить молярную массу газа М (г/моль):
2) Найдем относительную плотность газа по гелию:
DHe = М(газа ) / М (He) = 28 / 4 = 7.
Ответ: DHe = 7.
Пример 8. Определить формулу вещества, в котором массовые доли углерода и водорода составляют 85,71% и 14,29% соответственно.
Относительная плотность паров этого вещества по азоту равна 1,5 .
Решение:
Данное вещество состоит только из углерода и водорода, так как сумма массовых долей углерода и водорода (85,71 +14,29) равна 100%, поэтому обозначим его формулу СхНу.
1) Пусть масса образца равна 100 г, тогда масса и количества вещества углерода и водорода в нем будут равны:
m(С) = m(в-ва) ∙ω(С) = 100 ∙ 0,8571 = 85,71 (г);
n(С) = m(С) / М(С) = 85,71 / 12 = 7,1425 (моль);
m(Н) = m(в-ва) ∙ ω(Н) = 100 ∙ 0,1429 = 14,29 (г);
n (Н) = m(Н) / М(Н) = 14,29 / 1 = 14,29(моль).
2) Найдем соотношение х : у в соединении:
x : у = n(С) : n(Н) = 7,1425 : 14,29 = 1 : 2 .
Таким образом, простейшая формула вещества – СН2. М(СН2) = 14 г/моль.
3) Молекулярная формула может содержать в k раз большее число атомов, чем простейшая (СН2)k. Для нахождения истинной формулы вещества найдем его молярную массу:
М(СхНу) =Dазот ∙ М(N2) = 1,5 ∙ 28 = 42 (г/моль).
Коэффициент кратности, k равен : М(СхНу):М(СН2) = 42:14 = 3,
Следовательно, истинная формула вещества С3Н6.
Ответ: С3Н6
Пример 9. При сгорании 2,3 г органического вещества образовалось 2,24л (н.у.) оксида углерода (IV) и 2,7 г воды. Определить молекулярную формулу сожженного вещества, если абсолютная плотность его паров равна 2,0536 г/л.
Решение:
1) В продуктах сгорания вещества содержатся углекислый газ и вода, поэтому оно имеет в своем составе углерод, водород и, возможно, кислород. Обозначим его формулу СхНуОz и запишем уравнение реакции горения: C
xHyOz + (x + 0,25y – 0,5z) O2 → xCO2 + 0,5 y H2O
Найдём:
2) Количество вещества и массу углерода в СO2:
n(СО2) = V(СО2) / Vm = 2,24 : 22,4 = 0,1 (моль); n(С) = n(СО2) = 0,1 моль;
m(С) = 0,1 ∙ 12 = 1,2 г.
3) Количество вещества и массу водорода в Н2О:
n(Н2О) = m(Н2О) / М(Н2О) = 2,7 / 18 = 0,15 (моль);
n(Н) = 2 ∙ n(Н2О) = 2 ∙ 0,15 = 0,3 (моль); m(Н) = 0,3 ∙ 1 = 0,3 (г).
4) Массу и количество вещества кислорода в органическом веществе:
m(О) = m(в-ва) – m(С) – m(Н) = 2,3 – 1,2 – 0,3 = 0,8 (г);
n(О) = m(О) / М(О) = 0,8/16 = 0,05 (моль).
5) Соотношение х:у:z в органическом веществе:
x:у:z = n(С) : n(Н) : n(О) = О,1 : 0,3 : 0,05 = 2 : 6 : 1.
Таким образом, простейшая формула органического вещества -С2Н6О.
М(С2Н6О) = 46г/моль
Исходя из абсолютной плотности его паров, находим молярную массу :
М(СхНуОz) = ρ.Vm = 2,0536 . 22,4 = 46 (г/моль).
Следовательно, истинная формула совпадает с простейшей: С2Н6О.
Ответ: С2Н6О.
Пример 10. Определить массу углекислого газа, который может
образоваться при горении 10л (н.у.) оксида углерода (II) в 10л (н.у.)
кислорода. Найти состав полученной газовой смеси (в %% по объему).
Решение:
Запишем уравнение реакции горения оксида углерода (П):
2СО + О2 = 2СО2
1) Определим, какое из реагирующих веществ находится в избытке.
Согласно уравнению реакции 2 моль СО реагируют с 1моль О2, при этом образуется 2моль СО2 или в соответствии с законом объемных отношений для газов 2 объема СО реагируют с 1 объемом О2 и при этом образуются 2 объема СО2.
Следовательно, для горения 10л СО требуется вдвое меньший объем кислорода, т.е. из взятых 10 л прореагирует только 5л кислорода. Таким образом, кислород взят в избытке, а оксид углерода (II) – в недостатке.
Расчет всегда ведется по тому веществу, которое взято в недостатке, в нашем случае расчет ведем по СО. Количества прореагировавшего СО и образовавшегося СО2 равны между собой, так как стехиометрические коэффициенты в уравнении реакции для этих веществ одинаковы, поэтому:
n(CO2) = n(CO) или в соответствие с законом объемных отношений:
V(CО2) = V(CO) = 10 л
2) Результаты расчетов часто отображают в уравнении реакции:
количества исходных веществ записывают над формулами соответствующих веществ, количества прореагировавших веществ пишут под их формулами. Вещество, оставшееся в избытке после реакции записывают в правой части уравнения химической реакции в скобках и под ним указывают оставшееся количество: