Файл: Методические рекомендации по выполнению контрольной работы по дисциплине Химия.docx
Добавлен: 12.01.2024
Просмотров: 287
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
.
При уменьшении объема в 3 раза концентрации всех веществ увеличатся в 3 раза. После увеличения концентрации скорость прямой реакции стала
Vпр = 1(3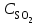 )2(3
)2(3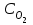 ) = 1 9
) = 1 9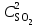 3
3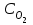 = 271
= 271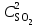
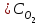 , т. е. возросла в 27 раз; а скорость обратной Vобр = 2 (3
, т. е. возросла в 27 раз; а скорость обратной Vобр = 2 (3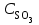 )2 = 2 9
)2 = 2 9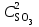 = 92
= 92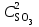 , т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).
, т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).
Пример 4.7. Как изменятся скорости прямой и обратной реакции, если в системе 2NO(г)+О2(г) 2NO2(г) уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Если да, то в какую сторону?
2NO2(г) уменьшить давление в 2 раза? Произойдет ли при этом смещение равновесия? Если да, то в какую сторону?
Решение. До уменьшения давления выражения для скорости прямой и обратной реакции имели вид: vпр = 1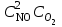 vобр = 2
vобр = 2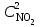
При уменьшении давления в 2 раза концентрации всех реагирующих веществ уменьшаются в 2 раза, так как общий объем системы увеличивается в 2 раза.
Тогда
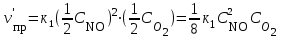
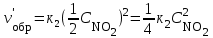 .
.
В результате уменьшения давления скорость прямой реакции уменьшилась в 8 раз, а скорость обратной в 4 раза. Таким образом, скорость обратной реакции будет в 2 раза больше, чем прямой и смещение равновесия произойдет в сторону обратной реакции, т. е. в сторону разложения NO2.
Пример 4.8. Объемный состав реакционной газовой смеси в момент равновесия для реакции 2А
2В + D был следующий: 89% А; 7% В; 4% D. Найдите КР и КС для этой реакции, если общее давление в системе при температуре 900 К равно 105 Па.
Решение. Для реакции, протекающих между газами, при вычислении константы равновесия удобно пользоваться парциальными давлениями реагирующих веществ. Парциальным давлением газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. Общее давление смеси газов равно сумме парциальных давлений газов.
Для данной реакции парциальные давления составляют РА=0,89105 Па, РВ=0,07105 Па, РD=0,04105 Па. Подставляем эти значения в выражение константы равновесия:
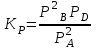
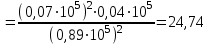
КС рассчитываем по уравнению: КР = КС(RT). Так как для данной реакции
Δ = 3 – 2 = 1, то КС =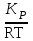 =
= 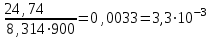 . Таким образом,
. Таким образом,
КР = 24,74; КС = 3,310–3.
Пример 4.9. В какую сторону сместится химическое равновесие реакции
А + В D, если повысить температуру на 30°? Температурные коэффициенты скорости прямой и обратной реакции соответственно равны 2 и 3.
D, если повысить температуру на 30°? Температурные коэффициенты скорости прямой и обратной реакции соответственно равны 2 и 3.
Решение. При повышении температуры на 30° скорость прямой реакции возрастет в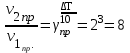 раз, а скорость обратной в
раз, а скорость обратной в 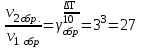 раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево).
раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево).
Контрольные вопросы
66. В начальный момент протекания реакции
NiO(к) + Н2(г) Ni(к) + H2O(г)
Ni(к) + H2O(г)
концентрации были равны (моль/л): СН2 = 0,5; СН2О = 1,7. Рассчитайте равновесные концентрации газообразных веществ, если КС = 5,66.
67. Константа равновесия реакции N2O4
2NO2 равна 0,16 при 375 К. Равновесная концентрация NO2 равна 0,09 моль/л. Вычислите равновесную и исходную концентрацию N2O4. Какая часть (в %) N2O4 разложилась к моменту наступления равновесия?
68. Рассчитайте равновесные концентрации газообразных веществ в гетерогенной системе FeO(к) + CO(г) Fe(к) + CO2(г), если начальная концентрация СО составляла 2 моль/л, константа равновесия КС=0,6.
Fe(к) + CO2(г), если начальная концентрация СО составляла 2 моль/л, константа равновесия КС=0,6.
69. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции 2NO2 2NO + O2 установилось при следующих концентрациях: [NO2] = 0,4 моль/л; [NO] = 1 моль/л; [O2] = 0,5 моль/л. Вычислите константу равновесия для этой температуры и исходную концентрацию диоксида азота.
2NO + O2 установилось при следующих концентрациях: [NO2] = 0,4 моль/л; [NO] = 1 моль/л; [O2] = 0,5 моль/л. Вычислите константу равновесия для этой температуры и исходную концентрацию диоксида азота.
70. Используя справочные данные табл. 1 приложения, рассчитайте ΔН0 реакции, протекающей по уравнению 2NO2(г) 2NO(г) + O2(г) и определите, в какую сторону сместится равновесие при охлаждении системы.
2NO(г) + O2(г) и определите, в какую сторону сместится равновесие при охлаждении системы.
71. Рассчитайте равновесную концентрацию О3 и константу равновесия в реакции 3О2(г) 2О3(г), если начальная масса О2 равна 24 г, а равновесная концентрация О2 равна 0,6 моль/л.
2О3(г), если начальная масса О2 равна 24 г, а равновесная концентрация О2 равна 0,6 моль/л.
72. Реакция идет по уравнению N2 + ЗН2 = 2NH3 Концентрации участвующих в ней веществ (моль/л): [N2] = 0,80; [Н2] = 1,5; [NH3] = 0,10. Вычислите концентрацию водорода и аммиака, когда [N2] =0,5 моль/л.
73. В закрытом сосуде установилось равновесие СО + Н2О СО2 + Н2. Исходные концентрации оксида углерода и паров воды были соответственно равны 0,8 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2, если равновесная концентрация СО
СО2 + Н2. Исходные концентрации оксида углерода и паров воды были соответственно равны 0,8 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2, если равновесная концентрация СО
2 равна 0,3 моль/л. Рассчитайте константу равновесия.
74. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л, [О2] - 0,01 моль/л. Вычислите концентрацию этих веществ, когда [NО] = 0,005 моль/л.
75. Напишите выражение для константы равновесия гомогенной системы
N2 + ЗН2 2NH3.
2NH3.
Как изменится скорость прямой реакции, если увеличить концентрацию водорода в 3 раза?
76. При состоянии равновесия системы N2 + 3H2 2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитайте, как изменятся скорости прямой и обратной реакции, если давление увеличить в 4 раза. В каком направлении сместится равновесие?
2NH3 концентрации веществ были (моль/л): [N2] = 0,3; [H2] = 0,9; [NH3] = 0,4. Рассчитайте, как изменятся скорости прямой и обратной реакции, если давление увеличить в 4 раза. В каком направлении сместится равновесие?
77. В гомогенной системе СО + С12 СОС12 равновесные концентрации реагирующих веществ (моль/л) [СО] = 0,2; [С12] =0,3; [СОСl2] = 1,2. Вычислите константу равновесия системы и исходные концентрации С12 и СО.
СОС12 равновесные концентрации реагирующих веществ (моль/л) [СО] = 0,2; [С12] =0,3; [СОСl2] = 1,2. Вычислите константу равновесия системы и исходные концентрации С12 и СО.
78. Как изменится скорость прямой и обратной реакции в системе
СО(г) + 3Н2(г) СН4(г) + H2O(г),
СН4(г) + H2O(г),
если концентрации исходных веществ и продуктов реакции уменьшить в 3 раза? В каком направлении сместится равновесие?
79. Реакция идет по уравнению Н2 + I2 = 2HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ (моль/л) [Н2] = 0,04; [
I2] = 0,05. Вычислите начальную скорость реакции и ее скорость при [Н2] = 0,03 моль/л.
80. Вычислите константу равновесия для гомогенной системы
СО(г) + Н2О(г) СО2(г) + Н2(г), если равновесные концентрации реагирующих веществ (моль/л): [СО]Р= = 0,004; [Н2О]Р = 0,064; [СО2]Р = 0,016.. Чему равны исходные концентрации воды и СО?
СО2(г) + Н2(г), если равновесные концентрации реагирующих веществ (моль/л): [СО]Р= = 0,004; [Н2О]Р = 0,064; [СО2]Р = 0,016.. Чему равны исходные концентрации воды и СО?
81. Почему при изменении давления смещается равновесие системы
N2 + ЗН2 2NH3 и не смещается равновесие системы N2 + О2
2NH3 и не смещается равновесие системы N2 + О2  2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
82. В реакторе при некоторой температуре протекает реакция
СО2 + Н2 СО + Н2О. Определите константу равновесия, если в начальный момент СН2 = 2,15 моль/л, ССО2 = 1,25 моль/л, а к моменту равновесия прореагировало 60% начального количества СО2.
СО + Н2О. Определите константу равновесия, если в начальный момент СН2 = 2,15 моль/л, ССО2 = 1,25 моль/л, а к моменту равновесия прореагировало 60% начального количества СО2.
83. При 80°С некоторая реакция заканчивается за 10 мин. Принимая температурный коэффициент скорости реакции равным 2, рассчитайте, через какое время закончится эта реакция, если проводить ее при 60°С; при 150°С.
84. Константа равновесия гомогенной системы N2 + 3H2 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,8 моль/л. Вычислите равновесную и исходную концентрацию азота.
2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,8 моль/л. Вычислите равновесную и исходную концентрацию азота.
При уменьшении объема в 3 раза концентрации всех веществ увеличатся в 3 раза. После увеличения концентрации скорость прямой реакции стала
Vпр = 1(3
 )2(3
)2(3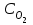 ) = 1 9
) = 1 9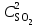 3
3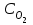 = 271
= 271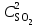
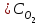 , т. е. возросла в 27 раз; а скорость обратной Vобр = 2 (3
, т. е. возросла в 27 раз; а скорость обратной Vобр = 2 (3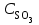 )2 = 2 9
)2 = 2 9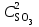 = 92
= 92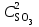 , т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).
, т. е. возросла в 9 раз. Следовательно, равновесие сместится в сторону прямой реакции (вправо).Пример 4.7. Как изменятся скорости прямой и обратной реакции, если в системе 2NO(г)+О2(г)
Решение. До уменьшения давления выражения для скорости прямой и обратной реакции имели вид: vпр = 1
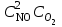 vобр = 2
vобр = 2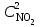
При уменьшении давления в 2 раза концентрации всех реагирующих веществ уменьшаются в 2 раза, так как общий объем системы увеличивается в 2 раза.
Тогда
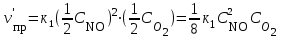
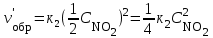 .
.В результате уменьшения давления скорость прямой реакции уменьшилась в 8 раз, а скорость обратной в 4 раза. Таким образом, скорость обратной реакции будет в 2 раза больше, чем прямой и смещение равновесия произойдет в сторону обратной реакции, т. е. в сторону разложения NO2.
Пример 4.8. Объемный состав реакционной газовой смеси в момент равновесия для реакции 2А
2В + D был следующий: 89% А; 7% В; 4% D. Найдите КР и КС для этой реакции, если общее давление в системе при температуре 900 К равно 105 Па.
Решение. Для реакции, протекающих между газами, при вычислении константы равновесия удобно пользоваться парциальными давлениями реагирующих веществ. Парциальным давлением газа в смеси называется давление, которое производил бы этот газ, занимая при тех же физических условиях объем всей газовой смеси. Общее давление смеси газов равно сумме парциальных давлений газов.
Для данной реакции парциальные давления составляют РА=0,89105 Па, РВ=0,07105 Па, РD=0,04105 Па. Подставляем эти значения в выражение константы равновесия:
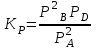
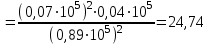
КС рассчитываем по уравнению: КР = КС(RT). Так как для данной реакции
Δ = 3 – 2 = 1, то КС =
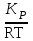 =
= 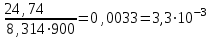 . Таким образом,
. Таким образом, КР = 24,74; КС = 3,310–3.
Пример 4.9. В какую сторону сместится химическое равновесие реакции
А + В
Решение. При повышении температуры на 30° скорость прямой реакции возрастет в
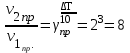 раз, а скорость обратной в
раз, а скорость обратной в 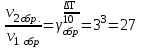 раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево).
раз. Так как скорость обратной реакции возросла в 27 раз, а скорость прямой в 8 раз, то равновесие этой реакции при повышении температуры сместится в сторону обратной реакции (влево). Контрольные вопросы
66. В начальный момент протекания реакции
NiO(к) + Н2(г)
концентрации были равны (моль/л): СН2 = 0,5; СН2О = 1,7. Рассчитайте равновесные концентрации газообразных веществ, если КС = 5,66.
67. Константа равновесия реакции N2O4
2NO2 равна 0,16 при 375 К. Равновесная концентрация NO2 равна 0,09 моль/л. Вычислите равновесную и исходную концентрацию N2O4. Какая часть (в %) N2O4 разложилась к моменту наступления равновесия?
68. Рассчитайте равновесные концентрации газообразных веществ в гетерогенной системе FeO(к) + CO(г)
69. При нагревании диоксида азота в закрытом сосуде до некоторой температуры равновесие реакции 2NO2
70. Используя справочные данные табл. 1 приложения, рассчитайте ΔН0 реакции, протекающей по уравнению 2NO2(г)
71. Рассчитайте равновесную концентрацию О3 и константу равновесия в реакции 3О2(г)
72. Реакция идет по уравнению N2 + ЗН2 = 2NH3 Концентрации участвующих в ней веществ (моль/л): [N2] = 0,80; [Н2] = 1,5; [NH3] = 0,10. Вычислите концентрацию водорода и аммиака, когда [N2] =0,5 моль/л.
73. В закрытом сосуде установилось равновесие СО + Н2О
2 равна 0,3 моль/л. Рассчитайте константу равновесия.
74. Реакция идет по уравнению N2 + O2 = 2NO. Концентрации исходных веществ до начала реакции были [N2] = 0,049 моль/л, [О2] - 0,01 моль/л. Вычислите концентрацию этих веществ, когда [NО] = 0,005 моль/л.
75. Напишите выражение для константы равновесия гомогенной системы
N2 + ЗН2
Как изменится скорость прямой реакции, если увеличить концентрацию водорода в 3 раза?
76. При состоянии равновесия системы N2 + 3H2
77. В гомогенной системе СО + С12
78. Как изменится скорость прямой и обратной реакции в системе
СО(г) + 3Н2(г)
если концентрации исходных веществ и продуктов реакции уменьшить в 3 раза? В каком направлении сместится равновесие?
79. Реакция идет по уравнению Н2 + I2 = 2HI. Константа скорости этой реакции при некоторой температуре равна 0,16. Исходные концентрации реагирующих веществ (моль/л) [Н2] = 0,04; [
I2] = 0,05. Вычислите начальную скорость реакции и ее скорость при [Н2] = 0,03 моль/л.
80. Вычислите константу равновесия для гомогенной системы
СО(г) + Н2О(г)
81. Почему при изменении давления смещается равновесие системы
N2 + ЗН2
82. В реакторе при некоторой температуре протекает реакция
СО2 + Н2
83. При 80°С некоторая реакция заканчивается за 10 мин. Принимая температурный коэффициент скорости реакции равным 2, рассчитайте, через какое время закончится эта реакция, если проводить ее при 60°С; при 150°С.
84. Константа равновесия гомогенной системы N2 + 3H2