Файл: 1 Жмса Д алуды технологиялы схемасын растыру. 2 Дз жне мб сапасын басару жйелері. Дз жне мб сапасын басару жйелері.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 18.01.2024
Просмотров: 106
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ҚР Стандарттау бойынша нормативтік құжаттары ҚР «Стандарттау туралы» Заңымен бекітіліген.
Оларға мыналар жатады:
• Қазақстан Республикасының Мемлекеттік стандарттары (СТ РК) халқаралық, аймақтық стандарттар, сонымен қатар стандарттау бойынша нормалар мен нұсқаулар қолданылады;
• техниклық-экономикалық ақпараттардың жалпы қазақстандық классификаторлары;
• салалық стандарттар;
• кәсіпорынның стандарттары;
• ғылыми-техникалық, инженерлік және басқа да қоғамдық бірлестіктердің стандарттары.
Стандарттаудың негiзгi принциптерi:
1) келiсу;
2) бүкпесiздiк;
3) ерiктiлiк;
4) отандық және шетелдiк өндiрушiлер мен өнiм берушiлер үшiн стандарттау саласындағы бiрдей талаптар;
5) экономикалық қисындылық болып табылады.
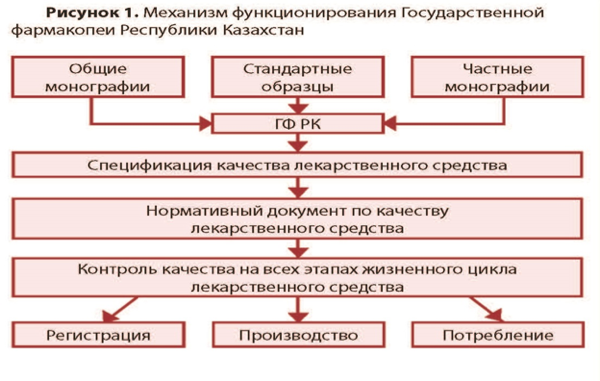
9) ҚР МФ қызметінің жағдайы және механизмі. ҚР Мемлекеттік Фармакопеясының құрылымы
ҚР Мемлекеттік Фармакопеясының құрылымы
Мемлекеттік фармакопея (МФ) – бұл мемлекеттік бақылаудағы және заңды күші бар фармакопея. МФ талаптары дәрілік заттарды өндірумен, сақтаумен және қолданумен айналысатын белгілі бір мемлекеттің дәрілік заттар айналымының барлық субъектілері үшін міндетті болып табылады.
ҚР МФ құру мемлекеттік қолдау арқылы 2005 жылдан бастап жүзеге асырылады. Фармакопеяның алғашқы басылымы үш томда мемлекеттік (қазақ) және орыс тілдерінде жарияланған [5-7]. I және II том 2008 жылы, III том 2015 жылы бекітілді және қолданысқа енгізілді. ҚР МФ заңнамалық мәртебесі "Халық денсаулығы және денсаулық сақтау жүйесі туралы"ҚР Кодексінде белгіленген.
Бүкіл әлемде фармакопеяның жұмыс істеуі олардың миссиясымен айқындалады. Оның тұжырымдамаларының айырмашылығы барлық жағдайларда олардың қауіпсіздігін, тиімділігі мен сапасын қамтамасыз ететін дәрілік заттар сапасының мемлекеттік стандарттарын жасау жолымен, негізінен, қоғамның денсаулығын сақтауға түсетін мәнде көрсетілмейді. Сол мағына оның мақсаттарына шынайы ізгілікті сипат бере отырып, ҚР МФ миссиясына берілген.ҚР МФ талаптары әлемнің көптеген фармакопеяларымен қатар дәрілік заттарға ғана емес, медициналық мақсаттағы бұйымдарға да қолданылады. Осыған байланысты, ҚР МФ бастапқы анықтамасы медициналық практикада қолданылатын құралдардың көрсетілген санатын қамтитын өзгеріске ұшырады. Осылайша, ҚР МФ дәрілік заттар мен медициналық мақсаттағы бұйымдардың сапасын нормалайтын мемлекеттік стандарттар мен ережелердің жиынтығы болып табылады.
ҚР МФ дәрілік заттарды стандарттау жүйесінде орталық орын алады. Фармакопея мемлекет кепілдік беретін дәрілік заттар сапасының шекті рұқсат етілген деңгейін белгілейді. Өндірушілердің ерекшеліктерімен регламенттелетін сапа деңгейі фармакопеялық талаптардан төмен болмауы керек. Өндірушінің ерекшелігі негізінде уәкілетті органмен келісім бойынша оның өмірлік циклінің барлық сатыларында сапаны бақылауға арналған дәрілік заттың сапасы бойынша нормативтік құжат жасалады. Осылайша, фармакопея талаптары дәрілік заттардың толық өмірлік циклін қамтиды. Жұмыс істеудің осындай тетігі дәрілік заттардың сапасын мемлекеттік реттеудің басты құралы ретінде ҚР МФ рөлін айқындайды
Қазіргі уақытта ҚР МФ 191 жалпы бөлім, 24 жалпы мәтін және 90 жалпы монографияны қамтиды (3-сурет). Оларда баяндалған жалпы талаптар мыналарға қолданылады::
-
сынау және сынау әдістері; -
- реактивтер;- сапа көрсеткіштері; -
- буып-түю материалдары мен контейнерлер; -
- фармацевтикалық қолдануға арналған субстанциялар; -
- дәрілік түрлер; -
- дәрілік препараттар, оның ішінде гомеопатиялық препараттар, радиофармацевтикалық препараттар; -
- биологиялық өнімдер; -
- дәрілік өсімдік заттары; -
- дәрілік өсімдік шикізатының морфологиялық топтары; -
- медициналық мақсаттағы бұйымдар (ыдыс ішіндегі катетерлер, тігіс материалдары).
ҚР МФ жалпы монографияларымен қатар сапа көрсеткіштеріне, сынау әдістемелеріне және олардың қолайлылық өлшемдеріне қойылатын талаптарды регламенттейтін 646 жеке монография бар (4-сурет).
Жеке монографиялар келесілерге таратылады:- фармацевтикалық қолдануға арналған субстанциялар, оның ішінде белсенді субстанциялар және қосалқы заттар;- әртүрлі дәрілік түрлердегі дәрілік препараттар;- дәрілік өсімдік шикізаты және дәрілік өсімдік препараттары;- - радиофармацевтикалық препараттар және радиофармацевтикалық препараттарға арналған шығыс материалдары;- медициналық иммунобиологиялық препараттар (вакциналар, иммуноглобулиндер).Фармакопеяның негізгі пайдаланушылары дәрілік заттарды әзірлеушілер, өндірушілер және дистрибьюторлар, дәріханалық ұйымдар, сапаны бақылау зертханалары, реттеуші және сараптамалық органдар, ғылыми және білім беру мекемелері болып табылады.
10) Фармацевтикалық қолдануға арналған субстанцияларды жіктеу және сапа спецификасын жасау.
Фармацевтикалық қолдануға арналған субстанцияларды жіктеу және сапа спецификасын жасау.
Субстанция : дайын дәрі дәрмектер дайындау үшін пайдаланылатын стандартталған биологиялық белсенді зат, (әдетте синтез жолымен алынған) немесе стандартталған биологиялық белсенді заттар қоспасы ( әдетте жануар немесе өсімдік тектес нысандардан алынған). Субстанциялар дайын дәрі дәрмек ретінде пайдаланылмайды. Дайын дәрі дәрмек өндіруші кәсіпорын , дайын дәрі дәрмек жасау алдында субстанциясының сапасына бақылау жүргізеді. Осы пайдаланылған субстанциялардың барлық серияларының үлгілері дайын өнім шығарылғаннан кейін, кем дегенде екі жыл кәсіпорында сақталады.
Сапа көрсеткіштері:
-
Кіріспе бөлім -
Сипаттама -
Ерігіштік -
Идентификация -
Балқу температурасы -
Қайнау температурасы немесе айдаудың температуралық шектері -
Қатаю температурасы -
Салыстырмалы тығыздық -
Меншікті оптикалық айналу -
Меншікті жұтылу көрсеткіші -
Сыну көрсеткіші -
Тұтқырлық -
Ерітіндінің сапалық көрсеткіштері:
-
Мөлдірлік -
Түстілік -
Қышқылдық немесе рН
-
Механикалық қосылулар -
Тектес қоспалар:
-
Идентификацияланған қоспалар -
Идентификацияланбаған қоспалар -
Қоспалардың жиынтық мөлшері
-
Органикалық еріткіштердің қалдық мөлшері -
Жеңіл көмірленетін заттар -
Бейорганикалық аниондар: хлоридтер,сульфаттар,нитраттар -
Бейорганикалық катиондар: темір және басқалар -
Кептіргендегі масса шығыны немесе су -
Жалпы күл немесе сульфат күлі -
Ауыр металдар -
Күшән -
Микробиологиялық тазалық немесе стерильділік -
Пирогендер : бактериялық эндотоксиндер -
Сандық анықтау -
Белсенділік -
Орау -
Таңбалау -
Тасымалдау -
Сақтау -
Сақтау мерзімі
Негізгі фармакологиялық әсері
11) Дәрілік формалардың сапа көрсеткіштерді таңдау.
12) ДЗ сапа спецификасының құрылымы және түрлері
13) Қысым астындағы ДҚ стандарттау
| 1. | Сипаттама |
| 2. | Анықтау |
| 3. | Қысым |
| 4. | Баллонның герметикасын тексеру |
| 5. | Вентильді құрылғыны сынау |
| 6. | Дозаның массасы* |
| 7. | Қаптамадағы дозаның саны* |
| 8. | Қаптамадағы құрамның шығуы |
| 9. | Аэрозоль бөліктерінің мөлшері (суспензия)* |
| 10. | Су* |
| 11. | Ұқсас қоспалар: анықталған қоспалар анықталмаған қоспалар қоспалар жиыны |
| 12. | Микробиологиялық тазалығы |
| 13. | Доза құрамындағы біркелкілігі* |
| 14. | Мөлшерлік анықтау |
| 15. | Қаптама |
| 16. | Таңбалау |
| 17. | Тасымалдау |
| 18. | Сақтау |
| 19. | Сақтау мерзімі |
| 20. | Негізгі фармакологиялық әсері |
14) ДЗ сапасын жоғарылатудағы НҚ рөлі
15) Инъекцияға арналған ерітінділердің тұрақтылығын жақсарту үшін қолданылатын қосымша ингредиенттер.
Инъекцияға арналған ерітінділердің тұрақтылығын жақсарту үшін қолданылатын қосымша ингредиенттер
Инъекциялық дәрілік заттар-стерильді ерітінділер, эмульсиялар немесе суспензиялар. Олар инъекцияға арналған суда немесе белгіленген стерильді Сулы емес сұйықтықта немесе осы еріткіштердің қоспасында белсенді және көмекші заттарды еріту, эмульгиялау немесе тоқтата тұру арқылы дайындалады. Тиісті бақылау жағдайларында инъекцияға арналған ерітінділер мөлдір және іс жүзінде бөлшектерден бос болуы тиіс. Инъекцияға арналған эмульсиялар стратификация белгілерін анықтамауы керек. Енгізу тәсіліне қарай инъекциялық дәрілік нысандар тері астына, бұлшықетішілік, көктамыр ішіне, буын ішіне, жүрекішілік, қуыс ішіне, субконъюктивті және т. б. болып бөлінеді.
Көп дозалы Сулы инъекциялық дәрілік заттардың құрамында тиісті микробқа қарсы қасиеттері бар препараттарды қоспағанда, қажетті концентрациядағы тиісті микробқа қарсы консервант бар. Көп дозалы контейнерде парентеральді қолдану үшін дәрілік затты шығару кезінде оны енгізу және әсіресе дозаларды іріктеу арасында сақтау бойынша сақтық шараларын көрсету қажет.
Микробқа қарсы консерванттар. Асептикалық жағдайда дайындалған және термиялық стерилизацияға ұшырамайтын су препараттарында тиісті концентрацияда белгілі бір микробқа қарсы консерванттар болуы керек. Микробқа қарсы консерванттар қолданылмайды, егер:
- дәлелденген және бекітілген жағдайлардан басқа, бір реттік дозада енгізілетін көлем 15 мл-ден асса;
- препараттар бассүйек ішіне немесе жұлын сұйықтығына қол жеткізетін басқа да инъекцияларға немесе интра - немесе ретроокулярлы инъекцияларға немесе эпидуральды инъекцияларға арналған болса.
Мұндай препараттар бір дозалы контейнерлерде шығарылады.
Бұл формаларға қойылатын басты талап — стерильділік. Стерилизацияның әртүрлі әдістері бар, мысалы, автоклавта (120°C қаныққан бу немесе 100-110°c сұйық бу). Қыздыру кезінде ыдырайтын ерітінділерді зарарсыздандыру үшін олар 70-80°C температурада үш есе немесе 60-65°C температурада бес есе тиндализацияға жүгінеді.
Дәрілік заттардың сапасы мен қауіпсіздігін бақылау жөніндегі нормативтік техникалық құжаттарды құрастыру ережесінде инфузиялық дәрілік қалыптардың тұрақтылығын бақылауға койылатын нормативті құжат жобасында (АНҚ) мыналардың болуы талап етіледі: