Файл: 1. Иммобилизованные ферменты и их преимущества 5 Основы технологии иммобилизации ферментов 9.docx
Добавлен: 08.11.2023
Просмотров: 337
Скачиваний: 5
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
, на поверхность одного из которых помещают слой носителя. При пропускании электрического тока молекулы фермента или клетки благодаря имеющимся на поверхности заряженным группам начинают перемещаться в растворе в направлении электрода с носителем и осаждаются на поверхности последнего.
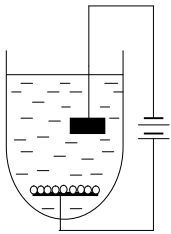
Рисунок 2 – Иммобилизация методом электроосаждения
Иммобилизация в массе носителя. Этот вариант один из самых распространенных, хотя его нельзя отнести к самым простым подходам. В данном варианте иммобилизации в качестве носителей применяются либо полимерный гель, либо полимерное волокно.
Нерастворимые материалы, которые служат основой матриц подобных носителей, могут быть как органическими веществами, так и неорганическими соединениями, как синтетическими производными, так и природными продуктами.
Если говорить о природе сил, удерживающих препарат в объеме носителя, то и здесь может быть как обездвиживание за счет физических факторов (просто массой носителя, т. е. механически), так и фиксация с образованием ковалентных связей между компонентами препарата и веществом матрицы (препарат «вшивается» в носитель) (рисунок 3).
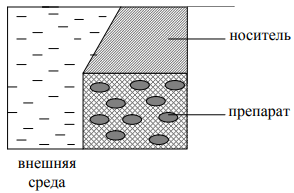
Рисунок 3 – Иммобилизация в массе носителя
Широкое распространение метода обусловлено тем, что в этом варианте достигается более высокая удельная концентрация иммобилизованных препаратов в носителе. Это в свою очередь теоретически дает возможность поднять продуктивность биотехнологического процесса в целом.
Еще одно важное преимущество иммобилизации в носителе по сравнению с иммобилизацией на носителе состоит в хороших эксплуатационных свойствах получаемых препаратов. Препараты также лучше защищены от многих неблагоприятных факторов среды.
Иммобилизация с использованием мембранной технологии. Суть метода — водный раствор препарата отделяется от водного раствора субстрата избирательно проницаемой мембраной. Существующие модификации этого метода различаются лишь способами получения избирательно проницаемой мембраны и ее природой. Важным фактором является толщина мембраны, — с ее уменьшением происходит повышение проявляемой иммобилизованными биокатализаторами активности, что определяется возможностью увеличения диффузии субстрата к биокатализатору.
Наиболее широкое распространение мембранные биокатализаторы получили не в системах превращения веществ, а при создании чувствительных элементов биосенсоров.
В мембранной технологии применяются следующие системы: плоские мембраны, пористые волокна и микрокапсулы.
Плоские мембраны легко пропускают молекулы субстрата, но представляют собой непреодолимый барьер для крупных молекул фермента или клеток (рисунок 4).
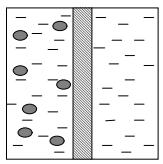
Рисунок 4 – Иммобилизация с использованием мембранной технологии
Пористые волокна — аналогично случаю плоских мембранных носителей, только здесь используются мембранные полые волокна. Фактически эти волокна представляют собой длинные тонкие трубки, стенки которых выполнены из полимерной мембраны (рисунок 5).
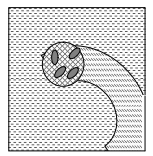
Рисунок 5 – Иммобилизация в пористые волокна
По сравнению с плоскими мембранами отношение занимаемого препаратами объема к общему объему системы выше, поэтому и выше получаются удельные продуктивности. Среди волокнообразующих полимеров используются триацетат целлюлозы — дешевый и доступный носитель, а также волокна коагулята целлюлозы. Носитель из коагулята целлюлозы гидрофилен, обладает высокой механической прочностью, его химическая и биологическая устойчивость определяется стабильностью самой целлюлозы.
Суть метода микрокапсулирования в том, что водный раствор с биопрепаратом (фермент, клетка) включают внутрь микрокапсул, представляющих собой замкнутые сферические пузырьки с тонкой полимерной стенкой (мембраной). В зависимости от условий получения размер микрокапсул изменяется от нескольких десятков до нескольких сотен микрометров.
Для формирования микрокапсул с иммобилизованными препаратами существуют два основных подхода: диспергирование и (микро) гранулирование.
В первом случае водная суспензия фермента диспергируется в несмешивающуюся с ней органическую жидкость, а присутствующие в системе специальные добавки образуют на поверхности капелек водной фазы мембранную пленку. Получаемые микрокапсулы имеют неодинаковые размеры — существует некоторое распределение величин их диаметров, зависящее от гидродинамических свойств применяемых жидкостей, интенсивности перемешивания, соотношения объемов фаз, геометрии рабочего сосуда и конструкции мешалки.
Во втором случае водная суспензия препарата через особое дозирующее устройство (гранулятор) инъектируется порциями строго заданного объема в несмешивающуюся с водой органическую жидкость, где на границе раздела фаз поверхности водной капли происходит формирование оболочки микрокапсулы. В этом случае получаются частицы практически одинаковой величины.
В принципе микрокапсулирование отличается от включения в волокна главным образом формой получаемых препаратов: при микрокапсулировании образуются сферические микрокапсулы, а при втором способе — нити.
Технология микрокапсулирования в настоящее время находит очень широкое применение в самых разнообразных отраслях — от производства лекарств и пищевых добавок до изготовления красящего слоя печатающих устройств или специальных антипиреновых присадок к полимерным композициям. Большие надежды связываются с практической реализацией лазерного термоядерного синтеза, где используют шарики дейтерево-тритиевого топлива, включенные как раз в микрокапсулы. Определенное развитие получили методы иммобилизации ферментов в полимерные микрокапсулы, а также довольно популярны эти приемы при иммобилизации животных и растительных клеток; что касается микроорганизмов, то таких работ еще мало.
Наполнение микрокапсул (внутреннее содержимое) может быть газовым, жидким, студнеобразным и твердым.
Весьма интересен прием совместного капсулирования клеток и экзогенных ферментов. Например, бактерии Gluconobacter oxydans, способные окислять глюкозу в глюконовую кислоту, требуют для этого хорошего снабжения кислородом. Однако при капсулировании даже при обильной аэрации они проявляли низкую глюкозооксидазную активность. При включении в полимер одновременно с клетками каталазы и добавлении в среду Н2О2 (донор кислорода) количество образующейся глюконовой кислоты резко увеличилась.
Для целей иммобилизации, как оказалось, можно использовать свойства ряда металлов образовывать хелатные комплексы. В этом случае не требуется дополнительной модификации носителя, и иммобилизация протекает быстро и в достаточно обычных условиях. Наиболее подходящими свойствами для иммобилизации обладают из переходных металлов титан и цирконий, оксиды которых не проявляют токсического действия.
Этот метод иммобилизации разработан для ферментов на основе химии гидроксидов переходных металлов. В качестве носителя используют собственно гидроксид металла, который можно получить осаждением при гидролизе соответствующего хлорида. Молекула фермента иммобилизуется при образовании хелатов.
При некоторых приемах используется совместное осаждение гидроксидов металлов с ферментами. Такое осаждение может привести к получению более активного продукта, чем при последующем добавлении фермента, так как поверхность частицы выпадающего в осадок гидроксида очень велика. Однако при этом необходимо учитывать возможную инактивацию фермента в результате инкубации при низких значениях рН.
Чтобы получить более высокую ферментативную активность, нужно оптимизировать процесс иммобилизации относительно некоторых важных условий: продолжительность иммобилизации, рН, соотношение количества фермента и носителя.
Металлохелатный метод иммобилизации ферментов впервые разработал Новеис в университете г. Бирменген (Великобритания) в опытах иммобилизации на целлюлозе с применением диазотирования.
Рассмотрим возможность переходных металлов образовывать хелатные комплексы с биополимерами на примере титана и целлюлозы. В растворе хлорида титана определенная часть ионов титана образует октаэдрические координационные
комплексы с другими молекулами и ионами, которые в данном случае выступают в роли лигандов комплексного иона (пример комплексного иона приведен на рисунке 6).
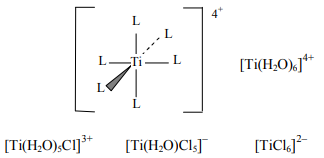
Рисунок 6 – Пример комплексного иона
Гидроксильные группы являются эффективными лигандами для ионов переходных металлов, и, следовательно, можно ожидать, что ионы переходных металлов будут образовывать комплексы с полисахаридами, гидроксильные группы которых будут замещать другие лиганды. Более того, хорошо известно, что гликоли — очень эффективные лиганды ионов переходных металлов. Некоторые полисахариды, такие как целлюлоза, содержат гидроксильные группы, не участвующие в образовании гликозидных связей между углеводными остатками, и, следовательно, способные образовывать хелаты с ионами переходных металлов, замещая своими гидроксильными группами два лиганда иона титана. Таким образом, поскольку целлюлоза представляет собой полимер молекул D-глюкопиранозы, связанных β-1,4-связью, в образовании хелатов могут участвовать гидроксильные группы в положении 2 и 3.
О возможности участия во взаимодействии целлюлозной цепи с титаном гидроксильной группы в положении 6 D-глюкопиранозного остатка можно лишь строить предположения. Стерически этой группе трудно приблизиться к другим гидроксильным группам целлюлозы и участвовать в образовании хелата. Таким образом, обработанную хлоридом титана целлюлозу можно рассматривать как полимерный хелат с аква-, хлораква- и хлор-комплексами титана, преобладающими в водном растворе хлорида титана (рисунок 7).
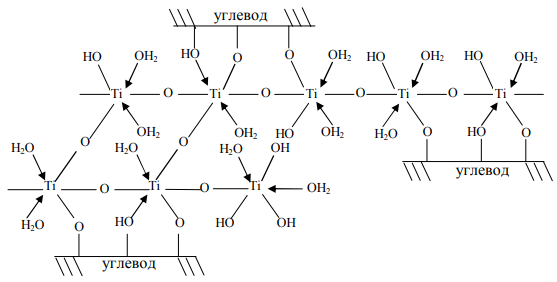
Рисунок 7 – Обработанная титаном целлюлоза, координационно связавшая вдоль своих цепей различные аква-, хлораква- и хлор-комплексы ионов титана, преобладающие
в растворе
Следует отметить, что по стерическим соображениям все лиганды иона титана заместить гидроксильными группами полисахаридной цепи невозможно. Более того, оставшиеся лиганды не будут замещаться гидроксильными группами соседней целлюлозной цепи из-за нерастворимости и недостаточной подвижности макромолекулы целлюлозы. Любая же другая молекула, содержащая группы, способные замещать лиганды, может образовать хелат с титаном, связанным с целлюлозой. Такая молекула должна находиться в водном растворе и рН раствора может быть близок к нейтральному.

Рисунок 2 – Иммобилизация методом электроосаждения
Иммобилизация в массе носителя. Этот вариант один из самых распространенных, хотя его нельзя отнести к самым простым подходам. В данном варианте иммобилизации в качестве носителей применяются либо полимерный гель, либо полимерное волокно.
Нерастворимые материалы, которые служат основой матриц подобных носителей, могут быть как органическими веществами, так и неорганическими соединениями, как синтетическими производными, так и природными продуктами.
Если говорить о природе сил, удерживающих препарат в объеме носителя, то и здесь может быть как обездвиживание за счет физических факторов (просто массой носителя, т. е. механически), так и фиксация с образованием ковалентных связей между компонентами препарата и веществом матрицы (препарат «вшивается» в носитель) (рисунок 3).

Рисунок 3 – Иммобилизация в массе носителя
Широкое распространение метода обусловлено тем, что в этом варианте достигается более высокая удельная концентрация иммобилизованных препаратов в носителе. Это в свою очередь теоретически дает возможность поднять продуктивность биотехнологического процесса в целом.
Еще одно важное преимущество иммобилизации в носителе по сравнению с иммобилизацией на носителе состоит в хороших эксплуатационных свойствах получаемых препаратов. Препараты также лучше защищены от многих неблагоприятных факторов среды.
Иммобилизация с использованием мембранной технологии. Суть метода — водный раствор препарата отделяется от водного раствора субстрата избирательно проницаемой мембраной. Существующие модификации этого метода различаются лишь способами получения избирательно проницаемой мембраны и ее природой. Важным фактором является толщина мембраны, — с ее уменьшением происходит повышение проявляемой иммобилизованными биокатализаторами активности, что определяется возможностью увеличения диффузии субстрата к биокатализатору.
Наиболее широкое распространение мембранные биокатализаторы получили не в системах превращения веществ, а при создании чувствительных элементов биосенсоров.
В мембранной технологии применяются следующие системы: плоские мембраны, пористые волокна и микрокапсулы.
Плоские мембраны легко пропускают молекулы субстрата, но представляют собой непреодолимый барьер для крупных молекул фермента или клеток (рисунок 4).

Рисунок 4 – Иммобилизация с использованием мембранной технологии
Пористые волокна — аналогично случаю плоских мембранных носителей, только здесь используются мембранные полые волокна. Фактически эти волокна представляют собой длинные тонкие трубки, стенки которых выполнены из полимерной мембраны (рисунок 5).

Рисунок 5 – Иммобилизация в пористые волокна
По сравнению с плоскими мембранами отношение занимаемого препаратами объема к общему объему системы выше, поэтому и выше получаются удельные продуктивности. Среди волокнообразующих полимеров используются триацетат целлюлозы — дешевый и доступный носитель, а также волокна коагулята целлюлозы. Носитель из коагулята целлюлозы гидрофилен, обладает высокой механической прочностью, его химическая и биологическая устойчивость определяется стабильностью самой целлюлозы.
2.3. Микрокапсулирование
Суть метода микрокапсулирования в том, что водный раствор с биопрепаратом (фермент, клетка) включают внутрь микрокапсул, представляющих собой замкнутые сферические пузырьки с тонкой полимерной стенкой (мембраной). В зависимости от условий получения размер микрокапсул изменяется от нескольких десятков до нескольких сотен микрометров.
Для формирования микрокапсул с иммобилизованными препаратами существуют два основных подхода: диспергирование и (микро) гранулирование.
В первом случае водная суспензия фермента диспергируется в несмешивающуюся с ней органическую жидкость, а присутствующие в системе специальные добавки образуют на поверхности капелек водной фазы мембранную пленку. Получаемые микрокапсулы имеют неодинаковые размеры — существует некоторое распределение величин их диаметров, зависящее от гидродинамических свойств применяемых жидкостей, интенсивности перемешивания, соотношения объемов фаз, геометрии рабочего сосуда и конструкции мешалки.
Во втором случае водная суспензия препарата через особое дозирующее устройство (гранулятор) инъектируется порциями строго заданного объема в несмешивающуюся с водой органическую жидкость, где на границе раздела фаз поверхности водной капли происходит формирование оболочки микрокапсулы. В этом случае получаются частицы практически одинаковой величины.
В принципе микрокапсулирование отличается от включения в волокна главным образом формой получаемых препаратов: при микрокапсулировании образуются сферические микрокапсулы, а при втором способе — нити.
Технология микрокапсулирования в настоящее время находит очень широкое применение в самых разнообразных отраслях — от производства лекарств и пищевых добавок до изготовления красящего слоя печатающих устройств или специальных антипиреновых присадок к полимерным композициям. Большие надежды связываются с практической реализацией лазерного термоядерного синтеза, где используют шарики дейтерево-тритиевого топлива, включенные как раз в микрокапсулы. Определенное развитие получили методы иммобилизации ферментов в полимерные микрокапсулы, а также довольно популярны эти приемы при иммобилизации животных и растительных клеток; что касается микроорганизмов, то таких работ еще мало.
Наполнение микрокапсул (внутреннее содержимое) может быть газовым, жидким, студнеобразным и твердым.
Весьма интересен прием совместного капсулирования клеток и экзогенных ферментов. Например, бактерии Gluconobacter oxydans, способные окислять глюкозу в глюконовую кислоту, требуют для этого хорошего снабжения кислородом. Однако при капсулировании даже при обильной аэрации они проявляли низкую глюкозооксидазную активность. При включении в полимер одновременно с клетками каталазы и добавлении в среду Н2О2 (донор кислорода) количество образующейся глюконовой кислоты резко увеличилась.
2.4. Иммобилизация металлохелатным способом
Для целей иммобилизации, как оказалось, можно использовать свойства ряда металлов образовывать хелатные комплексы. В этом случае не требуется дополнительной модификации носителя, и иммобилизация протекает быстро и в достаточно обычных условиях. Наиболее подходящими свойствами для иммобилизации обладают из переходных металлов титан и цирконий, оксиды которых не проявляют токсического действия.
Этот метод иммобилизации разработан для ферментов на основе химии гидроксидов переходных металлов. В качестве носителя используют собственно гидроксид металла, который можно получить осаждением при гидролизе соответствующего хлорида. Молекула фермента иммобилизуется при образовании хелатов.
При некоторых приемах используется совместное осаждение гидроксидов металлов с ферментами. Такое осаждение может привести к получению более активного продукта, чем при последующем добавлении фермента, так как поверхность частицы выпадающего в осадок гидроксида очень велика. Однако при этом необходимо учитывать возможную инактивацию фермента в результате инкубации при низких значениях рН.
Чтобы получить более высокую ферментативную активность, нужно оптимизировать процесс иммобилизации относительно некоторых важных условий: продолжительность иммобилизации, рН, соотношение количества фермента и носителя.
Металлохелатный метод иммобилизации ферментов впервые разработал Новеис в университете г. Бирменген (Великобритания) в опытах иммобилизации на целлюлозе с применением диазотирования.
Рассмотрим возможность переходных металлов образовывать хелатные комплексы с биополимерами на примере титана и целлюлозы. В растворе хлорида титана определенная часть ионов титана образует октаэдрические координационные
комплексы с другими молекулами и ионами, которые в данном случае выступают в роли лигандов комплексного иона (пример комплексного иона приведен на рисунке 6).
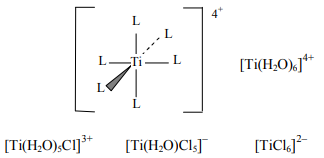
Рисунок 6 – Пример комплексного иона
Гидроксильные группы являются эффективными лигандами для ионов переходных металлов, и, следовательно, можно ожидать, что ионы переходных металлов будут образовывать комплексы с полисахаридами, гидроксильные группы которых будут замещать другие лиганды. Более того, хорошо известно, что гликоли — очень эффективные лиганды ионов переходных металлов. Некоторые полисахариды, такие как целлюлоза, содержат гидроксильные группы, не участвующие в образовании гликозидных связей между углеводными остатками, и, следовательно, способные образовывать хелаты с ионами переходных металлов, замещая своими гидроксильными группами два лиганда иона титана. Таким образом, поскольку целлюлоза представляет собой полимер молекул D-глюкопиранозы, связанных β-1,4-связью, в образовании хелатов могут участвовать гидроксильные группы в положении 2 и 3.
О возможности участия во взаимодействии целлюлозной цепи с титаном гидроксильной группы в положении 6 D-глюкопиранозного остатка можно лишь строить предположения. Стерически этой группе трудно приблизиться к другим гидроксильным группам целлюлозы и участвовать в образовании хелата. Таким образом, обработанную хлоридом титана целлюлозу можно рассматривать как полимерный хелат с аква-, хлораква- и хлор-комплексами титана, преобладающими в водном растворе хлорида титана (рисунок 7).

Рисунок 7 – Обработанная титаном целлюлоза, координационно связавшая вдоль своих цепей различные аква-, хлораква- и хлор-комплексы ионов титана, преобладающие
в растворе
Следует отметить, что по стерическим соображениям все лиганды иона титана заместить гидроксильными группами полисахаридной цепи невозможно. Более того, оставшиеся лиганды не будут замещаться гидроксильными группами соседней целлюлозной цепи из-за нерастворимости и недостаточной подвижности макромолекулы целлюлозы. Любая же другая молекула, содержащая группы, способные замещать лиганды, может образовать хелат с титаном, связанным с целлюлозой. Такая молекула должна находиться в водном растворе и рН раствора может быть близок к нейтральному.