Файл: Изучение молекулярных предикторов сосудистого риска опосредованного эндотелиальной дисфункцией у людей с сахарным диабетом 2 типа.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 05.12.2023
Просмотров: 112
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
КЛИНИЧЕСКАЯ ДИАГНОСТИКА ИНСУЛИНОВОЙ РЕЗИСТЕНТНОСТИ
МОЛЕКУЛЯРНЫЕ МАРКЕРЫ ИНСУЛИНОВОЙ РЕЗИСТЕНТНОСТИ
ШАПЕРОНЫ И МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА
ИНСУЛИНОВАЯ РЕЗИСТЕНТНОСТЬ, КАРБОНИЛЬНЫЙ СТРЕСС И ДИСФУНКЦИЯ ЭНДОТЕЛИЯ
ИНСУЛИНОВАЯ РЕЗИСТЕНТНОСТЬ, АДИПОГЕННАЯ ДИФФЕРЕНЦИРОВКА И ТРАНСКРИПЦИОННЫЙ ФАКТОР PREP1
ИНСУЛИНОВАЯ РЕЗИСТЕНТНОСТЬ, ЛИПОДИСТРОФИЯ И МУТАЦИИ ГЕНОВ
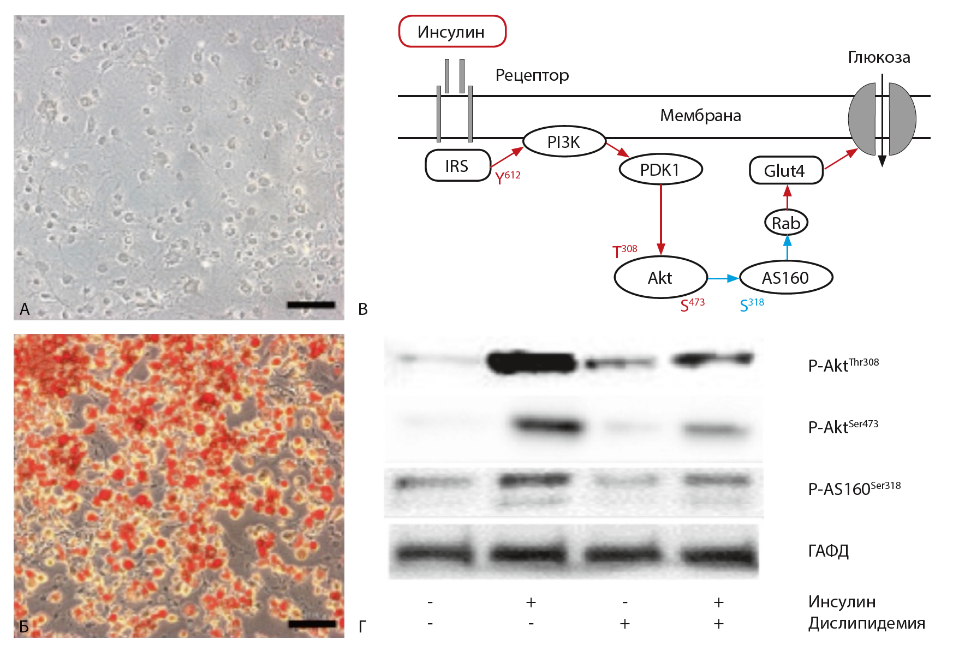
Рис. 1. Определение молекулярных маркеров ИР в линейных адипоцитах 3T3L1. (А) Культура преадипоцитов и (Б) зрелых адипоцитов 3T3L1 с липидными каплями, окрашенными OilRedO. Масштабный отрезок 100 нм. (В) Схема передачи инсулинового сигнала в жировых и мышечных клетках от рецептора до инсулинзависимого транспортера глюкозы Glut4. Красным и синим цветом показаны активирующие и ингибирующие воздействия и фосфорилируемые остатки соответственно. (Г) Способность инсулина стимулировать фосфорилирование компонентов каскада падает в условиях экспериментальной ИР, вызванной дислипидемией (обработкой клеток пальмитиновой кислотой в течение суток). Показаны репрезентативные результаты вестерн-блоттинга лизатов клеток, которые стимулировали или не стимулировали 100 нМ инсулином в течение 20 мин; для контроля нагрузки использовали окраску на глицеральдегидфосфатдегидрогеназу (ГАФД).
На рис. 1Г показано, что в зрелых адипоцитах 3Т3L1 инсулин значительно активирует фосфорилирование Akt и AS160, однако в условиях экспериментальной дислипидемии (длительная обработка клеток конъюгатом альбумина с пальмитиновой кислотой) активация снижается. Аналогичное снижение этих показателей наблюдали с другими индукторами ИР, моделируя условия воспаления (обработка клеток липополисахаридом), стресса ЭПР (обработка брефелдином-А) или гипоксии (обработка солями кобальта). Таким образом, независимо от причины, ИР характеризуется сходным снижением инсулинзависимого фосфорилирования Akt и AS160, которые могут служить маркерами ИР.
Для валидации этих белков как маркеров ИР у человека был проведен пилотный анализ мышечных биопсий. Он подтвердил, что инсулин стимулирует фосфорилирование Akt по остатку Ser-473 у здоровых доноров. При этом уровень фосфорилирования Ser-473 у больных СД2 был ниже. Мы не обнаружили достоверных различий между пациентами со слабой (М-индекс 4–6), умеренной (2–4) и выраженной (<2) степенью ИР. Эти результаты указывают на Ser-473 в Akt как потенциальный маркер ИР.
В лейкоцитах здоровых доноров фосфорилирование Ser-473 в Akt также возрастало при действии инсулина как in vitro (при стимуляции выделенных лейкоцитов инсулином), так и in vivo (в лейкоцитах, выделенных через 4 ч после начала клэмп-теста по сравнению с таковыми, взятыми до начала клэмп-теста). В то же время изменения этого параметра были незначительны у больных СД2, что согласуется с результатами, полученными с использованием мышечных биопсий. Таким образом, уровень фосфорилирования Ser-473 в Akt может маркировать состояние ИР, а лейкоциты периферической крови могут служить удобным объектом, отражая ситуацию в инсулинзависимых тканях.
Мы исследовали гипотезу о том, что, независимо от причины возникновения, развитие ИР опосредовано активацией воспалительного каскада и стрессзависимых киназ JNK и IKK как его главных участников. При всех способах экспериментальной индукции ИР в адипоцитах 3Т3L1 наблюдался более высокий уровень фосфорилирования JNK, чем в адипоцитах без ИР. В модели дислипидемии при этом наблюдалось усиление ингибиторного фосфорилирования белка IRS по остатку Ser-302, который считается субстратом JNK (Sun & Liu, 2009). Ингибиторный анализ JNK в резистентных адипоцитах 3Т3L1 показал частичное восстановление инсулинзависимого фосфорилирования Akt и AS160. Эти результаты свидетельствуют о том, что JNK опосредует развитие ИР различного генеза в адипоцитах 3Т3L1, по-видимому, за счет серинового фосфорилирования IRS и нарушения передачи инсулинового сигнала. Таким образом, фосфорилирование и активация JNK также являются потенциальными маркерами ИР наряду с Akt и AS-160.
ШАПЕРОНЫ И МАЛЫЕ БЕЛКИ ТЕПЛОВОГО ШОКА
Гипергликемия сопровождается развитием карбонильного стресса и накоплением различных конечных продуктов гликирования белков. Все это приводит к нарушению протеостаза, нормального функционирования ферментов и формированию агрегатов денатурированных белков. Для предотвращения этих неблагоприятных процессов происходит активация сложной системы шаперонов, препятствующих агрегации денатурированных белков и их частичной или полной ренатурации. Малые белки теплового шока (small heat shock proteins, sHsp) являются одним из компонентов системы шаперонов, и нарушение их работы может являться одним из факторов патогенеза СД2.
Мы исследовали влияние карбонильных соединений на структуру и свойства sHsp, а также факторы, влияющие на шапероноподобную активность этих белков. Известно, что при СД синтез ряда sHsp увеличивается в некоторых отделах мозга, сетчатке, сердце и клетках почек [38]. Повышение уровня sHsp защищает клетку от окислительного стресса, способствует эффективной передаче сигнала от инсулинового рецептора внутрь клетки и ингибирует процессы апоптоза. По этой причине различные способы повышения внутриклеточной концентрации малых белков теплового шока могут оказаться перспективными при лечении СД.
Связанные с СД2 нарушения метаболизма углеводов и жиров сопровождаются накоплением высокореакционных карбонильных соединений, в частности, метилглиоксаля. Существует много сведений о модификации малых белков теплового шока метилглиоксалем [39]. Эти данные в основном касаются двух малых белков теплового шока, а именно HspB1 и HspB5 (αВ-кристаллина). Эти белки эффективно модифицируются метилглиоксалем, и эта модификация может приводить к изменению олигомерной структуры, способности взаимодействовать с белками-партнерами, изменению антиапоптотической и шаперонной активности sHsp [39]. Следует отметить, что опубликованные данные достаточно противоречивы и касаются только двух из десяти экспрессируемых в тканях человека sHsp. Поэтому мы подробно исследовали модификацию малого белка теплового шока HspB6 метилглиоксалем и выяснили, что эта модификация влияет на стабильность HspB6, его способность взаимодействовать с белком-партнером HspB1, а также на способность HspB6 фосфорилироваться под действием сАМР-зависимой протеинкиназы [40].
В условиях избыточной пищевой нагрузки, карбонильного стресса и нарушенного протеостаза при СД2 особое значение имеет шапероноподобная активность sHsp, т.е. их способность предотвращать агрегацию частично денатурированных белков. Механизм шапероноподобной активности и ее зависимость от структуры sHsp и различных условий остаются малопонятными. Поэтому мы исследовали влияние различных условий и точечных мутаций на структуру и шапероноподобную активность HspB1 и HspB6. Установлено, что в условиях, моделирующих условия пищевой нагрузки внутри клетки (высокие концентрации белка, так называемый краудинг эффект), происходит изменение олигомерного состояния HspB6 [41] и HspB1 [42]. Существенные изменения в олигомерной структуре HspB1 происходят при точечных мутациях в N-концевом [43] и α-кристаллиновом доменах [42]. Эти изменения в олигомерной структуре HspB1 сопровождаются, как правило, уменьшением шапероноподобной активности sHsp. Эти данные указывают на возможный механизм шапероноподобной активности sHsp, играющих важную защитную роль при патологических процессах, происходящих при СД2.
ИНСУЛИНОВАЯ РЕЗИСТЕНТНОСТЬ, КАРБОНИЛЬНЫЙ СТРЕСС И ДИСФУНКЦИЯ ЭНДОТЕЛИЯ
Эндотелий сосудов является первой мишенью инсулина в организме, секретируемого в кровоток β-клетками поджелудочной железы. Аналогично эндотелий является первой мишенью активных форм кислорода и карбонильных аддуктов метаболизма глюкозы и жирных кислот, образующихся в результате окислительного и карбонильного стресса при пищевой перегрузке, ожирении и СД2. Вместе с тем на данный момент не вполне понятно, какие изменения происходят в эндотелии в стрессовых условиях, провоцируют ли они развитие и/или поддерживают состояние сахарного диабета.
Воздействие карбонильного стресса ожидается и на ранних, и на поздних этапах патогенеза СД2. Малоновый диальдегид (МДА) характерен для ранних стадий, являясь продуктом перекисного окисления жирных кислот, избыточных при ожирении. Напротив, накопление карбонильных продуктов распада глюкозы, таких как глиоксаль (ГО) и метилглиоксаль (МГО), происходит на поздних этапах развития СД2 в условиях устойчивой гипергликемии и ведет к гликированию белков плазмы и клеток крови, в частности гемоглобина.
Для того чтобы понять, с какими этапами патогенеза СД2 может быть связана дисфункция эндотелия, мы экспериментально смоделировали условия дислипидемии
, гиперинсулинемии и гипергликемии в линейных клетках EA.hy926 гибридного эндотелия сосудов человека. Для создания карбонильного стресса клетки обрабатывали несколько часов МДА, ГО или МГО; при этом МДА моделировал карбонильный стресс при дислипидемии, а ГО и МГО – при гипергликемии.
Низкомолекулярная проницаемость эндотелиального монослоя EA.hy926 повышалась только в условиях дислипидемии, но не гиперинсулинемии или гипергликемии. Это нарушение проявлялось как снижение электрического сопротивления (импеданса) монослоя как в стационарных условиях, так и при воздействии тромбина – классического индуктора проницаемости. Эти данные свидетельствуют о том, что дисфункция эндотелия может происходить при дислипидемии на ранних этапах патогенеза СД2.
Чтобы выяснить влияние карбонильного стресса, был проведен сравнительный анализ эффектов МДА, ГО и МГО на проницаемость монослоя эндотелия EA.hy926 [44]. Только МДА концентрационно-зависимо и необратимо повышал проницаемость эндотелиального монослоя в течение 4–6 ч после добавления к клеткам, тогда как ГО или МГО на эндотелиальный барьер не влияли. Аналогичное повреждающее действие оказывал неприродный глицеральдегид (ГА). Таким образом, вероятно, что только бифункциональные альдегиды с длиной углеродной цепи 3 и более влияют на проницаемость эндотелия in vitro за счет своей «сшивающей» активности, однако детальный механизм их действия требует уточнения. Избирательный эффект МДА на эндотелиальный барьер подтверждается экспериментами с FITC-меченным декстраном, которые отражают суммарную проницаемость для низко- и высокомолекулярных соединений.
Прижизненный видеоанализ клеток EA.hy926, обработанных карбонилами, показал, что только МДА угнетает их ламеллоподиальную активность. Поскольку эта активность отвечает за формирование межклеточных контактов и барьерную функцию, ее нарушение может являться клеточным механизмом действия МДА. Для того чтобы прояснить молекулярный механизм действия МДА, был проведен анализ структуры актинового и тубулинового цитоскелетов. Актин формировал нормальную сеть тонких филаментов, а тубулиновые микротрубочки – классические радиальные структуры по всей цитоплазме контрольных, а также обработанных ГО или МГО клеток. Все эти клетки формировали плотные контакты друг с другом. Напротив, в обработанных МДА клетках актиновый цитоскелет был менее выражен и деформирован. Микротрубочки распределялись хаотично, без радиальной полярности и локализовались преимущественно в центре клеток. Зоны межклеточных контактов были неоднородны и редуцированы. Эта картина хорошо согласуется с повышенной проницаемостью клеточного монослоя после обработки МДА, но не другими карбонилами.