ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 09.11.2023
Просмотров: 109
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
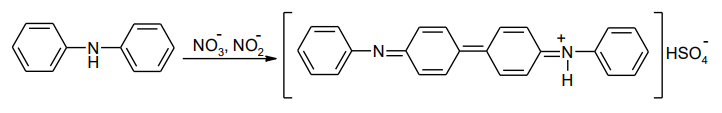
6. Примеси аммиака.
Иногда вода должна быть загрязнена аммиаком или солями аммония. ГФ рекомендует проводить испытание на отсутствие примесей аммиака. В воде очищенной допускается содержание примесного иона аммония в пределах не более 0,00002%. Для сравнения необходимо использовать эталонный раствор, содержащий 0,00002% аммиака. В испытуемой воде и эталонном растворе параллельно проводят реакцию с реактивом Несслера (раствор K2HgJ4 в KOH):
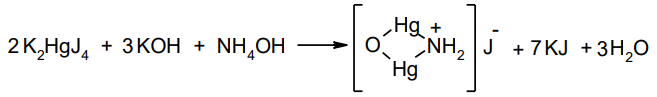
Окраска (бурая или жёлтая) в испытуемой воде не должна быть интенсивнее, чем в эталонном растворе.
7. Тяжёлые металлы.
Тяжелыми металлами называют элементы периодической системы Менделеева, которые обладают металлическими свойствами и плотность которых достигает более высоких значений, чем у железа. К такой категории относится сразу несколько химических элементов, в числе которых: свинец, медь, никель, ртуть, кобальт и сурьма. Описанный ниже метод определения содержания примесей тяжелых металлов в лекарственных средствах основан на образовании окрашенных сульфидов. Соли железа (II) дают с сульфид-ионом черный осадок:
Fe + Na2 S= FeS + 2 Na 2+
ФС регламентирует содержание тяжелых металлов не более 0,00001 %. Методика 1: В пробирку диаметром около 1,5 см помещают 10 мл испытуемой воды очищенной, прибавляют 1 мл уксусной кислоты разведенной 30 %, 2 капли 2% раствора натрия сульфида и перемешивают. Через 1 мин производят наблюдение за изменением окраски раствора по оси пробирки, помещенной на белую поверхность. Не должно быть окрашивания.
8. Восстанавливающие вещества. Восстановительные (органические) примеси в воде создают условия для развития в ней различных плесневых грибков, бактерий, сапрофитов и др. Поэтому испытание на восстановительные примеси является обязательным для очищенной воды. Для этого к 100 мл испытуемой воды добавляют 1 мл 0,02 М раствора перманганата калия, подкисленного разведенной серной кислотой (2 мл 16%), доводят воду до кипения и кипятят 10 мин. Розовое окрашивание воды должно сохраниться - отсутствие восстанавливающих веществ. Если в воде присутствуют органические примеси, раствор перманганата калия обесцвечивается: MnO4 + 5e + 8H = Mn + 4H2O
9. Микробиологическая чистота.
Вода очищенная должна контролироваться также на микробиологическую чистоту. Она должна соответствовать требованиям, предъявляемым к питьевой воде (Общее число аэробных микроорганизмов (бактерий и грибов) не более 100 КОЕ (колониеобразующие единицы) в 1 мл. Не допускается наличие Еscherichia coli, Staphylococcus aureus, Pseudomonas aeruginosa в 100 мл.). Испытание проводится в соответствии с ФС «Испытания на микробиологическую чистоту».
19.Химические методы количественного анализа. Гравиметрический метод количественного определения.
Химические методы разделяют на:
весовой анализ (гравиметрия)
– базируется на точном взвешивании;
объемный анализ (титрование)
– базируется на точном измерении.
Наибольшее значение имеют гравиметрический и титриметрический. Их называют классическими методами химического количественного анализа. Постепенно классические методы уступают свое место инструментальным. Однако они остаются самыми точными. Относительная погрешность этих методов всего 0,1-0,2%, а у инструментальных – 2-5%.
Титриметрический (объемный) анализ
Титриметрический количественный анализ – это точное измерение объема раствора реагента, который расходуется на эквивалентное взаимодействие с интересующим веществом. При этом концентрация используемого реагента устанавливается предварительно. Учитывая объем и концентрацию раствора реагента, рассчитывают содержание интересующего компонента. Название «титриметрический» происходит от слова «титр», которое обозначает один из способов выражения концентрации раствора. Титр показывает, сколько грамм вещества растворено в 1 мл раствора. Титрование – процесс постепенного доливания раствора с известной концентрацией к конкретному объему другого раствора. Его продолжают до момента, когда вещества прореагируют друг с другом полностью. Этот момент называют точкой эквивалентности и определяют по изменению окраски индикатора.
Методы титриметрического анализа:
Кислотно-основный.
Окислительно-восстановительный.
Осадительный.
Комплексонометрический.
Гравиметрия. Гравиметрический анализ (гравиметрия, весовой анализ) – это метод количественного химического анализа, основанный на точном измерении массы вещества. Использует закон сохранения массы веществ при химических превращениях. Аналитический сигнал в гравиметрии – масса.
Гравиметрический метод количественного определения
Методика количественного анализа гравиметрией включает следующие этапы проведения исследования:
1. Осаждение соединения, которое содержит интересующее вещество.
2. Фильтрование получившейся смеси для извлечения осадка от надосадочной жидкости.
3. Промывание осадка для устранения надосадочной жидкости и удаления с его поверхности примесей.
4. Высушивание при низких температурах для удаления воды или при высоких для перевода осадка в подходящую для взвешивания форму.
5. Взвешивание получившегося осадка.
6. Расчет результата гравиметрического анализа.
Осаждение осадка обычно проводят из горячих растворов, их высокая температура способствует образованию крупнокристаллического осадка. Раствор осадителя большей частью вливают небольшой струей, непрерывно помешивая. Фильтрование и промывание осадка – ф льтруют через бумажный фильтр, а так же через воронки с пористым дном. Промывание осадка проводят методом декантации. Высушивание осадка проводят в сушильном шкафу в бюксах (стеклянных колбах с крышкой). Прокаливание осадка – выполняют в фарфоровых тиглях, используя для этого муфельную печь. Прокаливание проводят несколько раз, пока масса осадка не станет постоянной. Взвешивание получившегося осадка производят на аналитических весах, которые представляют собой чувствительный физический прибор. Чтобы весы не портились и взвешивание давало точный результат, строго соблюдаются определенные правила. Определяемое вещество должно осаждаться практически полностью в виде малорастворимых осадков, осадки не должны содержать заметные количества примесей. Соединение, в виде которого определяемый компонент осаждается из раствора, называется формой осаждения.
Например, при осаждении железа (III) формой осаждения является Fe(OH)3, а при осаждении хлорида – AgCl FeCl3 + 3NH4OH → Fe(OH)3↓ + 3NH4Cl; AgNO3 + HCl → AgCl + HNO3.
После фильтрования и промывания осадок высушивают и прокаливают до постоянной массы, а затем взвешивают. Соединение, в виде которого производят взвешивание, называют гравиметрической формой. При высушивании и прокаливании осадков могут происходить химические процессы, например: 2Fe(OH)3 Fe2O3 + 3H2O. Таким образом, форма осаждения и гравиметрическая форма могут различаться по составу, а могут совпадать (например, в случае AgCl).
Гравиметрический анализ применяют для определения главных компонентов анализируемого материала, содержащихся в нем в больших и средних количествах. Гравиметрические методы наиболее надежны, но в настоящее время применяются редко. Недостатки гравиметрического метода количественного анализа – это длительность определения и неселективность (реагенты-осадители редко бывают специфичными). Поэтому необходимо предварительное разделение
20.Способы выражения концентрации титрованных растворов
Концентрация титрованного раствора обозначается терминами молярная, титр или титр по определяемому веществу.
Молярная концентрация (CМ) - это выраженное в молях количество растворенного вещества, содержащееся в одном литре раствора (моль/л).
Молярная концентрация эквивалента (CМ) (нормальная концентрация) – это число эквивалентов вещества в 1 л раствора (моль-экв/л).
Титр (Т) – это выраженная в граммах масса растворенного вещества, содержащаяся в одном миллилитре раствора. Титр вычисляют как отношение массы растворенного вещества к объему раствора (размерность г/мл).
Титр по определяемому веществу (титр соответствия, ТB/A) - это выраженная в граммах масса определяемого вещества, взаимодействующая с одним миллилитром данного титранта (размерность г/мл).
Титр по определяемому веществу вычисляют, исходя из молярности по формуле:
????????/???? = ???????? ???????? = ???????? ∗ Мэкв (????) 1000
Где: TB/A – титр раствора вещества B по веществу A, г/мл mA – масса вещества A, взаимодействующая с единицей объема титранта (B), г VB – объем раствора титранта (B), мл NB – молярная концентрация эквивалента титранта (B), моль- экв/л; Мэкв(A) – молярная масса эквивалента определяемого вещества (A), г- экв/моль
Молярная масса эквивалента вещества – масса одного моля эквивалента этого вещества, равную произведению фактора эквивалентности (fэкв) на молярную массу определяемого вещества (М).
Фактор эквивалентности (fэкв) – это число, обозначающее, какая доля молекулы вещества эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в окислительновосстановительной реакции.
21.Классификация титриметрических методов анализа.
Тетраметрические методы делятся:
1. В зависимости от способа титрования.
2. В зависимости от подхода к выполнению параллельных определений.
3. В зависимости от типа химической реакции, протекающей между веществами испытуемого и титрованного растворов.
3.1.В зависимости от способа титрования различают: прямое титрование, обратное титрование, косвенное (заместительное) титрование.