Файл: Научноисследовательская работа студентки 4 курса Направления подготовки 06. 03. 01 Биология Профиль Биохимия.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 04.12.2023
Просмотров: 197
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
Уравнения кривой оксигенации гемоглобина
Определение параметров взаимодействия гемоглобина с протонами водорода (эффект Бора)
Определение начальных условий для распределения кислорода в гемоглобине
ГЛАВА 2 МЕХАНИЗМЫ РЕГУЛЯЦИИ СВЯЗЫВАНИЯ ГЕМОГЛОБИНА С КИСЛОРОДОМ
2.1. Модельные представления, используемые для описания взаимодействия гемоглобина с кислородом
2.2. Свободная энергия системы гемоглобин – лиганды
2.3. Описание неравновесных процессов взаимодействия гемоглобина с кислородом
Роль гемоглобина как переносчика кислорода
Гемоглобин железосодержащий дыхательный пигмент крови позвоночных и многих беспозвоночных животных, осуществляющий перенос кислорода от органов дыхания к тканям организма. В крови позвоночных и некоторых беспозвоночных гемоглобин содержится внутри эритроцитов в растворенном состоянии.
Молекула гемоглобина позвоночных животных состоит из белка глобина и железосодержащей группы гема. В состав гема входят четыре протопорфириновых кольца, каждое из которых содержит атом двухвалентного железа. Молекулярный вес гемоглобина 66 00068 000. Физиологическая функция гемоглобина как переносчика кислорода основана на его способности обратимо связывать кислород в зависимости от концентрации последнего в крови. В присутствии кислорода железо гема связывает одну молекулу кислорода, при этом гемоглобин превращается в оксигемоглобин. При взаимодействии гемоглобина с окисью углерода (например, при отравлении этим газом) образуется более стабильный комплекс карбоксигемоглобин.
Продуктами распада гемоглобина являются многочисленные железопорфириновые комплексы. При этом происходит полное отделение гема от белка (хромопротеида); это отделение протекает с превращением железа в трехвалентную форму. Получаемый железопротопорфирин называется гемином, а его соединения – геминодериватами (рисунок 3).
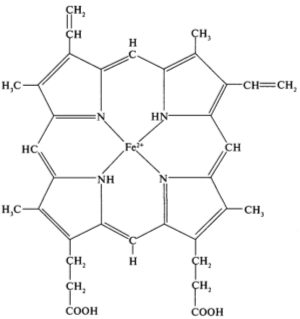
Рисунок 3 Структура гема гемоглобина
Молекула гемоглобина состоит из четырех субъединиц: двух α и двух β и соответственно содержит четыре полипептидные цепочки двух сортов. Каждая α-цепочка содержит 141, а β-цепочка 146 аминокислотных остатков. Таким образом, вся молекула гемоглобина включает 574 аминокислоты. Хотя аминокислотные последовательности αи β-цепочек различны, они имеют практически одинаковые третичные пространственные структуры. Собственно говоря, приведенные выше детали структуры относятся не к гемоглобину, а к его белковой компоненте глобину. Каждая субъединица гемоглобина содержит одну небелковую (так называемую простетическую) группу гем. Гем представляет собой комплекс Fe(II) с протопорфирином. Структура гемма представлена на рисунке 2.
Группировка гема представляет собой сложную копланарную циклическую систему, состоящую из центрального атома, который образует координационные связи с четырьмя остатками пиррола, соединенными метановыми мостиками (= СН -). В гемоглобине железо обычно находится в состоянии окисления (2+).
Четыре субъединицы две α и две β соединяются в единую структуру таким образом, что α -субъединицы контактируют только с β -субъединицами и наоборот, как показано на рисунке 4.
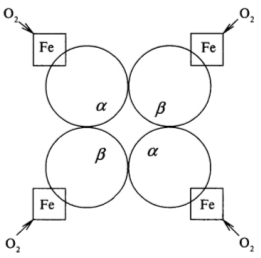
Рисунок 4 Схематичное изображение четвертичной структуры гемоглобина: Fe гем гемоглобина
Как видно из рисунка 4, одна молекула гемоглобина способна переносить 4 молекулы кислорода. И связывание, и освобождение кислорода сопровождается конформационными изменениями структуры α иβ -субъединиц гемоглобина и их взаимного расположения в эпимолекуле. Этот факт свидетельствует о том, что четвертичная структура белка не является абсолютно жесткой.
Атом железа может образовать шесть координационных связей. Четыре связи направлены к атомам азота пиррольных колец, оставшиеся две связи перпендикулярно к плоскости порфиринового кольца по обе его стороны. Гемы расположены вблизи поверхности белковой глобулы в специальных карманах, образованных складками полипептидных цепочек глобина. Гемоглобин при нормальном функционировании может находиться в одной из трех форм: феррогемоглобин (обычно называемый дезоксигемоглобином или просто гемоглобином), оксигемоглобин и ферригемоглобин (называемый также метгемоглобином). В феррогемоглобине железо находится в закисной форме Fe(II), одна из двух связей, перпендикулярных к плоскости порфиринового кольца, направлена к атому азота гистидинового остатка, а вторая связь свободна. Кроме этого гистидинового остатка, называемого проксимальным (соседним), по другую сторону порфиринового кольца и на большем расстоянии от него находится другой гистидиновый остаток дистальный гистидин, не связанный непосредственно с атомом железа. Взаимодействие молекулярного кислорода со свободным гемом приводит к необратимому окислению атома железа гемма [Fe(II) → Fe(III); гем → гемин]. В дезоксигемоглобине глобин предохраняет железо от окисления.
Обратимое присоединение кислорода (оксигенация), позволяющее гемоглобину выполнять свою основную функцию переносчика, обеспечивается возможностью образовать прочные пятую и шестую координационные связи и перенести электрон на кислород не от железа (то есть окислить Fe2+), а от имидазольного кольца проксимального гистидина.
Для связывания кислорода с гемоглобином характерна кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. В этом проявляется так называемый аллостерический эффект [15].
Стоит заметить, что лазерное излучение оказывает влияние на процесс оксигенации гемоглобина. Авторы работы [16] измеряли величину насыщения артериальной крови кислородом первой фаланги пальца с помощью высокочувствительного быстродействующего пульсоксиметра. Третью фалангу пальца подвергали облучению He-Ne лазера (20 мВт).
На рисунке 5 представлено изменение величины насыщения артериальной крови кислородом при воздействии лазерного излучением.
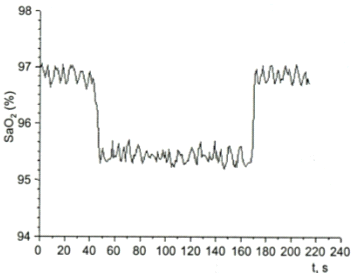
Рисунок 5 Влияние лазерного излучения на насыщение артериальной крови кислородом
На кривые насыщения регистрируются изменения от дыхательных циклов: 40 секунд начало воздействия, 170 секунд окончание. Снижение насыщения гемоглобина синхронное с воздействием, демонстрирует дополнительное освобождение кислорода в результате фотодиссоциации гемоглобина. Это не может быть связано с улучшением микроциркуляции. Все происходит слишком быстро и синхронно. Таким образом, это значит, что низкоинтенсивное лазерное облучение высвобождает кислород в месте облучения. Авторы говорят о лазерно-индуцированной оксигенации тканей. Речь идет о селективном повышении локальной концентрации кислорода в тканях. Авторы объясняют этот эффект сдвигом кривой диссоциации оксигемоглобина. И обосновывают это совпадением спектра поглощения гемоглобина и оксигемоглобина с длиной волны He-Ne лазера. То есть, по мнению авторов, оксигемоглобин является акцептором фотона.
Большой интерес для исследователей представляют особенности поведения молекул газов (лигандов) в гемовом кармане гемоглобина и миоглобина. В работе [16] рассмотрены механизмы диффузии лигандов в миоглобине, строение которого очень сходно со строением β-субъединицы молекулы гемоглобина.
Результат расчетов Д. Кейза и М. Карплюса в 1979 году оказался по тем временам несколько неожиданным. Выяснилось, что скорость диффузии лиганда в белке чрезвычайно чувствительна к виду межатомных потенциалов взаимодействия, определяющих конформационную подвижность. Конформационная подвижность обусловлена возможностью вращения молекулярных групп вокруг одинарных С-С-связей [17]. В вакууме при повороте на полный угол преодолеваются обычно три потенциальных барьера высотой
2-4 ккал/моль. В плотноупакованной белковой глобуле эти вращения сильно заторможены из-за стерических препятствий, и, казалось бы, ими можно пренебречь и рассматривать только небольшие колебания атомов около локальных положений равновесия. Расчет динамики связывания лиганда с миоглобином показал, что в этом случае энергия активации диффузии составляет
100т ккал/моль, что примерно в 10 раз больше экспериментальной величины, и процесс при комнатных температурах практически заморожен. Этот результат полностью опроверг представление о белковой глобуле как об апериодическом микрокристаллике. Оказалось, что включение в расчет конформационных степеней свободы совершенно принципиально для белков и снижает энергию активации диффузии лиганда до приемлемого значения
10 ккал/моль. Более того, оказалось, что в структуре миоглобина можно выделить два канала для проникновения лиганда из раствора в гемовый карман. Эти каналы работают с вероятностью около 60 и 40% соответственно и по своей структуре представляют систему флуктуационно открывающихся щелей (дверей), образованных аминокислотными остатками. На рисунке 5 схематически показан путь миграции СО в молекуле гемоглобина из гемового кармана параллельно гемовой плоскости через участок альфа-спирали Е по наиболее эффективному каналу. Молекула СО сначала преодолевает участок между гистидином HisE7 и валином ValEll, а затем между HisE7 и треонином ThrElo с дальнейшим выходом в растворитель (рисунок 6).
Роль гемоглобина как переносчика кислорода
Гемоглобин железосодержащий дыхательный пигмент крови позвоночных и многих беспозвоночных животных, осуществляющий перенос кислорода от органов дыхания к тканям организма. В крови позвоночных и некоторых беспозвоночных гемоглобин содержится внутри эритроцитов в растворенном состоянии.
Молекула гемоглобина позвоночных животных состоит из белка глобина и железосодержащей группы гема. В состав гема входят четыре протопорфириновых кольца, каждое из которых содержит атом двухвалентного железа. Молекулярный вес гемоглобина 66 00068 000. Физиологическая функция гемоглобина как переносчика кислорода основана на его способности обратимо связывать кислород в зависимости от концентрации последнего в крови. В присутствии кислорода железо гема связывает одну молекулу кислорода, при этом гемоглобин превращается в оксигемоглобин. При взаимодействии гемоглобина с окисью углерода (например, при отравлении этим газом) образуется более стабильный комплекс карбоксигемоглобин.
Продуктами распада гемоглобина являются многочисленные железопорфириновые комплексы. При этом происходит полное отделение гема от белка (хромопротеида); это отделение протекает с превращением железа в трехвалентную форму. Получаемый железопротопорфирин называется гемином, а его соединения – геминодериватами (рисунок 3).

Рисунок 3 Структура гема гемоглобина
Молекула гемоглобина состоит из четырех субъединиц: двух α и двух β и соответственно содержит четыре полипептидные цепочки двух сортов. Каждая α-цепочка содержит 141, а β-цепочка 146 аминокислотных остатков. Таким образом, вся молекула гемоглобина включает 574 аминокислоты. Хотя аминокислотные последовательности αи β-цепочек различны, они имеют практически одинаковые третичные пространственные структуры. Собственно говоря, приведенные выше детали структуры относятся не к гемоглобину, а к его белковой компоненте глобину. Каждая субъединица гемоглобина содержит одну небелковую (так называемую простетическую) группу гем. Гем представляет собой комплекс Fe(II) с протопорфирином. Структура гемма представлена на рисунке 2.
Группировка гема представляет собой сложную копланарную циклическую систему, состоящую из центрального атома, который образует координационные связи с четырьмя остатками пиррола, соединенными метановыми мостиками (= СН -). В гемоглобине железо обычно находится в состоянии окисления (2+).
Четыре субъединицы две α и две β соединяются в единую структуру таким образом, что α -субъединицы контактируют только с β -субъединицами и наоборот, как показано на рисунке 4.

Рисунок 4 Схематичное изображение четвертичной структуры гемоглобина: Fe гем гемоглобина
Как видно из рисунка 4, одна молекула гемоглобина способна переносить 4 молекулы кислорода. И связывание, и освобождение кислорода сопровождается конформационными изменениями структуры α иβ -субъединиц гемоглобина и их взаимного расположения в эпимолекуле. Этот факт свидетельствует о том, что четвертичная структура белка не является абсолютно жесткой.
Атом железа может образовать шесть координационных связей. Четыре связи направлены к атомам азота пиррольных колец, оставшиеся две связи перпендикулярно к плоскости порфиринового кольца по обе его стороны. Гемы расположены вблизи поверхности белковой глобулы в специальных карманах, образованных складками полипептидных цепочек глобина. Гемоглобин при нормальном функционировании может находиться в одной из трех форм: феррогемоглобин (обычно называемый дезоксигемоглобином или просто гемоглобином), оксигемоглобин и ферригемоглобин (называемый также метгемоглобином). В феррогемоглобине железо находится в закисной форме Fe(II), одна из двух связей, перпендикулярных к плоскости порфиринового кольца, направлена к атому азота гистидинового остатка, а вторая связь свободна. Кроме этого гистидинового остатка, называемого проксимальным (соседним), по другую сторону порфиринового кольца и на большем расстоянии от него находится другой гистидиновый остаток дистальный гистидин, не связанный непосредственно с атомом железа. Взаимодействие молекулярного кислорода со свободным гемом приводит к необратимому окислению атома железа гемма [Fe(II) → Fe(III); гем → гемин]. В дезоксигемоглобине глобин предохраняет железо от окисления.
Обратимое присоединение кислорода (оксигенация), позволяющее гемоглобину выполнять свою основную функцию переносчика, обеспечивается возможностью образовать прочные пятую и шестую координационные связи и перенести электрон на кислород не от железа (то есть окислить Fe2+), а от имидазольного кольца проксимального гистидина.
Для связывания кислорода с гемоглобином характерна кооперативность: после присоединения первой молекулы кислорода связывание последующих облегчается. В этом проявляется так называемый аллостерический эффект [15].
Стоит заметить, что лазерное излучение оказывает влияние на процесс оксигенации гемоглобина. Авторы работы [16] измеряли величину насыщения артериальной крови кислородом первой фаланги пальца с помощью высокочувствительного быстродействующего пульсоксиметра. Третью фалангу пальца подвергали облучению He-Ne лазера (20 мВт).
На рисунке 5 представлено изменение величины насыщения артериальной крови кислородом при воздействии лазерного излучением.

Рисунок 5 Влияние лазерного излучения на насыщение артериальной крови кислородом
На кривые насыщения регистрируются изменения от дыхательных циклов: 40 секунд начало воздействия, 170 секунд окончание. Снижение насыщения гемоглобина синхронное с воздействием, демонстрирует дополнительное освобождение кислорода в результате фотодиссоциации гемоглобина. Это не может быть связано с улучшением микроциркуляции. Все происходит слишком быстро и синхронно. Таким образом, это значит, что низкоинтенсивное лазерное облучение высвобождает кислород в месте облучения. Авторы говорят о лазерно-индуцированной оксигенации тканей. Речь идет о селективном повышении локальной концентрации кислорода в тканях. Авторы объясняют этот эффект сдвигом кривой диссоциации оксигемоглобина. И обосновывают это совпадением спектра поглощения гемоглобина и оксигемоглобина с длиной волны He-Ne лазера. То есть, по мнению авторов, оксигемоглобин является акцептором фотона.
Большой интерес для исследователей представляют особенности поведения молекул газов (лигандов) в гемовом кармане гемоглобина и миоглобина. В работе [16] рассмотрены механизмы диффузии лигандов в миоглобине, строение которого очень сходно со строением β-субъединицы молекулы гемоглобина.
Результат расчетов Д. Кейза и М. Карплюса в 1979 году оказался по тем временам несколько неожиданным. Выяснилось, что скорость диффузии лиганда в белке чрезвычайно чувствительна к виду межатомных потенциалов взаимодействия, определяющих конформационную подвижность. Конформационная подвижность обусловлена возможностью вращения молекулярных групп вокруг одинарных С-С-связей [17]. В вакууме при повороте на полный угол преодолеваются обычно три потенциальных барьера высотой
2-4 ккал/моль. В плотноупакованной белковой глобуле эти вращения сильно заторможены из-за стерических препятствий, и, казалось бы, ими можно пренебречь и рассматривать только небольшие колебания атомов около локальных положений равновесия. Расчет динамики связывания лиганда с миоглобином показал, что в этом случае энергия активации диффузии составляет 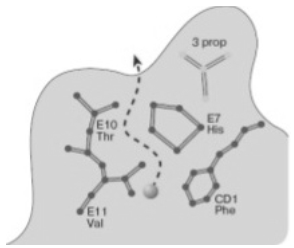
Рисунок 6 Схематическое изображение одного из каналов для диффузии лиганда в миоглобине
На рисунке 6 шариком указано место расположения связанного СО в гемовом кармане. Пунктир показывает путь выхода лиганда в растворитель. Плоскость рисунка параллельна гемовой плоскости и находится над ней на расстоянии 3,2 Ȧ. Обозначены положения аминокислотных остатков с указанием спирального участка и номера остатка в спирали (HisE7, ValE11, ThrE10); положение первого аминокислотного остатка в неспирализованном участке, соединяющем спирали С и D (CD1Phe); участок одной из пропионатных боковых цепей, присоединенных к молекуле гемма (3 prop) (рисунок 7).
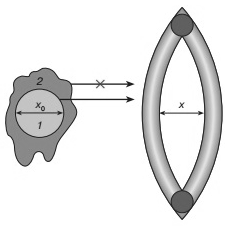
Рисунок 7 Модель диффузии в структурированной среде (белке)
При раскрытии флуктуационной щели на величину х>x0 субстрат 1 может диффундировать сквозь щель. Диффузия субстрата 2 сильно затруднена, так как требуется большая деформация щели (большая энергия активации).
Рисунок 7 иллюстрирует общую схему процесса диффузии через флуктуирующую щель, образованную элементами структуры белковой глобулы. Суть состоит в том, что для акта диффузии необходимо, чтобы просвет во флуктуирующей щели был не меньше, чем ванн-дер-ваальсов размер лиганда. Энергия активации диффузии при этом будет определяться соответствующей энергией раскрытия щели. В жидкостях на форму флуктуационной полости или дырки практически не накладывается существенных ограничений. В белковой глобуле это не так. Здесь имеется относительно жесткий упругий каркас, образованный спиральными элементами структуры. Подвижные боковые группы обеспечивают формирование дырки для диффузионного проникновения лиганда. Но форма этой дырки или щели диктуется локальной геометрией белковой структуры. В твердых телах геометрические ограничения еще более жесткие, но в этом случае в отличие от белка нет подвижных боковых групп, обеспечивающих раскрытие щелей с приемлемой энергией активации. Таким образом, белковая глобула представляет собой структурированную среду, в которой подвижная часть похожа на вязкую жидкость
, но возможные формы флуктуационных полостей и щелей ограничены упругим каркасом [19]. Проникновение внутрь белковой глобулы молекул (лигандов), геометрия которых не соответствует этим формам, будет сильно затруднено, так как потребует более широкого раскрытия щелей и соответственно значительно большей энергии активации. На этом этапе с точки зрения физики и закладываются основы стереоспецифичности биохимических процессов.
- 1 2 3 4 5 6 7 8 9 10
Уравнения кривой оксигенации гемоглобина
Кривая оксигенации гемоглобина. Если использовать принятую в физической химии терминологию, то кривая оксигенации гемоглобина демонстрирует количественные отношения между величиной парциального давления кислорода над кровью и количеством кислорода, Ц которое связывается гемоглобином при данном парциальном давлении газа [4]. С физиологической точки зрения кривая оксигенации гемоглобина ключ к пониманию процесса транспорта кислорода от легких к крови и от крови к тканям. Эта кривая заключает в себе огромный объем f информации.
Оксигенация гемоглобина — это процесс присоединения кислорода к гемоглобину. Обратный процесс — отсоединение кислорода от гемоглобина называется диссоциацией оксигемоглобина. В состоянии равновесия эти две реакции являются обратимыми и имеют одинаковые скорости. Поэтому для состояния термодинамического равновесия выражения «кривая оксигенации гемоглобина», «кривая оксигенации оксигемоглобина», «равновесная кривая оксигенации» эквивалентны. В литературе используют все эти выражения, но для сокращенной записи наиболее распространено обозначение КДО — кривая оксигенации оксигемоглобина.
Уравнение Гюфнера. Одна из самых первых работ по математическому описанию экспериментальных данных кривой оксигенации гемоглобина. Гюфнер предположил, что при оксигенации гемоглобина происходит реакция первого порядка [6].
Применяя закон действующих масс, Гюфнер получил выражение для описания равновесной кривой оксигенации гемоглобина: НЬ02 =±Р_ (1А2) НЪ + НЪ02 \ + к-р v где у степень насыщения гемоглобина кислородом; р — парциальное давление кислорода; к=— константа равновесной реакции оксигенации гемоглобина; a,fiкинетические коэффициенты.
Основным недостатком данного описания является то, что уравнение неспособно описать S образный характер кривой гемоглобина человека.
Уравнение Хилла. Хилл предложил считать молекулу гемоглобина полимерной молекулой, степень полимеризации которой равна h [7]. При этом он считал, что к молекуле гемоглобина могут одновременно присоединяться все h молекул кислорода: (Hb)h + НОг aJt (Hb02)h, (1.4.3) т. е. в растворе происходит химическая реакция к го порядка. При помощи закона действующих масс Хилл получил уравнение равновесной кривой оксигенации гемоглобина: .к-р" (pfPsJ П44Ї где k=alft = plb\ /730давление кислорода при у = 50%.
Уравнение Хилла в отличие от уравнения Гюфнера описывало S образную форму кривой оксигенации гемоглобина, но при этом значение степени полимеризации h оказывалось величиной дробной и зависящей от парциального давления кислорода в растворе. При дальнейших исследованиях было установлено, что взаимодействие гемоглобина с кислородом не является химической реакцией h — го порядка. В связи с этим уравнение Хилла утратило свой физический смысл, но оно довольно широко используется до сих пор в качестве простой аппроксимации кривой оксигенации.
Уравнение Эйдера. В связи с открытием того, что в молекуле гемоглобина содержатся четыре активных центра, Эйдер выдвинул гипотезу о последовательном четырехступенчатом заполнении гемоглобина кислородом [9]. Согласно ей насыщение гемоглобина кислородом последовательно проходит четыре стадии: коэффициенты Эйдера; ki=ailfii (/ = 1,4) равновесные константы реакции. Уравнение Бернарда. Бернард взял за основу предположение Ваймана Алена [2] о том, что к молекуле гемоглобина могут одновременно присоединяться две молекулы кислорода [2]. В результате он получил следующее уравнение кривой оксигенации:
Уравнение Высочиной. Высочина считала, что реакцию оксигенации гемоглобина нельзя считать равновесным процессом, следовательно, к ней нельзя применять закон действующих масс [22]. Поэтому она, используя выражение для переходного процесса, получила уравнение: = 1-11+ + 1+ 1 . (1.4.9)
В дальнейшем это уравнение было исследовано в работе [3], в которой автор показал, что параметр Ъ не является постоянной величиной, а зависит от давления.
Уравнение Подрабинека Каменского. Подрабинек и Каменский предположили, что процесс взаимодействия гемоглобина с кислородом является реакцией первого порядка. При этом константа равновесной реакции пропорциональна степени деформации молекулы, которая в свою очередь экспоненциально зависит от давления кислорода [24].
-
Метод неопределенных множителей Лагранжа. Законы сохранения
Для подтверждения термодинамической модели взаимодействия гемоглобина с кислородом, полученной в предыдущей главе, и нахождения параметров рассмотрим экспериментальные данные по стандартной кривой оксигенации гемоглобина.