ВУЗ: Казахский национальный медицинский университет им. С.Д. Асфендиярова
Категория: Шпаргалка
Дисциплина: Химия
Добавлен: 05.02.2019
Просмотров: 12579
Скачиваний: 45
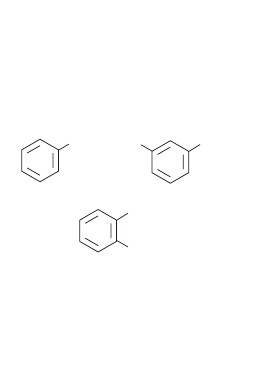
го кольца, и производные, в которых NO
2
группа на
ходится в боковой цепи):
физические свойства. Нитросоединения — жид
кие или твердые вещества, малорастворимые в воде,
растворяются в органических растворителях. Поли
нитросоединения — желтые кристаллические вещес
тва. Соединения, содержащие несколько нитрогрупп,
при нагревании или детонации разлагаются со взры
вом. Некоторые ароматические нитросоединения
имеют запах горького миндаля.
2-нитротолуол
CH
3
NO
2
алифатические
CH
3
—CH
2
—NO
2
CH
3
—CH
2
—CH
2
—NO
2
нитрометан
нитроэтан
1-нитропропан
ароматические
NO
2
NO
2
O
2
N
NO
2
СН
3
нитробензол
1,3-динитробензол
154. пОлучение нитрОсОединений
получение алифатических нитросоединений.
1. нитрование углеводородов действием разбав
ленной HNO
3
при повышенной температуре (реакция
коновалова) либо HNO
3
или N
2
O
4
в газовой фазе:
2. взаимодействие алкилгалогенидов с нитри-
тами металлов (нитрит серебра в неполярных рас
творителях (эфир, гексан) или с нитрит натрия в ди
метилформамиде HC(O)N(CH
3
)
2
или в диметилсуль
фоксиде (CH
3
)
2
SO
4
) образуются нитроалканы:
RX + AgNO
2
(NaNO
2
) → RNO
2
+ AgX (NaX),
где X = Cl, Br.
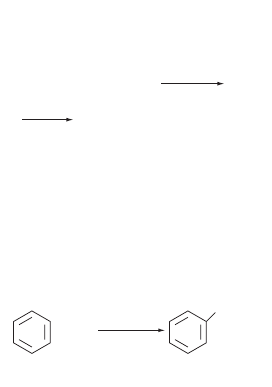
получение ароматических нитросоединений.
Нитрование бензола и его производных действием
нитрующих смесей (смеси HNO
3конц
и H
2
SO
4конц
).
Дальнейшее нитрование — введение еще одной или
двух нитрогрупп — необходимо проводить при темпе
ратурах выше 100 °С%
H2SO4, 30 °C
+ HNO3
+ H2O
NO2
бензол
нитробензол
азотная
кислота
2-нитропропан
СH
3
—CH
2
—CH
3
+ HNO
3
CH
3
—CH(NO
2
)—CH
3
+ H
3
O
110–140 °C
пропан
азотная кислота
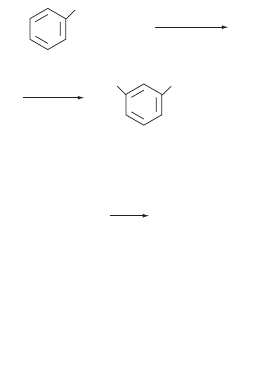
H2SO4, 60 °C
+ HNO
3
+ H
2
O
NO
2
NO
2
O
2
N
нитробензол
1,3-динитробензол
Для введения нитрогруппы в боковую цепь исполь
зуют метод коновалова — нагревание ароматичес
кого соединения с разбавленной HNO
3
:
фенилнитрометан
C
6
H
5
CH
3
+ HNO
3
C
6
H
5
CH
2
NO
2
толуол

155. химические свОйства
алифатических нитрОсОединений
1. восстановление (при действии восстановите
лей (LiAlH
4
, NaBH
4
)) или гидрирование (в присут
ствии катализатора Ni) нитросоединения превраща
ются в первичные амины.
2. действие щелочей. Первичные и вторичные
нитросоединения растворяются в водных щелочах с
образованием солей, так как нитрогруппа, будучи
сильным электроноакцептором, повышает подвиж
ность атомов водорода у соседнего с нитрогруппой
атома углерода.
В щелочной среде первичные и вторичные нитросо
единения способны таутомерно переходить в кислот
ную форму, так называемую ацинитроформу:
Таутомерное равновесие очень сильно смещено в
сторону нитроформы, т.е. влево.
Нитросоединения относят к псевдокислотам — ней
тральным соединениям, способным образовывать соли.
3. реакции, связанные с подвижностью
a-атомов водорода, характерны только для первич
ных и вторичных нитроалканов:
а) в присутствии оснований нитроалканы конденси
руются с альдегидами с образованием нитроспиртов
(реакция Анри);
б) с HNO
2
первичные нитроалканы образуют нитро
ловые кислоты.
RCH
2
N+OO
–
RCH=N+O
–
OH

Вторичные нитросоединения при реакции с HNO
2
образуют псевдонитролы:
4. реакции с минеральными кислотами. При на
гревании первичных нитроалканов с минеральными
кислотами образуются карбоновые кислоты и соли
гидроксиламина.
При обработке солей первичных или вторичных
нитросоединений разбавленными минеральными
кислотами образуются альдегиды или кетоны соот
ветственно (реакция Нэфа).
псевдонитролы
RCH(R
1
)NO
2
+ HNO
2
RC(R
1
)(N=O)NO
2
+ H
2
O