ВУЗ: Казахский национальный медицинский университет им. С.Д. Асфендиярова
Категория: Шпаргалка
Дисциплина: Химия
Добавлен: 05.02.2019
Просмотров: 12574
Скачиваний: 45
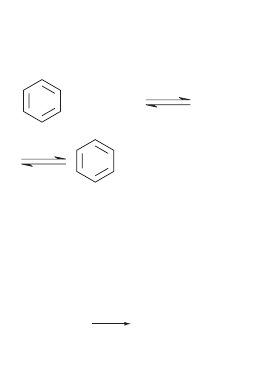
156. химические свОйства
арОматических нитрОсОединений
1. взаимодействие со щелочами.
Нитросоединения с нитрогруппой в боковой цепи
по химическим свойствам похожи на алифатические
нитросоединения:
2. реакции электрофильного замещения.
Нитробензол и его производные труднее, чем бен
зол и соответствующие производные, вступают в ре
акции электрофильного замещения, а электрофиль
ные реагенты атакуют бензольное кольцо в мполо
жение по отношению к нитрогруппе (заместитель
второго рода).
3. восстановление:
а) превращение нитробензола в соответствующий
амин — анилин (Н.Н. Зининым):
NaOH
Н
2
—С—N
+
—С=N
+
Н
=
—
O
O–
—
—
ONa
O–
Н+
+ Н
2
O
анилин
C
6
H
5
NO
2
C
6
H
5
NH
2
нитробензол

б) в нейтральных растворах при действии Zn в вод
ном растворе хлорида аммония нитросоединения
превращаются в производные гидроксиламина;
в) при действии оксида мышьяка (As
2
O
3
) в щелоч
ной среде нитросоединения превращаются в азоксисо
единения;
г) при восстановлении нитросоединений Zn в спир
товом растворе едкого натра образуются азоксисо
единения. Азоксисоединения — желтые кристалли
ческие вещества, не растворимые в воде, образуются
при окислении азосоединений. Азоксисоединения
можно восстановить в азосоединения. Азосоедине
ния можно окислить в азоксисоединения;
д) гидразосоединения — образуются при обработ
ке нитропроизводных гидразином (Н
2
NNН
2
) в присут
ствии катализатора в щелочной среде.
Нитросоединения, азоксисоединения, азосоединения
и гидразосоединения можно восстановить до соответ
ствующих аминов в присутствии катализаторов (As
2
O
3
,
Na
2
SnO
2
).
С помощью сульфида аммония (образуется в ре
акционной среде из аммиака и сероводорода) можно
восстановить одну нитрогруппу из двух, имеющихся
в соединении.

157. Общая характеристика,
физические свОйства и пОлучение
диазО- и азОсОединений
Диазосоединения ароматического ряда имеют об
щую формулу ArN
2
+
X
–
, где Аr — ароматический ради
кал; X — анион сильной кислоты (HSO
4
–
, Cl
–
, ClO
4
–
) или
ковалентносвязанная группа, например гидроксиль
ная; N
2
— группировка, связанная с ароматическим
радикалом и неорганическим остатком.
Азосоединения ароматического ряда имеют общую
формулу ArN=NAr
1
, где Аr и Аr
1
— одинаковые или
разные ароматические радикалы.
физические свойства.
Большинство солей арил
диазониев растворимо в воде, водные растворы их
имеют нейтральную реакцию. Сами соли — кристал
лические соединения, обычно неустойчивые в сухом
виде (могут разлагаться со взрывом). Поэтому с со
лями арилдиазониев работают, как правило, в рас
творах и редко выделяют в чистом виде.
реакция диазотирования. Диазосоединения по
лучают обработкой первичных ароматических аминов
водным раствором NaNO
2
в присутствии избытка силь
ной кислоты при 0–5 °С.
Генератор катиона нитрозония
+
NO (электрофиль
ный реагент) — HNO
2
(неустойчивое соединение, в
свободном виде не существует). Поэтому HNO
2
полу
чают из NaNO
2
действием сильной кислоты в водном
растворе, и она сразу начинает процесс диазотиро
вания:
Общая схема реакции:
где Аr — ароматический радикал; X = Cl, Br, H
2
SO
4
,
NO
3
, BF
4
.
Образующиеся соли диазония неустойчивы и легко
разрушаются водой, поэтому реакцию диазотирова
ния проводят при низких температурах (0–10 °С), а
получающиеся диазосоединения используют немед
ленно после получения.
Диазосоединения при различных рН среды претер
певают следующие превращения:
катион нитрозония
NaNO
2
+ H+
HO—N=O + H+
H
2
O+—N=O
[N=O]+ + Na+ + H
2
O
–Na+ азотистая кислота
ArN
2
+X– + NaX + 2H
2
O
ArNH
2
+ NaNO
2
+ 2НХ
диазотаты
рН > 7
[ArN≡N]+X–
[ArN≡N]+OH–
ArN=N—OH
Ar—N=NO–
соли
арилдиазониев
рН < 7
гидроксиды
арилдиазониев
рН ~ 7
диазокислоты
рН ~ 7

158. химические свОйства диазО-
и азОсОединений: реакции,
прОтекаЮщие с выделением азОта
I. реакции, протекающие с выделением азота.
Соли арилдиазониев — высокореакционные вещест
ва, могут распадаться как гетеролитическим (гетеро
лиз), так и гомолитическим (гомолиз) путем.
1. замещение диазогруппы на водород при
действии на соли арилдиазониев восстановителями
(станнит натрия или фосфорноватистая кислота).
2. замещение диазогруппы на галоген. Реакция
позволяет получать ароматические фторпроизвод
ные (реакция Шимана).
Замену диазогруппы на хлор или бром можно осу
ществить либо реакцией Зандмейера (нагреванием
солей арилдиазониев с однохлористой или однобро
мистой медью в присутствии соответствующей гало
геноводородной кислоты), либо реакцией Гаттер-
мана (нагреванием солей арилдиазониев с порошко
образной медью в присутствии соответствующего
галогеноводорода).
Иодопроизводные образуются при обработке солей
арилдиазониев йодистоводородной кислотой (вод
ным раствором KI):
ArN+≡NСl– + KI ArI + KCl
3. замещение диазогруппы на гидроксильную
группу. Соли диазония даже при 0—10°С медленно
реагирую с водой, превращаясь в фенолы, поэтому
их следует использовать сразу после получения.
4. замещение диазогруппы на циангруппу дей
ствием на соль арилдиазония цианидом одновалент
ной меди; получаются нитрилы ароматических кис
лот. Реакцию проводят с нейтральными растворами
солей арилдиазониев для избежания образования