Добавлен: 12.12.2023
Просмотров: 172
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Для испытания на подлинность кислоты глютаминовой используют цветную реакцию с нингидрином. В результате реакции образуется аммонийная соль енольной формы, имеющая сине-фиолетовую окраску.
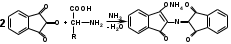
С солями меди кислота глютаминовая образует комплексные соединения темно-синего цвета:
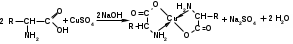
Количественное определение глютаминовой кислоты можно проводить методом Кьельдаля. Вначале проводят минерализацию с концентрированной серной кислотой:
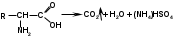
Затем добавляют раствор гидроксида натрия и отгоняют образующийся аммиак в приемник с борной кислотой:
(NH4)HSO4 + 2NaOH → NH3 + Na2SO4 + 2H2O
B(OH)3 + H2O → H[B(OH)4]
NH3 + H[B(OH)4] → NH4[B(OH)4]
Образующийся тетрагидроксиборат аммония оттитровывают хлористоводородной кислотой:
NH4[B(OH)4] + HCl → NH4Cl + B(OH)3 + H2O Кислоту глютаминовую можно определять алкалиметрическим методом. Титруют 0,1 М раствором гидроксида натрия с индикатором бромтимоловым синим. Титрант нейтрализует карбоксильную группу в γ-положении:
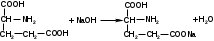
Возможно фотоколориметрическое определение глютаминовой кислоты, основанное на образовании окрашенных продуктов реакции с нингидрином.
Аминокислоты хранят в хорошо укуп таре,в сухом защищ от света месте,чтобы не допустить разложения.
Пирацетам СП Б.
З
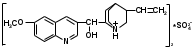 адача№6
адача№6Хинина сульфат
Chinini sulfas
6-метоксихинолил-(4)-[5-винилхинуклидил-(2)]-карбинола сульфат
С
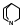
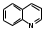 труктурной основой хинина служат две гетероциклические системы: хинолин (конденсированная система пиридина и бензола) и хинуклидин (конденсированная система двух пиперидиновых циклов):
труктурной основой хинина служат две гетероциклические системы: хинолин (конденсированная система пиридина и бензола) и хинуклидин (конденсированная система двух пиперидиновых циклов):хинол хинуклидин
В молекуле хинина эти два цикла связаны между собой карбинольной группой – CH(OH) –.
В молекуле хинина содержится несколько хиральных центров, обусловливающих оптическую изомерию. Хинина сульфат является левовращающим изомером.
Хинина сульфат представляет собой двукислотное основание, обусловленное наличием в его молекуле двух атомов азота. Бесцв игольчатые кристаллы.
Качественной реакцией на хинина сульфат является «талейохинная проба». Она заключается в окислении хинина бромной водой с образованием орто-хинона. Последующее действие раствором аммиака приводит к образованию дииминопроизводных орто-хиноидной структуры, окрашенных в изумрудно-зеленый цвет:
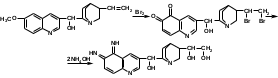 талейохинин
талейохининК общим реакциям идентификации хинина сульфата относятся реакции на третичную аминогруппу (хинолиновый и хинуклидиновый циклы) с осадительными общеалкалоидными реактивами – пикриновой кислотой, фосфорновольфрамовой кислотой, с раствором йода в кислой среде.
Раствор хинина сульфата в серной кислоте имеет голубую флуоресценцию.
Для количественного определения хинина сульфата в субстанции можно использовать гравиметрический метод после осаждения гидроксидом натрия основания, извлечения его хлороформом и взвешивания высушенного осадка.
[R≡N]2∙H2SO4 + 2NaOH → 2R≡N↓ + Na2SO4 + 2H2O
Кроме того, можно использовать общий метод титрования слабых азотистых оснований в среде неводных растворителей (смесь уксусной кислоты и уксусного ангидрида).
В лекарственных формах применяется алкалиметрическое титрование гидроксидом натрия (по кислотной части молекулы) в присутствии хлороформа (для извлечения выделившегося основания).
В лекарственных формах возможно использование спектрофотометрического метода.хранят в хор укуп таре предотвращ от действия света.
Задача№7
И
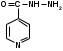 зониазид (МНН). Isoniazidum
зониазид (МНН). Isoniazidum(гидразид изоникотиновой кислоты)
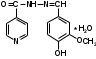
Фтивазид (МНН). Phthivazidum
(3-метокси-4-оксибензилиденгидразид изоникотиновой кислоты)
Наличие дополнительных хромофорных групп в молекуле фтивазида обусловливает различие УФ-спектров указанных веществ, что можно использовать для идентификации. Изониазид поглощает только в УФ-области оптического спектра, а фтивазид также в видимой области.
Остаток гидразидной группы обусловливает восстановительные свойства. Фтивазид, являясь гидразоном изоникотиновой кислоты, в растворах подвергается гидролитическому разложению, выделяя ванилин (реакция отличия от изониазида).
Групповой реакцией на пиридиновый цикл, содержащийся в лекарственных веществах, является образование глутаконового альдегида желтого цвета с 2,4-динитрохлорбензолом в спиртовой среде после добавления гидроксида калия:
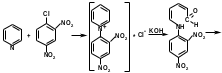
глутаконовый альдегид
Как и другие соединения третичного азота они образуют осадки с осадительными общеалкалоидными реактивами.
Восстановительные свойства изониазида подтверждают реакцией «серебряного зеркала»:
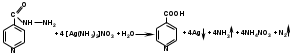
При нагревании фтивазида с хлористоводородной кислотой происходит гидролиз с образованием гидразина, изоникотиновой кислоты и ванилина, который обнаруживается по запаху:
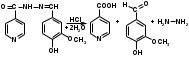
ванилин
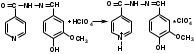
Для количественного определения фтивазида можно применять метод титрования в неводной среде (смесь ледяной уксусной кислоты и уксусного ангидрида):
Окислительно-восстановительные свойства изониазида используются при иодометрическом определении:
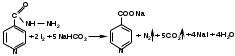
Для количественного определения в лекарственных формах возможно применение фотометрического метода и УФ-спектрофотометрии.
Задача№8
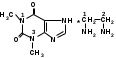
Эуфиллин. Euphyllinum. Аминофиллин (МНН)
1,3-диметилксантин с 1,2-этилендиамином.
По химическому строению относится к производным пурина, который состоит из двух гетероциклов: пиримидина и имидазола. Является двойной солью пуринового алкалоида теофиллина (1,3-диметилксантина) и этилендиамина. При неправильном хранении этилендиамин улетучивается, а оставшийся теофиллин мало растворим в воде. Благодаря этому испытуемый образец неполностью растворяется в воде для инъекций.
Обладает светопоглощением в УФ области оптического спектра.
Общей реакцией, рекомендуемой для испытания подлинности препаратов пуриновых алкалоидов и их солей, является мурексидная проба:
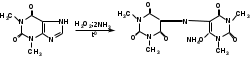
эуфиллин аммонийная соль тетраметил-
пурпуровой кислоты
Эуфиллин образует осадки с осадительными реактивами (раствором танина, раствором йода).
Отличительными реакциями на теофиллин, присутствующий в эуфиллине, является взаимодействие в щелочной среде с солями кобальта, серебра, т.к. наличие иона водорода имидной группы в положении 7 обусловливает кислотные свойства. С солями кобальта теофиллин образует белый с розоватым оттенком осадок:
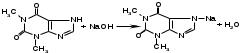
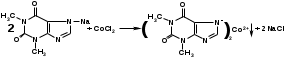
Аналогично образуется серебряная соль теофиллина, которая представляет полупрозрачный студенистый осадок.
Этилендиамин в эуфиллине (аминофиллине) открывают с помощью раствора сульфата меди (фиолетовое окрашивание).
Количественное определение теофиллина в эуфиллине выполняют после удаления этилендиамина путем нагревания методом заместительной (косвенной) нейтрализации – при добавлении раствора нитрата серебра. Выделившуюся азотную кислоту титруют 0,1 М раствором гидроксида натрия:
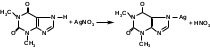
HNO3 + NaOH → NaNO3 + H2O
Этилендиамин в отдельной навеске титруют 0,1 М раствором хлористоводородной кислоты (индикатор – метиловый оранжевый):
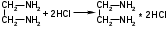
Эуфиллин применяют в качестве спазмолитического и диуретического средства.
ЗАДАЧА 9
Производное n-аминобензойной кислоты. Прокаина гидрохлорид(новокаин)procaine hydrochloride
Бесцветные кристаллы или белый кристаллический порошок без запаха. Легко растворим в спирте, малорастворим в хлороформе и почти не растворим в эфире
Подлинность: определяют по ик-спектрам, предварительно проводится прессование с таблетками бромида калия в области 4000-400см. Так же по уф-спектрофотометрии. Реакция на хлорид-ион с серебра нитратом
Количественное определение:
1)Метод аргентометрии, метод море
Титрант:серебра нитрат Индикатор:хромат калия Фактор эквивалентности 1
Обоснование:реакция осаждения хлорид ионов катионами серебра
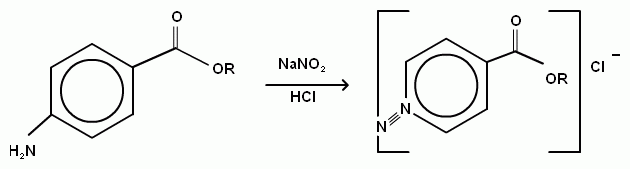
2)метод нитритометрия
Титрант: натрия нитрит Индикатор:смесь тропиолин 00 с метиленовым синим
Обоснование:реакция диазотирования,образование соли диазония
Хранят в хорошо укупоренных склянках желтого стекла. Список Б.
Выбор стабилизаторов зависит от свойств медикаментов, входящих в инъекционные растворы.
Лекарственные вещества, можно разделить на 3 группы:
1)соли, образованные слабыми основаниями и сильными кислотами,
2)соли, образованные сильными основаниями и слабыми кислотами,
3)легкоокисляющиеся вещества.
1 ГРУППА. Относятся соли алкалоидов и азотосодержащих оснований. Растворы имеют среду от нейтральной до слабокислой. Слабокислая Среда образуется за счет гидролиза солей с образованием основания и сильнодисоцииированной кислоты. Стабилизатор раствор хлористо-водородной кислоты 0,1М, 0,1н на 1 л. берется 10 мл. стабилизатора.Анализ стабилизатора
проводят после их приготовления и до стерилизации, методами, характерными для этих веществ.
2 ГРУППА. Соли сильных оснований и слабых кислот. К числу таких препаратов относятся натрия нитрит, натрия тиосульфат, кофеин-натрия бензоат. Их водные растворы, вследствие гидролиза, имеют щелочную среду. Гидролитические процессы усиливаются в кислой среде. Для подавления гидролиза добавляют щелочь или вещества, создающие слабощелочную среду - натрия гиброкарбоната. Для стабилизации натрия нитрита добавляют натрия гидроксид 0,1н 4 мл. на 1л. раствора. Никотиновая кислота 1 л. - 7,0 натрия гидрокарбоната, 3% раствора натрия тиосульфата - 20,0 натрия гидрокарбоната, кофеина - натрия бензоата - 4 мл. 0,1н раствора натрия гидроксида на 1 л. раствора.
3 ГРУППА. Легкоокисляющиеся вещества. Имеют этанольные, карбоксильные, фенольные, аминогруппу с подвижным атомом водорода. В присутствии кислород в растворе и особенно при термической стерилизации названные группы окисляются. Усиливаются эти процессы светом, изменение рН, наличием ионов тяжелых металлов.I. Обратные катализаторы. Трилон Б - комплексон, они связывают следы тяжелых металлов, в результате чего тяжелые металлы оказывают инициирующее действие на процессы окисления.
Задача 10 NaCI - Natrii chloridum; KCI - Kalii chloridum; CaCI2 - Calcii chloridum;
NaHCO3 - Natrii hydrocarbonas; H2O - Aqua purificata pro injectionibus
Катион натрия обнаруживают по окрашиванию бесцветного пламени горелки в желтый цвет. Для определения катиона калия следует использовать реакцию с гексанитрокобальтатом (III) натрия, с которым он образует желтый кристаллический осадок.
2KCl + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2NaCl
Н
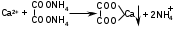 аличие ионов кальция устанавливают по белому осадку оксалата кальция после добавления к раствору оксалата аммония. Осадок растворим в разведенных минеральных кислотах.
аличие ионов кальция устанавливают по белому осадку оксалата кальция после добавления к раствору оксалата аммония. Осадок растворим в разведенных минеральных кислотах.Для количественного определения суммы хлоридов калия, натрия и кальция применяется метод аргентометрии (индикатор – хромат калия). Титруют до кирпично-красного окрашивания:
Cl- + AgNO3 → AgCl↓ + NO3-
K2CrO4 + AgNO3 → Ag2CrO4 + 2KNO3
кирпично- красное
Кроме того, можно использовать меркуриметрическое титрование.
Смотрите также файлы
- Итоговый проект по литературе Мир пушкинской лирики в исследованиях В. А. Грехнёва Автор работы.docx
- Отчет по лабораторной работе 10 определение модуля упругости (модуля юнга) по деформации изгиба.docx
- Реферат по дисциплине Психология Влияние речи родителей на развитие речи детей раннего возраста.docx