Добавлен: 12.12.2023
Просмотров: 174
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Общие реакции:
Реакция образования азокрасителя (на первичную ароматическую аминогруппу) основана на образовании хлорида диазония при действии раствором нитрита натрия и разведенной хлороводородной кислотой. Последующее сочетание хлорида диазония с фенолами в щелочной среде приводит к образованию азокрасителя:
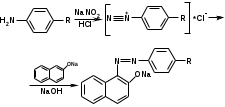
Лигниновая проба. Это своеобразная разновидность реакции образования шиффовых оснований. Она выполняется на газетной бумаге, при нанесении на которую сульфацила-натрия и капли разведенной хлористоводородной кислоты появляется оранжево-желтое окрашивание.
Реакция галогенирования (на ароматический цикл):
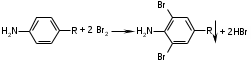
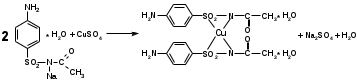
Реакция обнаружения серы (в сульфамидной группе). Наличие серы в молекуле сульфацила-натрия можно установить по реакции на сульфат-ион после окисления препарата с азотной кислотой.
При термическом разложении сульфацила-натрия в сухой пробирке образуется окрашенный плав и ощущается запах уксусной кислоты.
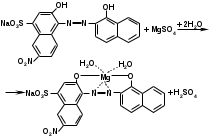
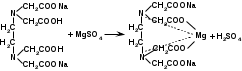
Реакция с растворами солей тяжелых металлов. Ионы меди, замещая подвижный атом водорода сульфамидной группы, образуют с сульфацилом-натрия внутрикомплексное соединение голубовато-зеленоватого цвета (реакция отличия от других сульфаниламидов):
Частные реакции на сульфацил-натрия:
Сульфацил-натрий при действии уксусной кислотой выделяет белый осадок сульфацила.
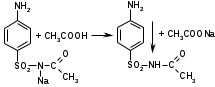
При растворении осадка в этаноле и добавлении концентрированной серной кислоты образуется этилацетат, имеющий характерный запах.
Катион натрия можно обнаружить по окраске бесцветного пламени в желтый цвет.
Количественное определение сульфацила-натрия можно провести с помощью физико-химических методов анализа
Используют УФ-спектроскопию, фотоколориметрию и нитритометрию
Натриевые соли сульфаниламидных препаратов титруют кислотой в спирто-ацетоновой среде (индикатор – метиловый оранжевый):
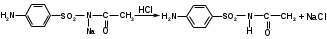
ЗАДАЧА 16
Висмута нитрат основной Bismuthi subnitras 0=Bi-O-Bi(OH)(NO3)
Висмута нитрат основной Bismuthi subnitras (пятая группа периодической системы элементов Д.И. Менделеева).
Применяют как вяжущее и отчасти антисептическое средство при желудочно-кишечных заболеваниях.
Свойства: практически нерастворим в воде и этаноле, однако смоченный водой, он окрашивает синюю лакмусовую бумагу в красный цвет вследствии гидролиза с образованием азотной кислоты и гидроксида висмутила. Химический состав непостоянен, может содержать примеси.
MgO
Магния оксид Magnesii oxydum (вторая группа периодической системы элементов Д.И. Менделеева) Применяют при повышенной кислотности желудочного сока. Свойства: практически нерастворим в воде и в этаноле, но растворим в разведенных кислотах.
Магния оксид и висмута нитрат основной практически нерастворимы в воде и этаноле, растворимы в кислотах (азотной, соляной):
O=Bi-O-Bi(OH)(NO3)== 2 Bi(NO3)3+3H2O
MgO + 2HCl → MgCl2 + H2O
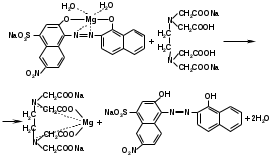
Для установления подлинности висмута нитрата основного можно использовать реакцию с сульфидом натрия после растворения лекарственной формы в азотной кислоте:
2Bi(NO3)3 + 3Na2S → Bi2S3↓ + 6NaNO3 (коричнево-черный осадок).
После взбалтывания лекарственной формы с разведенной серной кислотой и добавления раствора калия иодида образуется черный осадок иодида висмута, растворимый в избытке реактива:
Bi2(SO4)3 + 6KI → 2BiI3↓ + 3K2SO4
BiI3 + KI → KBiI4 (желто-оранжевое окрашивание)
Для установления подлинности магния оксида лекарственную форму растворяют в хлороводородной кислоте. Затем добавляют раствор гидрофосфата натрия и раствор аммиака. Образуется белый осадок:
MgCl2 + Na2HPO4 + NH4OH=(NH4CL)= NH4MgPO4↓белый + 2NaCl + H2O
Количественное определение висмута нитрата: комплексонометрическим методом. Титруют 0,05 М раствором трилона. Б в присутствии индикатора пирокатехинового фиолетового:
Учитывая непостоянство состава висмута нитрата основного, расчет содержания проводят по оксиду висмута, которого должно быть 79-82%.
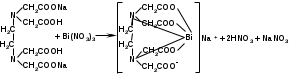
Магния оксид: комплексонометрическим методом с использованием индикатора кислотного хром черного специального.
MgO + 2H2SO4 → MgSO4 + H2O

З
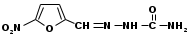 АДАЧА 17. Фурацилин. Furacilinum. Нитрофурал (МНН)
АДАЧА 17. Фурацилин. Furacilinum. Нитрофурал (МНН)5-нитрофурфурола семикарбазон
В основе структуры лежит 5-нитрофуран:
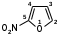
фуран 5-нитрофуран
Фурацилллин назначают наружно для лечения и предупреждения гнойно-воспалительных процессов и внутрь для лечения бактериальной дизентерии.
ЛФ: в виде 0,02%-ных водных, 0,066% спиртовых растворов и 0,2%-ной мази; таблетки по 0,1г.
Производные 5-нитрофурана (производные фурана), ЛС: нитрофурал (фурацилин), нитрофурантоин (фурадонин), фуразолидон, фуразидин (фурагин).
Производные нитрофурана сходны по физическим свойствам. это желтые с зеленоватым оттенком кристаллические вещества, без запаха. они очень мало растворимы или практически нерастворим в воде и этаноле, мало или умеренно растворимы в диметилформамиде, мало или очень мало- в ацетоне. ввиду наличия не только нитро-, но и имидной группы нитрофурал проявляет в растворах кислотные свойства и лучше других растворяется в щелочах.
Для испытания подлинности лекарственных веществ ФС рекомендует цветную реакцию с водным раствором гидроксида натрия. Образуется оранжево – красное окрашивание.
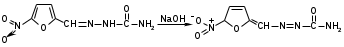
оранжево-красное окрашивание
При нагревании со щелочью фурацилин разлагается с выделением аммиака.
Количественное определение фурацилина выполняют иодометрическим методом, основанным на окислении иодом в щелочной среде.
I
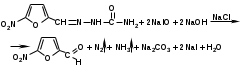 2 + 2NaOH → NaI + NaIO + H2O
2 + 2NaOH → NaI + NaIO + H2OПосле окончания процесса окисления фурацилина раствор подкисляют и титруют выделившийся избыток иода тиосульфатом натрия:
NaIO + NaI + H2SO4 → I2 + Na2SO4 + H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Для количественного определения фурацилина в лекарственных формах используют фотоколориметрический метод, основанный на цветной реакции с гидроксидом натрия.
1
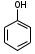 8.
8.1. Фенол чистый. Phenolum purum. Оксибензол (МНН)
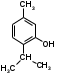
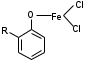
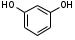
2. Тимол. Thymolum. 2-изопропил-5-метилфенол
3. Резорцин. Resorcinum. м-диоксибензол
Фенол, резорчин и тимол применяют в качестве антисептических средств. фенол-едкое вещество, вызывает ожоги кожи и слизистых оболочек. Раствор фенола (3-5%) применяют для дезинфекции инструментов, белья и т.д. Резорцин менее токсичен, поэтому его назначают при кожных заболеваниях в виде 2-5% водных, спиртовых растворов и 5-20% мазей. еще меньшая токсичность тимола позволяет применять его внутрь в качестве антисептического средства при заболеваниях ЖКТ и как противоглистное средство. Фенол используют в качестве консервантов некоторых жидких ЛФ.
Химические свойства фенолов обусловлены как наличием в молекуле гидроксильной группы с подвижным атомом водорода, так и ароматического ядра. Фенолы проявляют слабые кислотные свойства.
Под влиянием влаги, света и кислорода воздуха и резорцин легко окисляется. Этим объясняется грязно – розовое окрашивание резорцина (вещества 3).
Для подтверждения подлинности фенолов изучают УФ – спектр.
Для обнаружения фенольного гидроксила проводят реакцию с хлоридом железа (III). Образуютя окрашенные соединения. Окраска зависит от числа и расположения в молекуле фенольных гидроксилов
При сочетании фенолов с солями диазония в щелочной среде происходит реакция образования окрашенных оксиазосоединений:
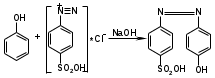
фенол соль диазония оксиазосоединение
красное окрашивание
Для фенолов характерна реакция замещения. Так, с бромной водой образуются осадки бромпроизводных:
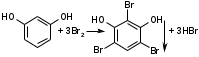
резорцин
Отличительной реакцией на резорцин является реакция конденсации с фталиевым ангидридом с образованием флуоресцеина:
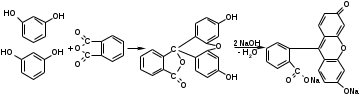
Количественное определение фенолов в субстанции и лекарственных формах проводят методом броматометрии (прямой и обратный варианты). В качестве титрованного раствора используют 0,1 М раствор бромата калия. Определение ведут в присутствии бромида калия в кислой среде. Выделяющийся бром вступает в реакцию с фенолом.
KBrO3 + 5KBr + 3H2SO4 → 3Br2 + 3K2SO4 + 3H2O
[реакцию бромирования фенола см. выше]
В случае прямого титрования используют индикатор метиловый красный, который обесцвечивается в конце титрования.
В случае обратного титрования избыток бромата калия определяют йодометрически.
Лекарственные препараты фенолов хранят по списку Б в хорошо укупоренной таре, при температуре не выше 25 (тимол). предохраняют от действия света, под влиянием которого в присутствии кислорода воздуха они постепенно окисляются приобретая розовое окрашивание. НД допускает изменение цвета до розового.
1
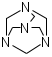 9.
9.(CH2)6N4
Гексаметилентетрамин. Hexamethylentetraminum
Смотрите также файлы
- Итоговый проект по литературе Мир пушкинской лирики в исследованиях В. А. Грехнёва Автор работы.docx
- Отчет по лабораторной работе 10 определение модуля упругости (модуля юнга) по деформации изгиба.docx
- Реферат по дисциплине Психология Влияние речи родителей на развитие речи детей раннего возраста.docx