ВУЗ: Национальный исследовательский томский политехнический университет
Категория: Учебное пособие
Дисциплина: Химия
Добавлен: 09.02.2019
Просмотров: 10329
Скачиваний: 59
21
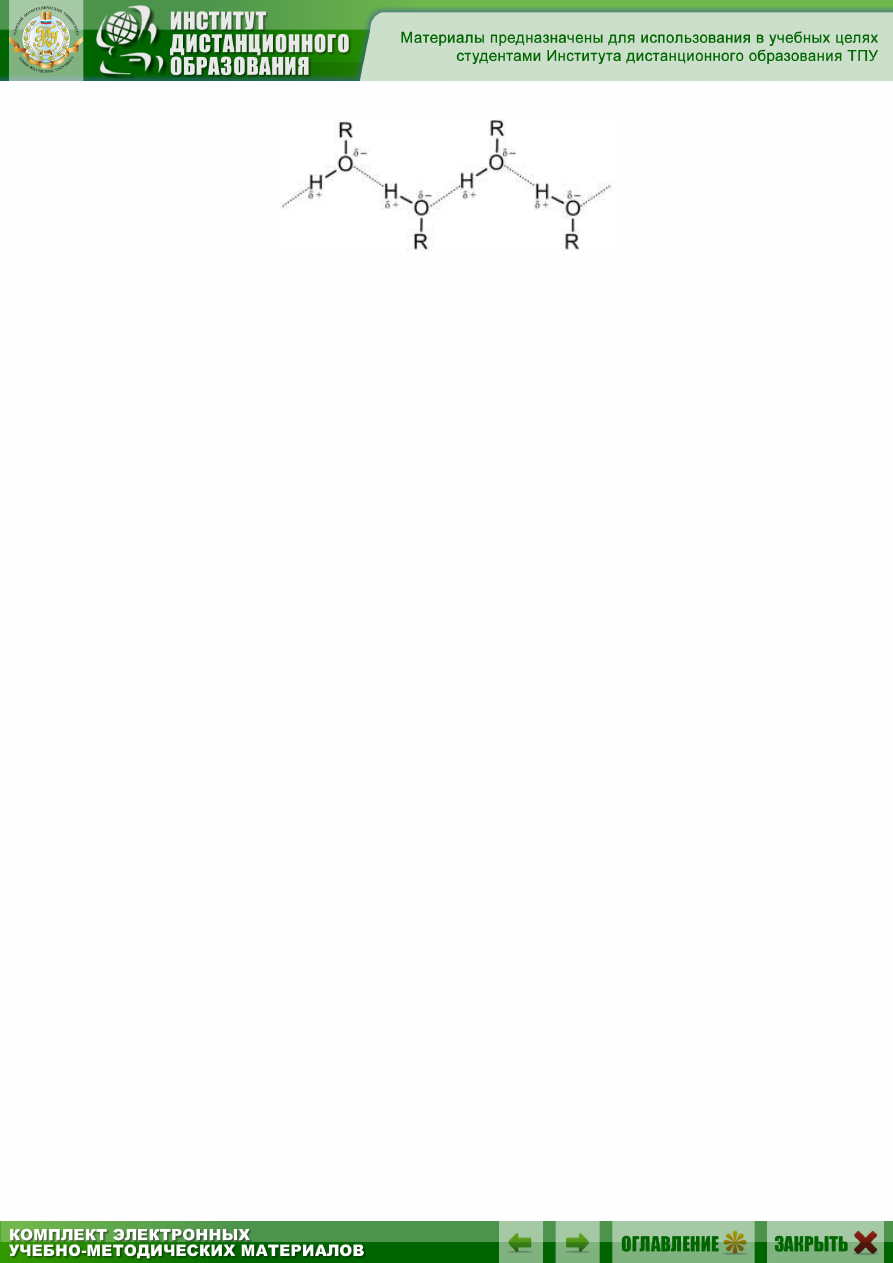
Водородная связь может быть межмолекулярной и внутримолеку-
лярной.
Водородная связь гораздо более слабая, чем ионная или ковалент-
ная, но более сильная, чем межмолекулярное взаимодействие. Водород-
ные связи обусловливают некоторые физические свойства веществ (на-
пример, высокие температуры кипения). Особенно распространены во-
дородные связи в молекулах белков, нуклеиновых кислот и других био-
логически важных соединений, обеспечивая им определенную про-
странственную структуру (организацию).
2.2. Электронное строение атома углерода
Электронное строение атома углерода в основном состоянии имеет
вид 1s
2
2s
2
2р
2
, т.е. на s-орбитали 1-го энергетического уровня находятся
два электрона, на s-орбитали и р-орбиталях 2-го энергетического уровня
находятся по два электрона. Следует вспомнить, что орбиталью, или
электронным облаком, называют совокупность положений электрона
в атоме, т.е. область пространства, в которой наиболее вероятно нахож-
дение электрона. Форма электронной орбитали может быть различна. Из
электронной формулы атома углерода видно, что у него две разновидно-
сти орбиталей: s и p. s-Орбиталь имеет форму сферы, а p-орбиталь –
форму гантели или объемной восьмерки. Электроны заполняют орбитали
атома в порядке увеличения энергии. Чем ближе к ядру находится орби-
таль, тем меньшую энергию имеет электрон, расположенный на ней.
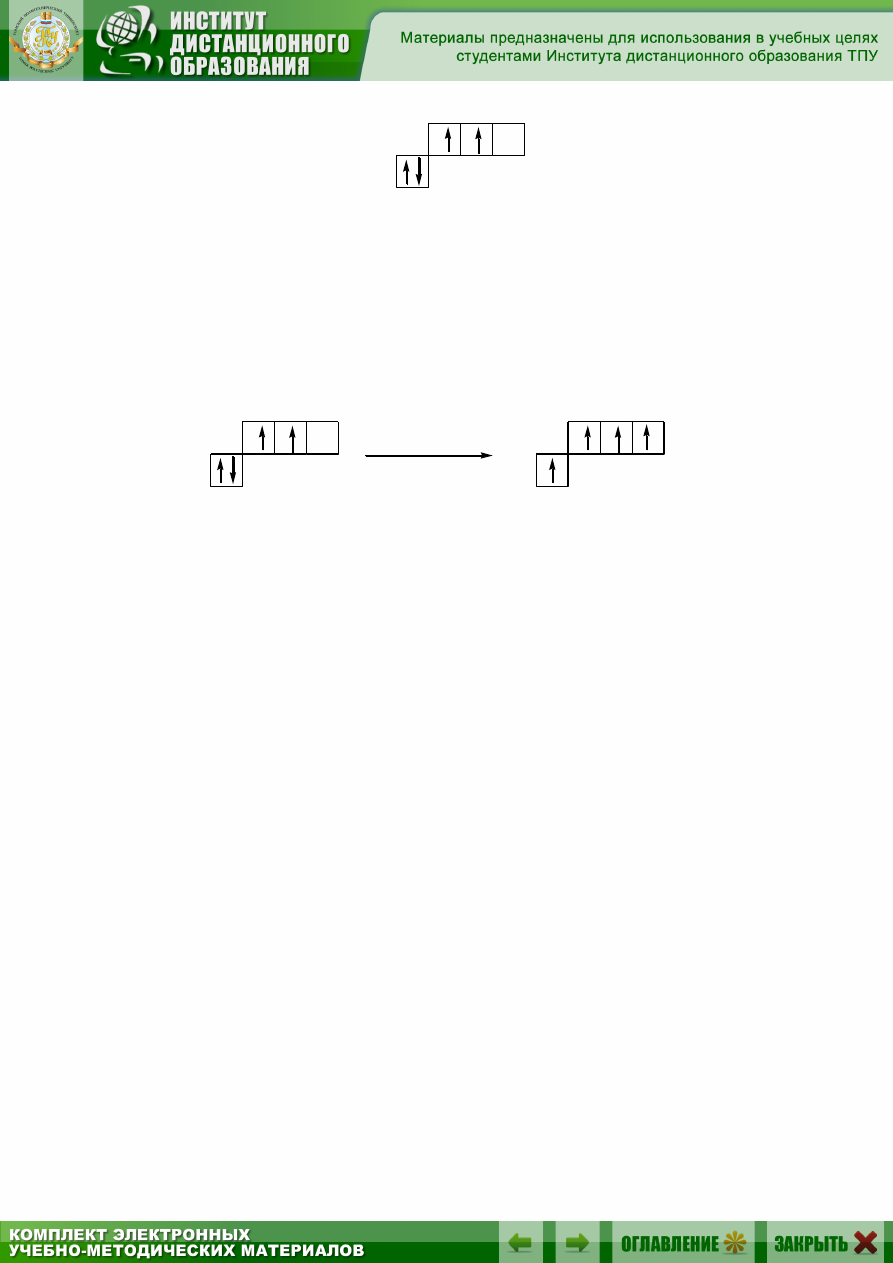
Строение электронной оболочки атома часто изображают с помо-
щью квантовых ячеек. Каждую орбиталь обозначают квадратиком,
электроны – стрелками, указывающими различное направление их спи-
на. Квадратики располагают ступеньками. Чем выше ступенька, тем
больше энергия электронов, находящихся на данной орбитали. Валент-
ность атома определяется главным образом числом неспаренных элек-
торонов на внешнем энергетическом уровне. Электронная конфигура-
ция внешнего энергетического уровня атома углерода имеет вид
22
2p
2s
В соответствии с приведенной электронно-графической формулой
атом углерода может образовать по обменному механизму только две
ковалентные связи. Однако в подавляющем большинстве органических
соединений углерод четырехвалентен. Это можно объяснить тем, что
при образовании химических связей выделяется энергия, достаточная
для перехода одного из электронов с 2s-орбитали на вакантную
2p-орбиталь. Принято говорить, что атом углерода перешел в возбуж-
денное состояние.
2p
2s
основное состояние
возбужденное состояние
2p
2s
Таким образом, атом углерода имеет четыре неспаренных электро-
на и может образовать четыре ковалентные связи.
2.3. Типы гибридизации атома углерода
В возбужденном состоянии атом углерода четырехвалентен и мо-
жет присоединить четыре одновалентных атома, таких, например, как
атомы водорода. Действительно, простейшим органическим соединени-
ем является метан CH
4
.
Логично предположить, что в молекуле метана три связи С–Н об-
разованы перекрыванием p-орбиталей атома углерода и s-орбиталей
трех атомов водорода, а четвертая связь – перекрыванием
s-орбиталей атомов углерода и водорода. В таком случае одна из связей
должна отличаться от остальных по длине и энергии. Эксперименталь-
ные данные говорят о том, что в метане все четыре связи С–Н одинако-
вы. Для объяснения этого факта американский химик Лаймус Полинг
предложил теорию гибридизации атомных орбиталей. Согласно этой
теории атом углерода не имеет «чистых» s- и p-орбиталей. При образо-
вании химических связей эти орбитали атома углерода усредняются по
форме и энергии, превращаясь в четыре новые равноценные орбитали.
Гибридизация – это взаимодействие атомных орбиталей
с близкими значениями энергии, сопровождающееся образованием
новых «гибридных» орбиталей, одинаковых по форме и энергии.
23
Гибридизация – процесс, требующий затрат энергии, но эти затра-
ты с избытком компенсируются за счет энергии, выделяющейся при об-
разовании большего числа ковалентных связей. Образующиеся «гиб-
ридные» орбитали имеют форму ассимметричной гантели и отличаются
от исходных орбиталей атома углерода.
Для атома углерода возможно три типа гибридизации:
sр
3
-гибридизация;
sр
2
-гибридизация;
sр-гибридизация.
2.3.1. Гибридизация sр
3
-типа
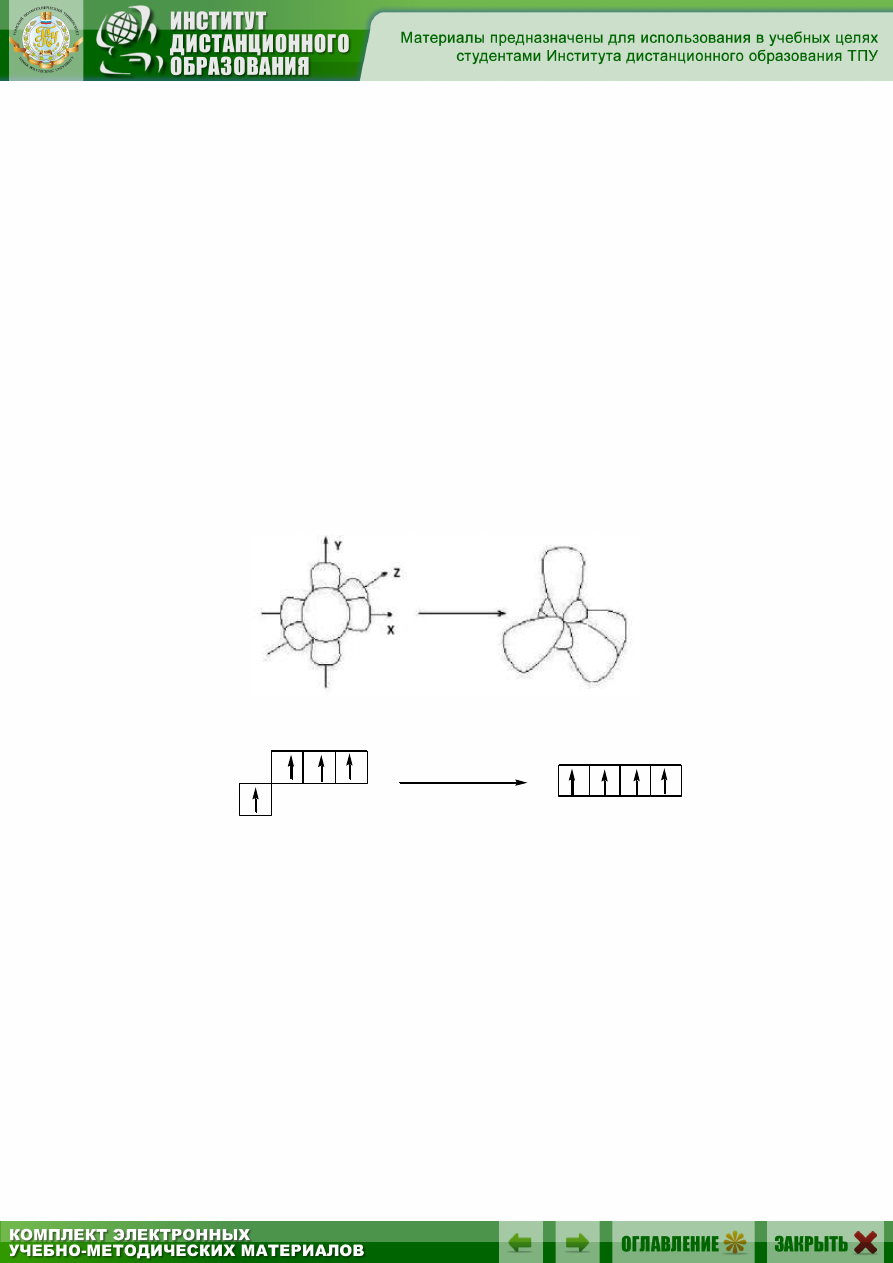
sр
3
-Гибридизация – это комбинация одной s- и трёх p-орбиталей внеш-
него энергетического уровня и образование четырех новых sр
3
-орбиталей,
имеющих форму объёмной восьмёрки с неравноценными сферами:
исходные орбитали sр
3
-
гибридные орбитали
sp
3
2p
2s
Каждая sр
3
-орбиталь имеет точку с нулевой электронной плотно-
стью – узел. У всех четырех орбиталей узлы совпадают – в этом месте
находится ядро атома. Электронные орбитали испытывают взаимное
отталкивание и отклоняются друг от друга в пространстве на макси-
мально возможное расстояние. Их оси направлены к вершинам тетраэд-
ра, в центре которого находится атом углерода, а угол между осями ра-
вен 109°28'.
24
2.3.2. Гибридизация sр
2
-типа
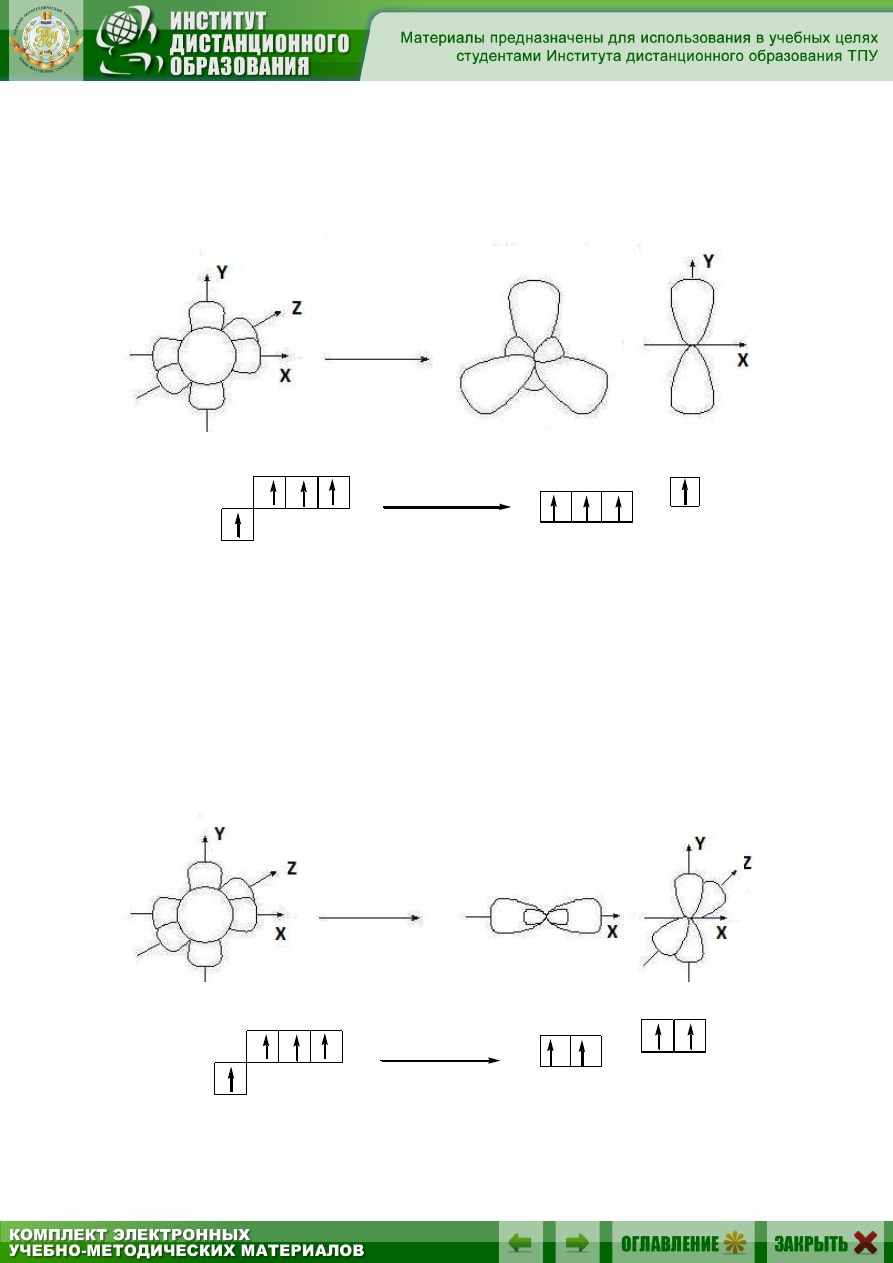
sр
2
-Гибридизация – это комбинация одной s- и двух p-орбиталей
внешнего энергетического уровня и образование трех новых sр
2
-орбиталей,
имеющих форму объёмной восьмёрки с неравноценными сферами:
исходные орбитали sр
2
-
орбитали p-орбиталь
2p
2s
sp
2
2p
Гибридные орбитали лежат в одной плоскости, угол между их ося-
ми орбиталей равен 120°. Одна p-орбиталь остается негибридизованной,
и её ось перпендикулярна плоскости, в которой расположены оси трех
гибридных орбиталей.
2.3.3. Гибридизация sр-типа
sр-Гибридизация – при этом взаимодействуют, выравниваясь по
форме и энергии только две орбитали атома углерода: одна s- и одна p-.
Образуются две новых sр-орбитали:
исходные орбитали sр-орбитали p-орбитали
sp
2p
2p
2s
25
Гибридные орбитали лежат на одной прямой, угол между их осями
равен 180°, оси двух негибридизованных р-орбиталей взаимно перпен-
дикулярны и перпендикулярны осям sp-орбиталей.
Гибридные орбитали атома углерода способны участвовать в обра-
зовании только
-связей, незатронутые гибридизацией р-орбитали обра-
зуют только
-связи. Именно этой особенностью определяется про-
странственное строение молекул органических веществ.
2.4. Ковалентные
- и
-связи
- и
-Связи различают по симметрии перекрывания орбиталей.
Если линия, соединяющая ядра связанных атомов, проходит через
область перекрывания орбиталей, связь называется
-связью; если об-
ласть перекрывания лежит в стороне от этой линии –
-связью.
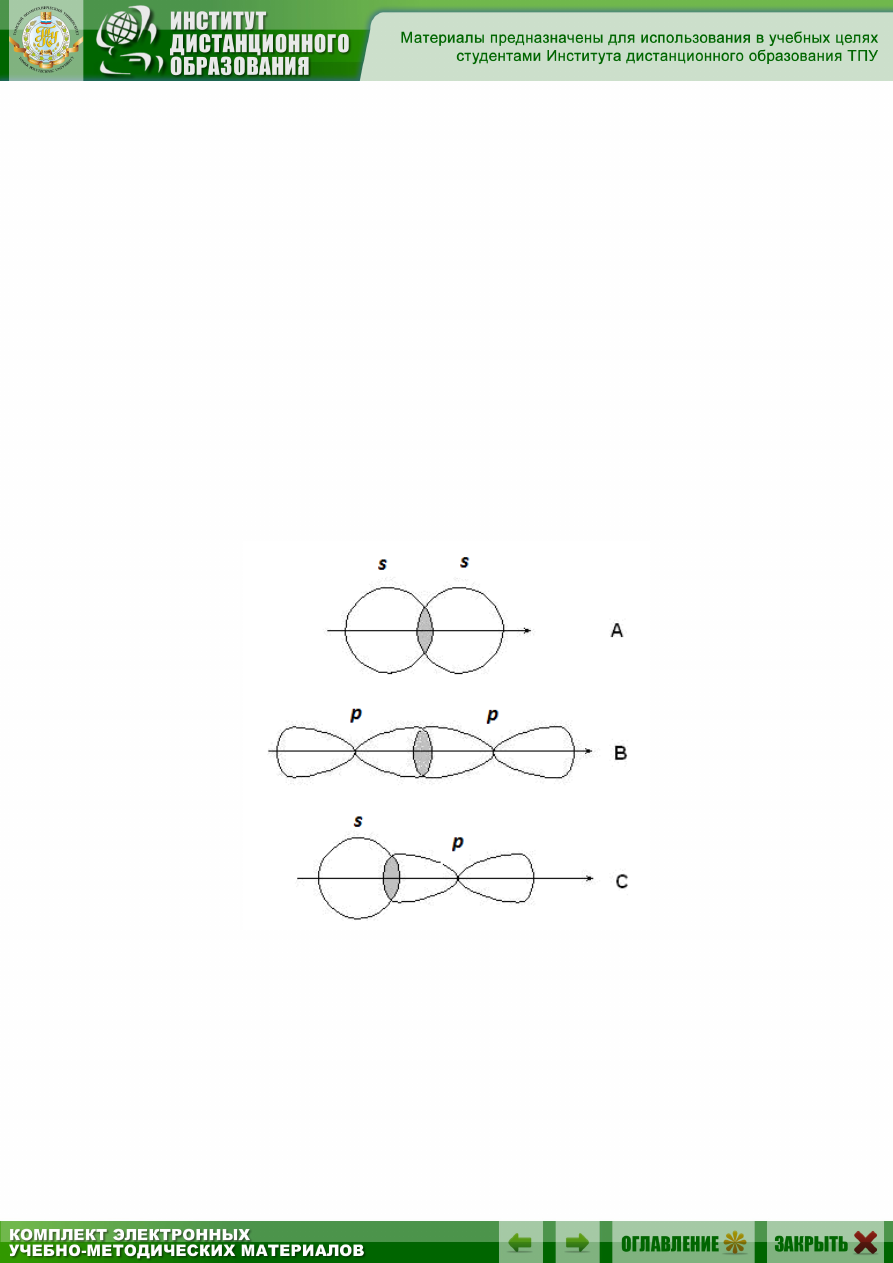
-Связи образуются при перекрывании s-s орбиталей атомов (А),
р-p орбиталей (В), s-p орбиталей (С) и гибридных орбиталей (рис. 2.2).
Рис. 2.2. Образование
-связей
-Связи образуются при боковом перекрывании р-р орбиталей, оси
которых параллельны друг другу (рис. 2.3).