ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 06.12.2023
Просмотров: 660
Скачиваний: 8
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
ТОҚСАН БОЙЫНША ЖИЫНТЫҚ БАҒАЛАУҒА АРНАЛҒАН ТАПСЫРМАЛАР
| 10.2А «Термодинамикаға кіріспе» бөлімі бойынша жиынтық бағалау | |
| Оқу мақсаты |
|
| Бағалау критерийі | Білімалушы
|
| Ойлау дағдыларының деңгейі | Білу және түсіну Қолдану |
| Орындалу уақыты | 20 инут |
| 1. (a) Көп нүктенің орнына қажетті сөздерді қойып, төменде берілген сөйлемді толықтырыңыз. Газ күйінде, екі атом арасында байланыс түзілгенде бөлінетін энергия – .................. деп аталады. Байланыс энергиясының шамасы әрқашан мәнге ие болады, яғни түзілген жүйеден энергия бөлінетіндігін білдіреді. Байланыс энергиясының мәні мен таңбасы жөнінен қарама-қарсы шама – .......................... энергиясы деп аталады. | |
-
Бромэтанда C-Br арасында байланыс үзілуі гомолиттік үзілу деп аталады және келесі теңдеумен сипатталады: CH3Br → CH3• + Br•
Түзілетін екі бөлшек …
-
атомдар -
бос радикалдар -
молекулалар -
иондар
-
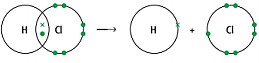 Суретті зерделеңіз. Суретте берілген процесті қалай атауға болады?
Суретті зерделеңіз. Суретте берілген процесті қалай атауға болады?-
гетеролиттік үзілу -
гомолиттік үзілу -
тізбектің айырылуы -
тізбектің өсуі
-
-
(a) Кестедегі ақпаратты қараңыз.
| Қосылыс | С6Н6 (сұйық) | СО2 (г) | Н2О (сұйық) |
| θ -1 ∆Hтүз / кДж моль | +49 | -394 | -286 |
 С6Н6 (с) + 7 1 О2 (г) → 6 СО2 (г) + 3 Н2О(с)
С6Н6 (с) + 7 1 О2 (г) → 6 СО2 (г) + 3 Н2О(с)2
Бензолдың жану реакциясы үшін стандартты энтальпияның өзгерісі кДж моль-1 мәнін қай тұжырым көрсетеді:
1) 6 * ( -394) + 3 * (-286) – (49)
2) 12 * (-394) + 6 * (-286) – 2* (49)
3) 12 * (394) + 6 * (-286) – 2 *(-49)
-
H2(г) +O2(г) → 2H2O(г) реакциясы үшін энтальпияның өзгерісін ∆Hθ = -572 кДж ескере отырып, дұрыс тұжырымды анықтаңыз.-
Стандартты жану энтальпиясының өзгерісі Н2 (г) үшін - 286 кДж моль-1 -
Стандартты жану энтальпиясының өзгерісі Н2 (г) үшін + 286 кДж моль-1 -
Стандартты түзілу энтальпиясының өзгерісі H2O(г) үшін - 572 кДж моль-1 -
Стандартты түзілу энтальпиясының өзгерісі H2O(г) үшін + 572 кДж моль-1
-
-
(а) Ұсынылған схемадан Гесс заңын түсіндіріңіз.
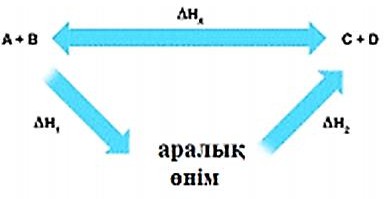
-
Сутек асқын тотығы біртіндеп суға және оттегіге ыдырайды. Реакцияның өзгеріс энтальпиясын стандартты түзілу энтальпиялары арқылы анықтауға болады.
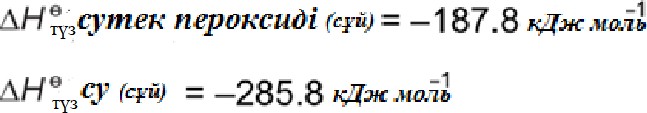
Гесс циклын қолданып айырылу реакциясының өзгеріс энтальпиясын есептеңіз. 2H2O2 (сұй) → 2H2O(сұй) + O2 (г)
-
Кальций карбиді CaC2 кальций оксидін CaO және көміртек C көзі саналатын коксты күйдіру арқылы алынатын маңызды өнеркәсіптік өнім болып саналады.
ΔH пен көрсеткіштерді қолдана отырып, Гесс заңы бойынша теңдеулер құрыңыз.
Стандартты энтальпия өзгерісі
CaO(қ)+3C(қ)→CaC2(қ)+CO(г) ΔHx =?
Ca(қ)+12O2(г)→CaO(қ) ΔH1= −635.1 кДж/моль C(қ)+12O2(г)→CO(г) ΔH2= −110.5 кДж/моль
Ca(қ)+2C(қ)→CaC2(қ) ΔH3 = −59.8 кДж/моль Берілген реакцияның энтальпия өзгерісін ΔHx есептеңіз.
-
(a) Төменде кестеде берілген тұжырымдардың «шын» немесе «жалған» екенін көрсетіңіз. Егер тұжырым дұрыс болса, () егер бұрыс болған жағдайда () белгісін қойыңыз.
| № | Тұжырым | Шын ()/ Жалған () |
| 1 | Гиббс энергиясының өзгерісі процестің өздігінен жүру- жүрмеу мүмкіндігін анықтайды | |
| 2 | Өздігінен жүретін процестер үшін Гиббс энергиясының мәні теріс болады | |
| 3 | ΔH∘ − жүйедегі стандартты энтропияның өзгерісі | |
| 4 | ΔS∘ − жүйедегі стандартты энтальпияның өзгерісі | |
| 5 | ΔG∘ − жүйедегі бос энергияның стандартты (Гиббс) өзгерісі | |
| 6 | Егер жүйе мен қоршаған ортадағы жалпы энтропия өзгерісі оң болса, химиялық және физикалық процестер спонтанды жүреді | |
(b) 25°C-та су буының конденсациялануындағы бос энергия өзгерісін есептеп, мәтінді аяқтаңыз. Барлық көрсеткіштерді ең жақын бүтін санмен және кДж/моль арқылы
көрсетіңіз.
Н2О (г) → Н2О (с)
 ΔH0 = - 44 кДж
ΔH0 = - 44 кДж
 моль
моль| Қосылыс | S0 (Дж ) 298 К моль |
| Н2О (с) | 70 |
| Н2О (г) | 189 |



 ΔG∘ =ΔH0−TΔS0
ΔG∘ =ΔH0−TΔS0
Су буының конденсациясы кезінде ретсіз қозғалыс Процесс спонтанды болып
табылады.
-
(a) Энтальпия мен энтропия өзгерісі мен реакцияның жүру жағдайына байланысты тұжырымдарды сәйкестендіріңіз.
| Энтальпия мен энтропия өзгерісі | Реакция энтропиясына байланысты тұжырым | ||
| A | ΔH° < 0, ΔS°<0 | 1 | Реакция кез келген температурада спонтанды бола бермейді. Кері реакция спонтанды болады. |
| B | ΔH° < 0, ΔS°>0 | 2 | Реакция кез келген температурада спонтанды. Кері реакция спонтанды емес. |
| C | ΔH°> 0, ΔS°>0 | 3 | Реакция төмен температурада спонтанды болады. Жоғары температурада кері реакция спонтанды болуы мүмкін. |
| D | ΔH°>0, ΔS°<0 | 4 | Реакция жоғары температурада спонтанды болуы мүмкін. Төмен температурада кері реакция спонтанды түрде өтеді. |