ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 25.10.2023
Просмотров: 211
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
c(Fe2+)V(Fe2+) =с(1/5 МnO4‾)V( МnO4‾),
Зная объемы аликвоты анализируемого раствора V(Fe2+) и титрантаV(МnO4‾), а также концентрацию раствора титрантас(1/5 МnO4‾), рассчитывают концентрациюc(Fe2+) определяемого вещества в исходном анализируемом растворе. Массу железа(II) во всем объемеV(в литрах) исходного анализируемого раствора рассчитывают обычным путем:m = c(Fe2+) M(Fe2+) V.
Б)Обратное ОВ титрование проводят тогда, когда применение прямого титрования невозможно по тем или иным причинам.К аликвоте анализируемого раствора, содержащего определяемый компонент X, прибавляют точно известное количество вещества А, взятого в избытке. Непрореагировавший избыток вещества А оттитровывают стандартным раствором титранта Т.
Так при иодиметрическом определении сульфид-иона к аликвоте анализируемого раствора, содержащего сульфид-ионы, прибавляют в избытке точно известное количество раствора иода. S2‾ +J2 =S+ 2J‾
Непрореагировавший избыток иода отгитровывают стандартным раствором тиосульфата натрия:
2Na2S2O3+J2=Na2S4O6+ 2NaJ
Расчеты проводят, исходя из закона эквивалентов с учетом полуреакций:
| S2‾‑ 2е=S | z = n = 2 |
| J2 + 2e =2J‾ | z = n = 2 |
| 2S2O32‾ ‑2e =S4O62‾ | z = n/2= 2/2 = 1 |
Втакомслучае:
n(1/2J2) = n(1/2S2‾) + n(Na2S2O3)
с(1/2S2‾)V(S2‾)= c(1/2J2)V(J2)-c(Na2S2O3)V(Na2S2O3)
В)Заместительное ОВ титрование применяют для определения веществ как вступающих, так и не вступающих в ОВ реакции.Так, при иодометрическом определении пероксида водорода к аликвоте анализируемого раствора, содержащего определяемый пероксид водорода в сернокислой среде, прибавляют избыточное количество иодида калия. При этом протекает реакция с образованием иода:Н2О2+2J‾ + 2Н+=J2 + 2Н2O
Выделившийся иод (заместитель) в количестве, эквивалентном количеству пероксида водорода в аликвоте, оттитровывают стандартным раствором тиосульфата натрия:2Na2S2O3+J2 =Na2S4O6+ 2NaJ
Расчеты проводят так же, как и при прямом титровании, исходя из закона эквивалентов, с учетом того, что молекула пероксида водорода принимает два электрона (z = п = 2),два иодид-иона теряют вместе два электрона, переходя в молекулу иода J2(z = п =2); для тиосульфат-иона z = 1.
Индикаторы ОВТ:
1)Индикатор — реагент, участвующий в ОВ реакции. Примером может служить раствор титранта — перманганата калия KMnO4в перманганатометрии. Раствор перманганата калия обладает интенсивной малиново-фиолетовой окраской, поэтому первая же капля избыточного титранта после ТЭ окрашивает титруемый раствор в розово-малиновый цвет. Титрование оканчивают при появлении устойчивой розово-малиновой окраски раствора.
2)Индикатор — вещество, вступающее в специфическое взаимодействие с окислителем или восстановителем с образованием окрашенных соединений. Примером может служить свежеприготовленный раствор крахмала, который в присутствии иода окрашивается в синий цвет.
3)Индикатор — вещество, которое при определенном потенциале раствора окисляется или восстанавливается с изменением окраски. Такие индикаторы называют редокс-индикаторами. Другими словами, редокс-индикаторы — это индикаторы, способные окисляться или восстанавливаться с изменением окраски в ТЭ или вблизи ее. Окислительно-восстановительные индикаторы бывают о6ратимыми и необратимыми. Обратимые индикаторы меняют окраску обратимо при потенциале раствора в ТЭ или вблизи ее и при этом не разрушаются. Необратимые индикаторы изменяют окраску при достижении определенного значения потенциала в ТЭ или вблизи ее и при этом необратимо разрушаются.
О-Фенантролин (Ферроин)Дифениламин
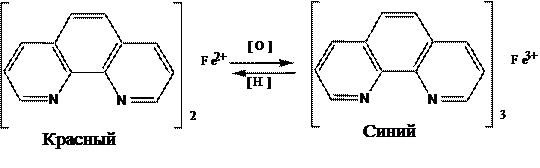
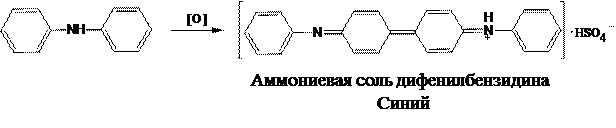
Осадительное титрование. Сущность метода, требования, предъявляемые к реакциям в методе осадительного титрования. Классификация методов по природе реагента. Кривые осадительного титрования, их расчет, построение. Индикаторы (осадительные, металлохромные, адсорбционные).
Осадительное титрование – это метод титриметрического анализа, основанный на применении титрантов, образующих с анализируемым веществом малорастворимые соединения. Метод – фармакопейный. В основе лежит реакция: mAm++nBn-=AmBn↓. ПР(Ks)=mmnnSm+n. Если m=1, n=1, то Ks=[A+]в насыщ р-ре[B-]в насыщ р-ре
. В насыщенном растворе [A+]=[B-]=√Ks или рА=рВ=1/2рKs. В насыщенном водном растворе малорастворимого бинарного электролита наблюдается равенство концентраций и показателей концентраций его ионов. В осадительном титровании насыщенный раствор образуется в титриметрической системе в ТЭ. Ag+(T)+Cl-(X)=AgCl↓
Титрование ведут до прекращения образования осадка AgCl. В этот момент количество титранта равно количеству определенного вещества. В осадительном титровании КТТ обычно фиксируют с помощью индикаторов, хотя иногда применяют и безындикаторный способ.
Методы осадительного титрования обычно классифицируют по природе активного реагента, взаимодействующего с определяемым веществом: аргентометрия (AgNO3), тиоцианатометрия (KNCS или NH4NCS), меркурометрия (Hg2(NO3)2), сульфатометрия (H2SO4), бариметрия (BaCl2).
Реакции в осадительном титровании должны отвечать следующим требованиям:
1)Определяемое вещество должно хорошо растворяться в воде с образованием бесцветного раствора и содержать хотя бы один ион, вступающий в реакцию осаждения с титрантом.
2)Реакция осаждения должна протекать строго стехиометрически. Побочные реакции и процессы соосаждения титранта или определяемого вещества с образующимся осадком исключаются.
3)Реакция должна протекать практически до конца.
4)Осадок должен выпадать быстро, при комнатной температуре, без образования пересыщенных растворов.
Кривая осадительного титрования — графическое изображение изменения концентрации определяемого вещества (или титранта) в зависимости от объема прибавленного титранта (или определяемого вещества). Часто кривые осадительного титрования строят в координатах рМ —V(Т) или рА — V(Т), где показатель концентрации катионов металла рМ = -lg[Мn+]; рА = -lg [An-]; V(Т) — объем прибавленного титранта.
Расчет и построение кривых осадительного титрования. Рассмотрим расчет и построение кривых осадительного титрования на примере аргентометрического титрования раствора хлорида натрия (Х) стандартным раствором нитрата серебра (Т): NaCl(Х) + AgNO3(Т)= AgCI↓ + NaNO3
В качестве начальных условий выберем следующие:
-объем исходного анализируемого раствора V(NaCl)=V(Х)=100мл=0,1л
-концентрация исходного анализируемого раствора c(NaCl)=с(Х)=0,1 моль/л;
-объем прибавленного титранта V(AgNO3)=К(Т) - переменная величина;
-концентрация титранта c(AgNO3)=с(Т)=0,1 моль/л. Произведение растворимости хлорида серебра равно: Ks°(AgCI) = 1,78 • 10-10; -lg Ks°(AgCl) = pKs° = 9,75.
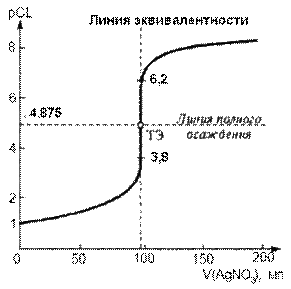
Для построения кривой осадительного титрования рассчитаем pCl =-lg [C1-] в различные моменты титрования, а также найдем pAg=-lg[Ag+]=Ks°(AgCl)-pCl=9,75-pCl после начала прибавления титранта.
1) Расчет pCl исходного раствора: pCl=-lg[Cl-]=-lg0,1=1.
2) Расчет pCl до ТЭ. После начала прибавления титранта и до ТЭ концентрация хлорид-ионов в титруемом растворе уменьшается.
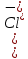 ; pCl=-lg[Cl-]
; pCl=-lg[Cl-]3) Расчет pCl в ТЭ. В ТЭ теоретически все хлорид-ионы оттитрованы; образовалось эквивалентное количество хлорида серебра, который незначительно растворяется: AgCl ↔ Ag+ + Cl-
pCl = -lg[Сl-] = -lg Ks°(AgCl)/2 = рKs°(AgCl)/2 = 9,75/2 = 4,875.
4) Расчет pCl после ТЭ. После ТЭ дальнейшее прибавление титранта приводит к уменьшению растворимости осадка AgCl за счет влияния избытка вводимых катионов серебра. Равновесная концентрация хлорид-ионов уменьшается.
Ks°(AgCl)=[Ag+]
рKs°(AgCl)=pAg+pCl,
pCl=рKs°(AgCl)–pAg=9,75–pAg.
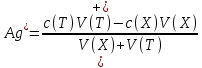 .
. Осадительные индикаторы - такие индикаторы, которые выделяются из раствора в виде осадка в хорошо заметной форме в ТЭ или вблизи ее. Известно небольшое число осадительных индикаторов. Примером осадительных индикаторов может служить хромат калия K2CrO4, предложенный Мором для аргентометрии хлорид-ионов нитратом серебра.
Осадительные индикаторы - такие индикаторы, которые выделяются из раствора в виде осадка в хорошо заметной форме в ТЭ или вблизи ее. Известно небольшое число осадительных индикаторов. Примером осадительных индикаторов может служить хромат калия K2CrO4, предложенный Мором для аргентометрии хлорид-ионов нитратом серебра.В исходный анализируемый раствор, содержащий определяемые хлорид-ионы, прибавляют небольшое количество раствора хромата калия и титруют раствором нитрата серебра. В процессе титрования вначале образуется малорастворимый белый осадок хлорида серебра: Ag++Cl-=AgCl↓
Хлорид серебра менее растворим, чем хромат серебра, поэтому осадок хромата серебра не образуется до тех пор
, пока в растворе имеются хлорид-ионы. В ТЭ все хлорид-ионы теоретически оттитрованы. Прибавление первой же избыточной порции титранта - раствора нитрата серебра - приводит к возникновению красного осадка хромата серебра: 2Ag++CrO42-=Ag2CrO4↓ При появлении красного осадка титрование заканчивают.
Металлохромные индикаторыв осадительном титровании - индикаторы, образующие с титрантом окрашенные комплексы вблизи ТЭ. Один из наиболее известных металлохромных индикаторов осадительного титрования - соль железа(Ш) - был предложен Фольгардом для тиоцианатометрического определения катионов серебра Ag+ и для аргентометрического определения галогенидов способом обратного титрования. Обычно в качестве соли железа(Ш) используют железо-аммонийные квасцы NH4Fe(SO4)2*12Н2O.
В исходный анализируемый раствор, содержащий катионы серебра, прибавляют небольшое количество раствора индикатора - соли железа(Ш). При титровании протекает реакция Ag++NCS-=AgNCS↓. В ТЭ все катионы серебра теоретически оттитрованы. Прибавление после ТЭ первой же избыточной порции титранта приводит к образованию тиоцианатных комплексов железа(Ш) красного цвета: Fe3++nNCS-=[Fe(NCS)n]3-n
Адсорбционные индикаторы - такие индикаторы, адсорбция или десорбция которых осадком при осадительном титровании сопровождается изменением окраски в ТЭ или вблизи ее. Индикаторы этого типа - органические вещества, которые адсорбируются осадком в ТЭ и окрашивают его, а до ТЭ - не адсорбируются. Типичные адсорбционные индикаторы - флуоресцеин и эозин:
Эти два индикатора после ТЭ при адсорбции на поверхности образовавшегося при титровании осадка изменяют свой цвет следующим образом:

Флуоресцеин применяется при аргентометрическом определении Cl-, Br-, I-, SCN-. Эозин обычно используется при аргентометрическом определении Br-, I-, SCN-. Помимо флуоресцеина и эозина в качестве адсорбционных индикаторов применяют также ализариновый красный, бромкрезоловый синий, бромфеноловый синий, дифенилкарбазид, дифенилкарбазон, конго красный и другие.
Осаждаемая и гравиметрическая форма