ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.11.2023
Просмотров: 197
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
ОБЩАЯ ХАРАКТЕРИСТИКА И КЛАССИФИКАЦИЯ ФИЗИКОХИМИЧЕСКИХ МЕТОДОВ АНАЛИЗА
Основной закон светопоглощения (Закон БугераЛамбертаБера)
Основные узлы приборов абсорбционной спектроскопии
Основные узлы приборов для эмиссионного спектрального анализа
Качественный эмиссионный спектральный анализ
РЕНТГЕНОСПЕКТРАЛЬНЫЙ МЕТОД АНАЛИЗА
Основные узлы рентгеноспектральных приборов
Количественный рентгеноструктурный анализ
Качественный хроматографический анализ
КОНДУКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
Измерение электропроводности растворов
ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
Измерительная ячейка и электроды потенциометрического ме тода анализа.
Измерительная ячейка и электроды потенциометрического ме тода анализа.
-
Для проведения потенциометрического анализа собирают гальванический эле‐ мент, на одном из электродов которого протекает электрохимическая реакция с участием определяемого иона (см. рисунок 8.3.1).
Исследуемый гальванический элемент обычно состоит из индикаторного электрода и электрода сравнения. Индикаторным называется электрод, потенциал которого зависит от концентрации (активности) определяемого иона. Потенциал электрода сравнениядолжен оставаться постоянным независимо от протекания каких‐либо реакций в анализируемом растворе.
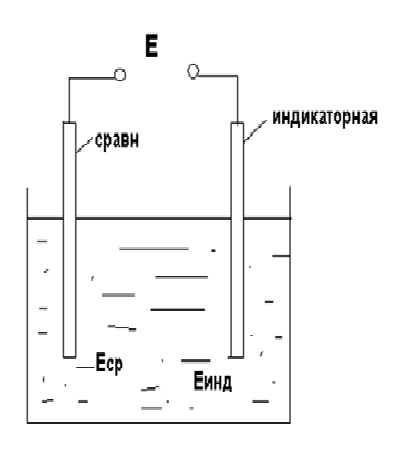 Э.Д.С. исследуемого элемента выражается как разность между потенциалом электрода срав‐ нения Есри потенциалом индикаторного электрода Еинд:
Э.Д.С. исследуемого элемента выражается как разность между потенциалом электрода срав‐ нения Есри потенциалом индикаторного электрода Еинд:Рисунок 8.3.1
Е = Еср — Еинд
Потенциал индикаторного электрода связан уравнением Нернста с концентрации (активностью) определяемого числа.
Индикаторный электрод должен удовлетво‐ рять ряду требований:
-
необходимо, чтобы его потенциал был, воспроизводим, и устанавливался доста‐ точно быстро; -
электрод должен обладать так же определенной химической устойчивостью, что‐ бы не реагировать с другими компонентами анализируемого раствора.
-
Электроды бывают первогои второгорода (см. рисунок 8.3.2).-
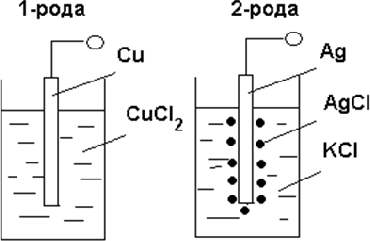 Металлические электроды первого рода представляют собой металлическую проволоку, погру‐ женную в раствор хорошо растворимой соли этого ме‐ талла. Металлические индикаторные электроды изго‐ товляют из различных металлов: серебра, платины, ртути, свинца, золота, кадмия, иридия и др.
Металлические электроды первого рода представляют собой металлическую проволоку, погру‐ женную в раствор хорошо растворимой соли этого ме‐ талла. Металлические индикаторные электроды изго‐ товляют из различных металлов: серебра, платины, ртути, свинца, золота, кадмия, иридия и др. -
Электроды второго рода состоят из метал‐ ла, покрытого слоем малорастворимого соединений этого металла и погруженного в раствор хорошо рас‐
-
Рисунок 8.3.2
творимого соединения с тем же анионом. К ним отно‐ сятся хлорсеребряныйи каломельныйэлектроды. Элек‐
троды второго рода обычно применяют как электроды сравнения.
-
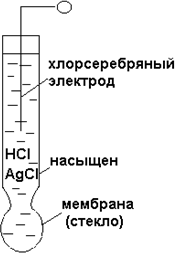 Мембранные электроды. В работе мембранных электродов используется не электрохимическая реакция с переносом электронов, а разность по‐ тенциалов, возникающая на границе раздела фаз, и равновесна об‐ мена ионов между мембраной и раствором. В обычных конструкциях мембранных электродов мембрана разделяет исследуемый раствор и вспомогательный внутренний раствор. Наиболее широко приме‐ няемым электродом этого типа является стеклянный электрод (см. рисунок 8.3.3).
Мембранные электроды. В работе мембранных электродов используется не электрохимическая реакция с переносом электронов, а разность по‐ тенциалов, возникающая на границе раздела фаз, и равновесна об‐ мена ионов между мембраной и раствором. В обычных конструкциях мембранных электродов мембрана разделяет исследуемый раствор и вспомогательный внутренний раствор. Наиболее широко приме‐ няемым электродом этого типа является стеклянный электрод (см. рисунок 8.3.3).-
Электроды сравнения должны обладать устойчивым во времени воспроизводимым потенциалом, не меняющимся при про‐ хождении небольшого тока. В качестве электродов сравнения приме‐
-
Рисунок 8.3.3
няют электроды 2 рода: хлорсеребряныйи каломельный.
Хлорсеребряныйэлектродпредставляет собой (см. рисунок
8.3.4). KAgCl = aAg+ · aCl—, где КAgCl‐ произведение растворимостей. Активность ионов се‐ ребра в таком растворе равно
aAg+ =
KAgCl.
 aCl—
aCl—Тогда уравнение Нернста для серебряного электрода:

 или
илиRT E = E0 + F
RT
 · lnaAg+ = E0 + F
· lnaAg+ = E0 + F· ln
KAgCl aCl—
RT
 = E0 + F
= E0 + FRT
 · lnKAgCl — F
· lnKAgCl — F· lnaCl—

0
E = E'
RT
 — F · lnaCl—.
— F · lnaCl—. Как видно, потенциал хлорсеребряного электрода определяется активностью иона хлора в растворе. Обычно используется насыщен‐ ный раствор КCl.
Как видно, потенциал хлорсеребряного электрода определяется активностью иона хлора в растворе. Обычно используется насыщен‐ ный раствор КCl.Ионоселективные электроды. Решающее влияние на развитие и успехи ионометрического (потенциометрического) метода анализа оказало удачное конструирование ионоселективных электродов на основе различных мембран. Стеклянные ионоселективные электроды чувствительны к ионам щелочным металлов Li+, Na+, K+, Pb+, Cs+, а также к ионам Ag+, Tl+ и NH4+. Устройство и их принцип действия так же, как и у стеклянного pH‐электрода. Наиболее существенным отли‐ чием является состав стекла, из которого готовятся мембраны.
Рисунок 8.3.4
Важной характеристикой ионоселективного электрода является его коэффи‐ циент селективности, показывающий, во сколько раз электрод более чувствителен к
данным ионам, чем к посторонним. Основным достоинством стеклянного электрода является простота работы, применимость в широкой области р[ИОН]. К недостаткам относят хрупкость их конструкции и усложнение ра‐ боты при переходе к сильно щелочным и сильно кислым растворам.

.
Имеющиеся также мембранные электроды ионочувствительный элемент изготовляется из малораство‐ римого кристаллического вещества с ионным характером проводимости. Перенос заряда в таком кристалле происходит за счет дефектов кристаллической решетки. Вакансии могут заниматься ионами только определен‐ ного размера и заряда, что обуславливает высокую селективность кристаллических мембран. Конструктивно такие электроны сходны со стеклянными. Из электродов этого типа широко применяется фторидный электрод, в котором мембраной является монокристалл LаF3 Измеряет концентрацию фторид‐ионов F‐ в области от 10‐6 до 1 моль/л. Имеется также электрод с мембраной из сульфида серебра, пригодной для измерения концентра‐ ции Ag+ и S2+ ионов. Пределы измерения 10‐12…1 моль/л.
- 1 ... 14 15 16 17 18 19 20 21 22
Приборы для измерения ЭДС гальванического элемента
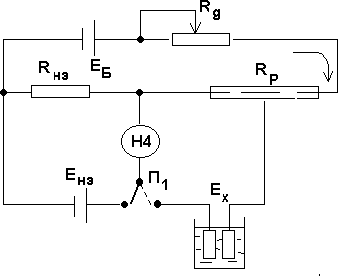 Электродвижущая сила (ЭДС) гальванического эле‐ мента обычно измеряется компенсационным методам. Схема потенциометрической установки:
Электродвижущая сила (ЭДС) гальванического эле‐ мента обычно измеряется компенсационным методам. Схема потенциометрической установки:Рисунок 8.4.1
-
Прямая потенциометрия
Методы прямой потенциометрии основаны на непосредственном применении урав‐ нения Нернста для нахождения активности или концентрации участника электродной реак‐ ции по экспериментально измеренной ЭДС цепи или потенциала электрода. Наибольшее распространение среди прямых потенциометрических методов получил метод определения pH. Прямые потенциометрические методы часто стали называть ионометрическими мето‐ дами анализа или ионометрией.
-
Определение pH.
Под водородным показателем раньше понимали отрицательный десятичный лога‐ рифм молярной концентрации ионов водорода:
pH = —lg[H+].
В настоящее время величина рН считается характеристикойактивностиионовводо‐
рода:
pH = —lg(aH+) = —lg[H+] · fH+,
где aH+‐ активность иона водорода; fH+ ‐ коэффициент активности.
Наибольшее практическое применение в последнее время нашел стеклянный элек‐ трод, используемый в широком интервале pH в присутствии окислителей.
Перед работой стеклянный электрод некоторое время вымачивают в растворе HCl (0,1 м). При этом ионы водорода из раствора обмениваются на ионы натрия из стеклянной мембраны и в системе устанавливается некоторое равновесие. Подготовленный таким обра‐ зом электрод может быть использован для определения pH.
Таким образом, электродная реакция на стеклянном электроде сводится к обмену ио‐ нами водорода между раствором и стеклом:
H+(р — р) — H+(стекло).
Потенциал стеклянного электрода определяется по выражению:


0 H
или
E = Eст + RT · ln(a +) F
E = Eст — 2,303 · RT · pH.
 0 F
0 F

0
0
В величину Eст входит и так называемый потенциал асимметрии, представляющий разность потенциа‐ лов между двумя сторонами стеклянной мембраны. Она возникает из‐за несовпадения свойств разных сторон мембраны и может быть измерено экспериментально, если по обе стороны мембраны поместить один и тот же раствор. Величина Eст зависит также от константы равновесия H+(р‐р)↔ H+(стекло) , характеризующей сорт стекла и некоторые другие свойства стеклянного электрода.

0
Стандартный потенциал стеклянного электрода Eстобычно не определяют. При ис‐ пользовании заводских pH‐ метров эта операция заменяется настройкой приборов по стан‐ дартным буферным растворам, так как шкала pH‐ метров проградуирована непосредствен‐ но в единицах pH. Налажен широкий выпуск промышленных pH‐ метров со стеклянным электродом.
-
Основные приемы ионометрического анализа
Во всех приёмах прямой потенциометрии используется зависимость потенциала инди‐ каторного (обычно ионоселективного) электрода от активности или концентрации опреде‐ ляемого вещества. Активность иона может быть рассчитана по уравнению:

lna = (E — E0 ) · nF, (8.5.1)
м инд инд RT
где Eинд– экспериментально найденный потенциал индикаторного электрода. Величину Eинд находят по ЭДС исследуемого элемента E:
Eинд = Eср — E, (8.5.2)
где Eср – потенциал электрода сравнения. Сочетание