ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.11.2023
Просмотров: 183
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
ОБЩАЯ ХАРАКТЕРИСТИКА И КЛАССИФИКАЦИЯ ФИЗИКОХИМИЧЕСКИХ МЕТОДОВ АНАЛИЗА
Основной закон светопоглощения (Закон БугераЛамбертаБера)
Основные узлы приборов абсорбционной спектроскопии
Основные узлы приборов для эмиссионного спектрального анализа
Качественный эмиссионный спектральный анализ
РЕНТГЕНОСПЕКТРАЛЬНЫЙ МЕТОД АНАЛИЗА
Основные узлы рентгеноспектральных приборов
Количественный рентгеноструктурный анализ
Качественный хроматографический анализ
КОНДУКТОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
Измерение электропроводности растворов
ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
Измерительная ячейка и электроды потенциометрического ме тода анализа.
Кондуктометрическое титрование
Измерения электропроводности растворов широко применяют в титрометрическом анализе для определения точки эквивалентности ТЭ (кондуктометрическое титрование). В методах кондуктометрического титрования измеряют электропроводность раствора после добавления небольших определённых порций титранта и находят точку эквивалентности графическим методом с помощью кривой в координатах æ — V( объём титранта).
 æ
æРисунок 7.4.1
В методе хронокондуктометрического титрования титрант подаётся в анализируемый раствор непре‐ рывно (или небольшими одинаковыми дозами через строго определённые промежутки времени). На диа‐ грамме самописца производится непрерывная запись кондуктометрической кривой в координатах показания прибора ‐ время.
-
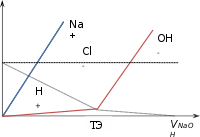
Рассмотрим, как изменяется электропроводность при титровании сильной кисло‐ тыНСl сильнымоснованиемNaOH (см. рисунок 7.4.2). В растворе в любой момент находятся ионы Н+, Cl‐, Na+ и OH‐.
H+Cl– + Na+OH– = Na+Cl– + H2O.
Изменения концентраций ионов при титровании:
 C
CРисунок 7.4.2
Электропроводность будет меняться за счёт увеличения концентрации ионов Na+ и уменьшаться Н+ (см. рисунок 7.4.3). Результирующая этих вкладов АВ показывает резкое уменьшение электропроводности до точки эквивалентности. Падение æ обусловлено уменьшением концентрации иона Н+, имеющего подвижность (при 25°С) 350 См∙см2/моль, что намного превышает подвижность иона Na+ ‐ 50 См∙см2/моль.
 æ
æРисунок 7.4.3
После ТЭ начинается резкий подъём электропроводности (ВС), так как в растворе будет нарастать концентрация ионов Na+ и ОН‐, подвижность которых составляет 199 См∙см2/моль.
-
При титровании слабой кислоты сильным основанием концентрация недиссо‐ циированных молекул кислоты HL монотонно падает практически до нуля (см. рисунки 7.4.4 и 7.4.5):
HL + Na+OH– = NaL + H2O
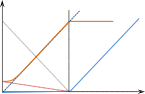 C Na+
C Na+L‐
HL
æ
 OH‐
OH‐H+


ТЭ VNaOH
Рисунок 7.4.4 Рисунок 7.4.5
-
Кондуктометрическим методом могут быть анализированы и сложные смеси, например, смесь сильной и слабой кислоты.
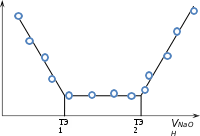 æ
æРисунок 7.4.6
ТЭ1 ‐ соответствуем объёму щёлочи, пошедшей на титрование сильной кислоты. ТЭ2 ‐ соответствует, общему объёму щё‐
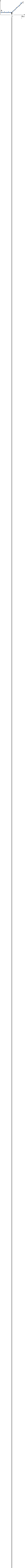 лочи, израсходованный на титрование обеих æ
лочи, израсходованный на титрование обеих æкислот.
-
Вид кривой кондуктометрическо‐ го титрования по методу осаждения; напри‐ мер, для реакции
2AgNO3+ BaCl2—↓2AgCl+ Ba(NO3)2
-
Для кондуктометрического тит‐ рования катионовв качестве титрантов могут
 быть использованы растворы различных ки‐ Рисунок 7.4.7
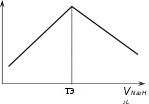
быть использованы растворы различных ки‐ Рисунок 7.4.7слот и окислителей, комплексов. Наибольшее практическое значение имеет кондуктомет‐ рическое титрование катионов двухзамещённой солью этилендиаминтетрауксусной ки‐ слоты (ЭДТА).
При титровании Fe3+ раствором ЭДТА получается, например, кривая:
 æ
æ
Рисунок 7.4.8
- 1 ... 14 15 16 17 18 19 20 21 22
ПОТЕНЦИОМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
-
Общая характеристика метода

3
Большое практическое значение имеют потенциометрические методы определения pH раствора со стеклянным и другими электродами, а также прямые потенциометрические оп‐ ределения концентрации (активности) других ионов с помощью ионоселективных электро‐ дов (ионометрия). Сконструированные ионоселективные электроды на ионы Cu2+, Ag2+, Ag+, Ca2+, Na+, K+, Cl‐, F‐, S2‐, NO ‐ и другие успешно применяют в анализе различных технологиче‐ ских растворов, объектов окружающей среды и т.д.
Другой важной областью применения потенциометрических методов является потен‐ циометрическое титрование кислот, оснований, солей и др. веществ. Потенциометрические методы успешно применяют в анализе мутных и окрашенных растворов и в анализе раство‐ ров на основе смешанных и неводных растворителей.
Основными достоинствами потенциометрического метода является
-
высокая точность; -
высокая чувствительность; -
возможность проводить титрование в более разбавленных растворах, чем это по‐ зволяют визуальные индикаторные методы; -
возможность автоматизации процесса титрования.
-
Теоретические основы потенциометрического метода анализа
Потенциометрический метод основан на зависимости потенциала электрода от состава раствора.
 Если в воду погрузить пластину какого‐либо металла, то на поверхности металла воз‐ никают процессы, приводящие к образованию так называемого двойного электрического слоя (см. рисунок 8.2.1 ).
Если в воду погрузить пластину какого‐либо металла, то на поверхности металла воз‐ никают процессы, приводящие к образованию так называемого двойного электрического слоя (см. рисунок 8.2.1 ).‐
‐
‐
‐
Металл‐
‐
‐
‐
‐
‐
‐
+ +
 + ++
+ +++ +++
+ +++
+ Раствор
+ +++
+ ++
+ +++
+ +++
+ +++
+ +++

+
+ +++
Ионы металла под влиянием полярных молекул воды отрываются от поверхности пла‐ стинки и переходят в раствор. При этом поверх‐ ность металла заряжается отрицательно за счет оставшихся в металле электронов, а слой воды заряжается положительно за счет ионов, кото‐ рые перешли в раствор.
При погружении металла в воду или рас‐ твор его соли через некоторое время скорость растворения металла и скорость осаждения ио‐ нов металла из раствора уравниваются, и возни‐ кает динамическое равновесие, которому отве‐ чает определенный потенциал металла относи‐ тельно водородного электрода, потенциал кото‐ рого принимается за нуль.
Равновесная разность потенциалов, возни‐ кающая на границе металл‐раствор хорошо рас‐
Рисунок 8.2.1
творимой соли данного металла, называется равновесным потенциалом металла (электрода).
Потенциал электрода в растворе зависит от природы металла и концентрации раство‐ ра. Зависимость потенциала электрода от концентрации выражается уравнением Нернста:
E = E0
+ RT lnC,
 nF
nFгде n– заряд иона; F‐ число Фарадея – 96500 ; С‐ концентрация ионов металла в растворе;
E0‐ стандартный электродный потенциал.
Если в раствор, содержащий окислительную и восстановленную форму одного и того же вещества, например Fe2+ и Fe3+, опустить электрод из благородного металла, например Pt или Au, то электрод приобретает потенциал, характерный для данных ионов.
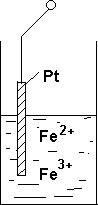 Ионы , находящиеся в растворе, попадая на электрод, способны отдавать или принимать электроны. На поверхности электрода созда‐ ется двойной электрический слой, и электрод при этом заряжается положительно или отрицательно. Например, при Fe3++e‐= Fe2+ элек‐ трод заряжается положительно, а при Cr2+‐ e‐ =Cr3+ электрод приобре‐ тает отрицательный заряд относительно водородного электрода.
Ионы , находящиеся в растворе, попадая на электрод, способны отдавать или принимать электроны. На поверхности электрода созда‐ ется двойной электрический слой, и электрод при этом заряжается положительно или отрицательно. Например, при Fe3++e‐= Fe2+ элек‐ трод заряжается положительно, а при Cr2+‐ e‐ =Cr3+ электрод приобре‐ тает отрицательный заряд относительно водородного электрода.Каждая окислительно‐восстановительная система характеризу‐ ется определенным значением потенциала, который возникает на электроде из металла (золото, платина), погруженного в раствор, со‐ держащий окисленную и восстановленную форму вещества .
Рисунок 8.2.2
Значение окислительно‐восстановительного потенциала зависит от природы и концентрации окисленной и восстановленной формы и
может быть определено по формуле:
E = E
+ RT · ln [Ok] ,

0 nF

[Восс]
где E0‐ стандартный окислительно‐восстановительный потенциал системы; [Ок]‐ концентра‐
ция окисленной формы ионов; [Восс]‐концентрация восстановительной формы ионов.
Следует отметить, что процессы, протекающие в системе “электрод‐раствор” сложные и не все ионы участвуют в создании скачка потенциала. Поэтому говорят не о концентрации ионов, а об активности ионов. Тогда
E = E
+ RT ln aок
= E + RT ln [Ок]fок

0 nF

авосс

0 nF

[Восс]fвос
аок, aвосс‐ активности соответственно окисленной и восстановленной формы ионов; fок, fвосс‐ коэффициенты активности.
Подставляя T=298,15 °С и числовые значения констант получим для 25°С:
E = E
+ 0,059 lg [Ок]fок .


0 n [Восс]fвос