Файл: Спецификация суммативного оценивания за четверть по предмету Химия 10 класс.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.11.2023
Просмотров: 479
Скачиваний: 16
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
1.Цель суммативного оценивания за четверть
2.Документ, определяющий содержание суммативного оценивания за четверть
3.Ожидаемые результаты по предмету «Химия»
4.Уровни мыслительных навыков по предмету «Химия», 10 класс
5.Распределение проверяемых целей по уровням мыслительных навыков в разрезе
6.Правила проведения суммативного оценивания
7.Модерация и выставление баллов
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА ЧЕТВЕРТЬ
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 2 ЧЕТВЕРТЬ
23
| | 10.2.2.2 расчеты по уравнениям химических реакций с участием металлов, с реагентами, имеющими примеси, а также на практический выход продукта от теоретически возможного; | Применение | 1 | 9 | РО | 4 | 4 | |
| Итого: | | | | | | 40 | 30 | 30 |
| Примечание: * - разделы, в которые можно вносить изменения | | | | | | | ||
24
Образец заданий и схема выставления баллов Задания суммативного оценивания за 3 четверть по предмету «Химия»
1. В таблице приведены температуры плавления и кипения элементов первой группы: лития, натрия и калия.
-
Элемент
Температура плавления (ОС)
Температура кипения (ОС)
Литий
180
1330
Натрий
98
890
Калий
64
774
Рубидий
-
-
Используя информацию, определите температуру плавления и кипения рубидия.
| А 19 и 810 | В 39 и 688 | С 73 и 620 | D 124 и 1498 |
Ответ: ________________________
Объясните ваш ответ.
_________________________________________________________________________
_________________________________________________________________________
[2]
Предположите сколько электронов находится на внешнем энергетическом уровне атома рубидия.
___________________________________________________________________________ [1]
Расположите элементы 1 группы (цезий, литий, калий, рубидий и натрий) в порядке по взаимодействию с водой. Начните ряд с самого менее реакционного.
___________________________________________________________________________ [1]
-
Составьте возможные сбалансированные уравнения химических реакций алюминия со следующими веществами:
1) Сульфат магния 2) Хлорид калия
-
Нитрат меди (II) -
Соляная кислота
Напишите сбалансированные уравнения реакции, подтверждающие ваш выбор.
-
__________________________________________________________________________ -
__________________________________________________________________________
[2]
-
Ежегодно во всём мире тысячи людей погибают от воздействия токсичных металлов.
-
Назовите два токсичных тяжёлых металла:
[1]
-
Назовите два вредных воздействия тяжелых металлов на организм человека.
_________________________________________________________________________
_________________________________________________________________________
[1]
-
Назовите два способа попадания тяжелых металлов в организм человека.
________________________________________________________________________
________________________________________________________________________
[2]
-
Заполните наблюдения и запишите выводы по качественному определению ионов металлов.
| Тест на катион | Наблюдения | | Выводы |
| Внесли в пламя нихромовую проволочку, смоченную в растворе А | Пламя окрасилось фиолетовый цвет | в | |
| Внесли в пламя нихромовую проволочку, смоченную в растворе В | | | В соли присутствует катион натрия |
| Внесли в пламя нихромовую проволочку, смоченную в растворе С | | | В соли присутствует катион кальция |
[3]
-
Одним из распространенных соединений водорода является вода. Вода в природе бывает жесткой и мягкой. Опишите, как в домашних условиях можно устранить временную жесткость воды. Напишите соответствующее уравнение химической реакции.
__________________________________________________________________________ [1]
-
(a) Даны формулы соединений железа: Fe(OH)2, Fe, FeSO4, FeO. Составьте генетический ряд железа.
___________________________________________________________________________ [1]
-
Напишите уравнение реакции получения гидроксида железа (II) из сульфата железа
(II).
___________________________________________________________________________ [1]
-
Рассчитайте количества вещества и массу осадка, если в реакцию вступило 20 г раствора сульфата железа (II), с массовой долей 10%
[3]
-
Учащийся добавил гидроксид натрия в пробирки с неизвестными веществами № 1, 2, 3 и 4. В результате,
в первой пробирке образовался осадок голубого цвета
во второй – белый студенистый осадок, растворимый в избытке гидроксида натрия в третьей – бурый осадок в четвертой – осадок не образовался.
Назовите, соли каких металлов находились в пробирках под номерами 1, 2, 3 и 4.
-
____________________________________, 2 - _______________________________
3- ____________________________________, 4 - _______________________________
[4]
-
На рисунке представлен эксперимент по коррозии железа. Объясните, в каком из стаканов коррозия протекает сильнее, а в каком слабее.
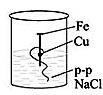
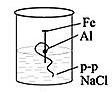
1 2
Сформулируйте вывод о влиянии металлов разной активности на коррозию железа.
___________________________________________________________________________
___________________________________________________________________________
___________________________________________________________________________
[3]
-
12 кг оксида кремния с массовой долей примесей 8% восстанавливают магнием по уравнению реакции SiO2 + 2Mg →2MgO + Si. Какова масса полученного кремния, если выход кремния от теоретически возможного равен 65%?
[4]
Схема выставления баллов
| № | Ответ | Балл | Дополнительная информация | ||||||||||||
| 1 | В Температуры кипения и плавления уменьшаются в группе металлов сверху вниз 1 электрон находится на внешнем энергетическом уровне, так как рубидий находиться в первой группе литий, натрий, калий, рубидий, цезий | 1 1 1 1 | | ||||||||||||
| 2 | 2Al + 3Cu(NO3)2 = 2Al(NO3)3 + 3Cu 2Al + 6HCl = 2AlCl3 + 3H2 | 1 1 | | ||||||||||||
| 3 | Два тяжелых металла Угнетение ЦНС, тошнота, рвота, спутанность сознания, головная боль и т.д. Пути поступления тяжелых металлов в организм: с продуктами питания, через дыхательные пути и т.д. Могут указать: с рыбой, с растительными продуктами и т.д. | 1 1 2 | Могут быть названы любые два металла, например, медь, олово, цинк, кадмий и др. Могут быть названы два любых отрицательных воздействия. Засчитываются любые два правильных ответа. | ||||||||||||
| 4 |
| 3 | 1 балл – за каждую верно заполненную ячейку | ||||||||||||
| 5 | Гидрокарбонаты разлагаются при высокой температуре/ кипячении Са(НСО3)2 → СаО + Н2О + СО2 или Mg(НСО3)2 → Mg(OH)2 + 2СО2 | 1 | | ||||||||||||
| 6 | Fe → FeO → FeSO4 → Fe(OH)2 → FeO → Fe | 1 | | ||||||||||||
| 6 | FeSO4 + 2NaOH → Fe(OH)2 + Na2SO4 | 1 | | ||||||||||||
| m(FeSO4) = 20 г*0,1 = 2 г n(FeSO4) = 0.013 моль n(Fe(OH)2) = 0.013 моль m(Fe(OH)2) = 0,013 * 90 = 1,17 г | 1 1 1 | | |||||||||||||
| 7 | 1– соль меди (II),
| 4 | 1 балл – за каждую пробирку | ||||||||||||
| 8 | В первом стакане железный гвоздь подвергается коррозии меньше, так медь менее активный металл, чем железо. Во втором стакане железный гвоздь подвергается коррозии больше, так как алюминий более активный металл, чем железо. Вывод | 1 1 1 | | ||||||||||||
| 9 | m(примесей) = 12 кг * 0.08 = 0,96 кг m(SiО2) = 11.04 кг n(SiО2) = 0.184 кмоль n(Si) = 0.184 кмоль m(Si) теор = 5,152 кг m(Si) практ = η * m(Si) теор /100 = 65*5,152/100 = 3,35 кг | 1 1 1 1 | | ||||||||||||
| Итого | 30 | | |||||||||||||
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 4 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 4 четверть
Продолжительность – 40 минут Количество баллов – 30
Типы заданий:
МВО – задания с множественным выбором ответов; КО – задания, требующие краткого ответа;
РО – задания, требующие развернутого ответа.
Структура суммативного оценивания
Данный вариант состоит из 10 заданий, включающие вопросы с множественным выбором ответов, требующие краткого и развернутого ответов.
В вопросах с множественным выбором ответов обучающийся выбирает правильный ответ из предложенных вариантов ответов.
В вопросах, требующих краткого ответа, обучающийся записывает ответ в виде численного значения, слова или короткого предложения.
В вопросах, требующие развернутого ответа, обучающийся должен показать всю последовательность действий в решении заданий для получения максимального балла. Оценивается способность обучающегося выбирать и применять математические приемы в ряде математических контекстов. Задание может содержать несколько структурных частей/ вопросов.
Характеристика заданий суммативного оценивания за 4 четверть
-
Раздел
Проверяемая цель
Уровень мыслительны х навыков
Кол. заданий
*
№
задания
*
Тип задания
*
Время на выполнение
, мин*
Балл *
Балл за раздел
10.4А
Важнейшие р-элементы и их
соединения
10.2.1.32 изучить амфотерные свойства оксида и гидроксида алюминия;
Знание и понимание
1
1
МВО
1
1
16
10.4.1.8 анализировать воздействие оксидов азота на атмосферу, нитратов на почву и водные ресурсы;
Навыки высокого порядка
1
2
РО
4
3
10.2.1.40 сравнивать свойства разбавленной и концентрированной серной
кислоты;
Применение
1
3
МВО
3
2
10.2.1.41 объяснять закономерности изменения физических и химических
свойств галогенов в группе;
Применение
2
4,5
КО
6
5
10.2.1.44 составлять план эксперимента по определению анионов и осуществлять его на практике;
Навыки высокого порядка
1
6
РО
6
5
10.4B
Производств
о
неорганичес ких соединений и сплавов
10.2.3.10 описывать способы получения и свойства чугуна и стали;
Знание и понимание
1
7
КО
3
2
14
10.2.1.45 описывать контактный процесс промышленного производства серной кислоты и знать ее значение для
промышленности;
Применение
1
8
РО
4
3
10.2.1.46 описывать способы промышленного производства
Применение
1
9
КО
6
5