Файл: Спецификация суммативного оценивания за четверть по предмету Химия 10 класс.doc
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 23.11.2023
Просмотров: 459
Скачиваний: 15
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
1.Цель суммативного оценивания за четверть
2.Документ, определяющий содержание суммативного оценивания за четверть
3.Ожидаемые результаты по предмету «Химия»
4.Уровни мыслительных навыков по предмету «Химия», 10 класс
5.Распределение проверяемых целей по уровням мыслительных навыков в разрезе
6.Правила проведения суммативного оценивания
7.Модерация и выставление баллов
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА ЧЕТВЕРТЬ
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 2 ЧЕТВЕРТЬ
| | 10.2.1.5 прогнозировать свойства химических элементов и их соединений по положению в периодической системе; | Навыки высокого порядка | 1 | 8 | РО | 4 | 5 | |
| 10.1C Химическая связь и строение вещества | 10.1.4.3 составлять диаграмму Льюиса для молекул H2, Cl2, O2, N2, HCl, NH3; | Применение | 1 | 9 | РО | 3 | 2 | 10 |
| 10.1.4.5 объяснять зависимость свойств веществ от электронного и пространственного строения молекул на примере BF3, CH4, NH3, H2O, ВеСl2; | Применение | 1 | 10 | РО | 4 | 2 | ||
| 10.1.4.8 составлять диаграмму Льюиса для соединений NaCl, CaO, MgF2, KH; | Применение | 1 | 11 | РО | 3 | 2 | ||
| 10.1.4.11 прогнозировать свойства соединений с различными видами связей и типами кристаллических решеток; | Навыки высокого порядка | 1 | 12 | РО | 4 | 4 | ||
| Итого: | | | | | | | 30 | 30 |
| Примечание: * - разделы, в которые можно вносить изменения | | | | |||||
8
Образец заданий и схема выставления баллов
Задания суммативного оценивания за 1 четверть по предмету «Химия»
-
Определите верное(-ые) утверждения для описания s – орбитали.
-
s-орбитали имеют шарообразную форму -
у атома водорода электроны находятся только на s – орбиталях. -
s- и р- орбитали имеют одинаковую форму
-
1 -
1 и 2 -
2 -
1 и 3
[1]
-
Напишите значения главного квантового и орбитального числа для атома с электронной конфигурацией 2,8,1 n = l =
[2]
-
Установите соответствие между электронной формулой и названиями элементов.
-
Электронная формула элемента
Название элемента
-
ns2
-
ns2np2
-
ns2np5
A) Магний
В) Хлор
С) Углерод-
Кальций -
Кремний -
Фтор -
Бериллий -
Фосфор
-
Ответ:
-
1.
2.
3.
[3]
-
Вычислите формулу соединения, в котором массовая доля калия составляет 56,5%, углерода – 8,7%, кислорода – 34,8%.
[3]
-
В результате распада атом смещается на 2 клетки к началу таблицу элементов, т.е. заряд ядра Z уменьшается на 2.
(a) Назовите тип распада. _____________________________________________________
[1] (b) Напишите уравнение радиоактивного распада элемента 12150????????.
___________________________________________________________________________
[1]
-
На примере элементов 2 группы покажите закономерность изменения следующих свойств:
-
радиус атома:
___________________________________________________________________________
[1]
-
число электронов на внешнем слое атома:
___________________________________________________________________________
[1] (с) энергия ионизации:
___________________________________________________________________________
[1]
-
Кислотные свойства высших оксидов усиливаются в ряду-
цезий, цинк, кремний -
алюминий, бериллий, стронций -
фосфор, азот, мышьяк -
германий, цинк, калий
-
[1]
-
Литий (Li), натрий (Na), калий (К), рубидий (Rb), цезий (Cs) и франций (Fr) относятся к щелочным металлам, которые расположены в І группе периодической системы. Металлические свойства сверху вниз по группе увеличиваются.
Спрогнозируйте физические и химические свойства цезия (укажите по два свойства). Физические свойства:
___________________________________________________________________________
[1]
Химические свойства
___________________________________________________________________________
___________________________________________________________________________
[2]
Напишите подтверждающие уравнения реакции:
___________________________________________________________________________
___________________________________________________________________________
[2]
-
Нарисуйте диаграмму «точек и крестов», показывая внешние электроны и заряды аммиака.
[2]
-
Объясните, почему метан — это газ (при комнатной температуре), основываясь на электронном и пространственном строении молекулы.
| Электронное строение молекулы | Пространственное строение молекулы |
| | |
[1]
___________________________________________________________________________
[1]
-
Нарисуйте диаграмму «точек и крестов» молекулы оксида кальция, показывая внешние электроны.
[2]
-
В таблице показаны некоторые физические константы веществ А - D.
Температура плавления, 0С
Электропроводность в твердом состоянии
Электропроводность расплава
A
1418
плохая
хорошая
B
1536
хорошая
хорошая
C
650
хорошая
хорошая
D
–115
плохая
плохая
A
1418
плохая
хорошая
-
Укажите, какое из веществ является железом.
-
Объясните, как вы пришли к этому выводу. железо – это вещество _____________________________________________________ объяснение ______________________________________________________________
[2]
-
Укажите, какое из веществ является хлороводородом.
Объясните, как вы пришли к этому выводу.
хлороводород – это вещество _______________________________________________ объяснение ______________________________________________________________
[2]
Схема выставления баллов
| № | Ответ | Балл | Дополнительная информация |
| 1 | В | 1 | |
| 2 | n = 3 l = 0,1,2 | 2 | |
| 3 |
| 1 1 1 | по 1 баллу за каждое верное соответствие |
| 4 | n(K) = 1,44 моль n(С) = 0,725 моль n(О) = 2,175 моль К:С:О = 2:1:3 К2СО3 | 3 | 1б – за расчет кол-ва атомов 1б – за верное соотношение 1б – за формулу |
| 5 | α - распад 121???????? →11748???????? + 42???????? 50 | 1 1 | |
| 6 | Радиус атома в группе сверху вниз увеличивается Число электронов на внешнем слое атома – в группе не изменяется Энергия ионизации сверху вниз в группе уменьшается | 1 1 1 | |
| 7 | А | 1 | |
| 8 | Физическая свойства: Очень мягкий; Очень низкая температура плавления; Имеет желтоватый цвет; Хорошо проводит электричество; Химическая свойства: Очень активный, поэтому хранится под слоем керосина; с водой реагирует со взрывом; горит на воздухе со взрывом 2Cs + 2H2O = 2CsOH + H2; 4Cs + O2 = 2Cs2O; | 1 2 1 1 | 1 балл – за два верных физических свойства металла 1 б – за каждое спрогнозированное химическое свойство 2б – за два уравнения реакции |
| 9 | 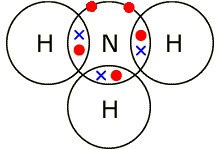 | 2 | 1 балл за внешние электроны; 1 балл за правильное расположение электронных пар |
| 10 |  Метан имеет тетраэдрическое строение и молекулярную кристаллическую решетку, где в узлах находятся отдельные молекулы вещества. Связи между молекулами значительно длиннее, связь слабее, поэтому это вещество газообразное. | 2 | 1 балл – за электронное и пространственное строение 1 балл – за объяснение |
| 11 | 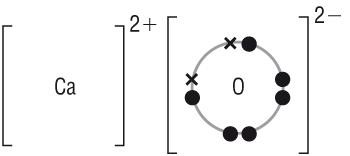 | 2 | 1 балл за внешние электроны; 1 балл за указание зарядов; |
| 12 | В, учащийся объясняет свой выбор с позиции строения вещества и кристаллической решетки D, учащийся объясняет свой выбор с позиции строения вещества и кристаллической решетки | 2 2 | 1 балл за указание вещества 1 балл за объяснение |
| | Итого | 30 | |
СПЕЦИФИКАЦИЯ СУММАТИВНОГО ОЦЕНИВАНИЯ ЗА 2 ЧЕТВЕРТЬ
Обзор суммативного оценивания за 2 четверть
Продолжительность – 40 минут Количество баллов – 30
Типы заданий:
МВО – задания с множественным выбором ответов; КО – задания, требующие краткого ответа;
РО – задания, требующие развернутого ответа.
Структура суммативного оценивания
Данный вариант состоит из 9 заданий, включающие вопросы с множественным выбором ответов, требующие краткого и развернутого ответов.
В вопросах с множественным выбором ответов обучающийся выбирает правильный ответ из предложенных вариантов ответов.
В вопросах, требующих краткого ответа, обучающийся записывает ответ в виде численного значения, слова или короткого предложения.
В вопросах, требующие развернутого ответа, обучающийся должен показать всю последовательность действий в решении заданий для получения максимального балла. Оценивается способность обучающегося выбирать и применять математические приемы в ряде математических контекстов. Задание может содержать несколько структурных частей/вопросов.
Характеристика заданий суммативного оценивания за 2 четверть
| Раздел | Проверяемая цель | Уровень мыслительны х навыков | Кол. заданий* | № задания* | Тип задания* | Время на выполнение , мин* | Балл * | Балл за раздел |
| 10.2A Закономе рности химическ их реакции | 10.2.3.2 уметь составлять окислительные и восстановительные уравнения, используя метод электронного баланса; | Применение | 1 | 1 | КО | 3 | 2 | 17 |
| 10.2.3.4 прогнозировать продукты электролиза, образующихся на электродах в растворах и расплавах электролитов; | Навыки высокого порядка | 1 | 2 | КО | 4 | 4 | ||
| 10.2.3.5 уметь составлять схемы процессов электролиза расплавов и растворов; | Применение | 1 | 3 | КО | 4 | 2 | ||
| 10.2.3.6 уметь рассчитывать массу, объем (газа) продуктов электролиза; | Применение | КО | 4 | 3 | ||||
| 10.3.4.2 предсказывать среду раствора соли по её качественному составу; | Навыки высокого порядка | 1 | 4 | КО | 6 | 4 | ||
| 10.3.1.3 уметь рассчитывать тепловой эффект химической реакции; | Применение | 1 | 5 | КО | 3 | 2 | ||
| 10.2 В Кинетика | 10.3.2.2 объяснять влияние факторов на изменение скорости химических реакций; | Знание и понимание | 1 | 6 | МВО | 2 | 1 | 9 |
| 10.3.2.3 уметь рассчитывать изменение скорости реакции при изменении концентрации реагирующих веществ и температуры; | Применение | 1 | 7 | РО | 3 | 3 | ||
| 10.3.2.5 объяснять механизм гомогенного и гетерогенного катализа; | Знание и понимание | 1 | 8 | РО | 5 | 5 |