ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 332
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
Молярные доли частиц будут равны:
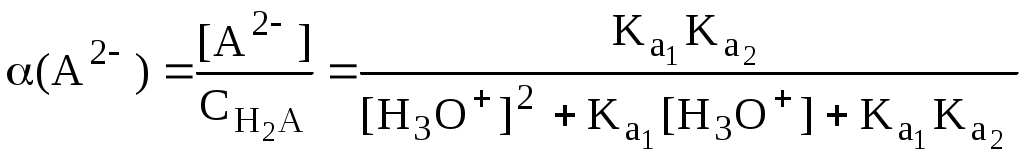
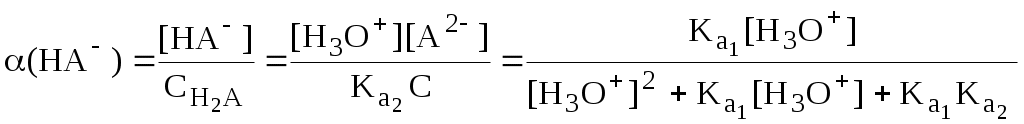
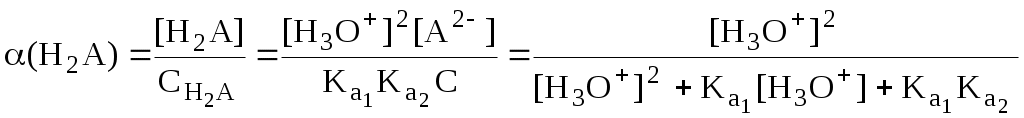
В общем виде формула для расчёта молярной доли частицы
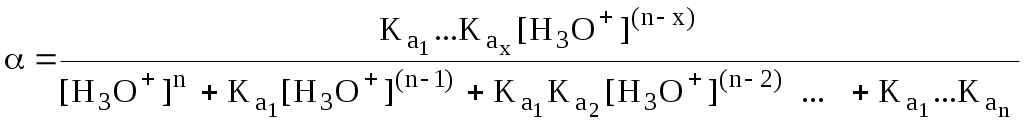
Для одноосновной кислоты
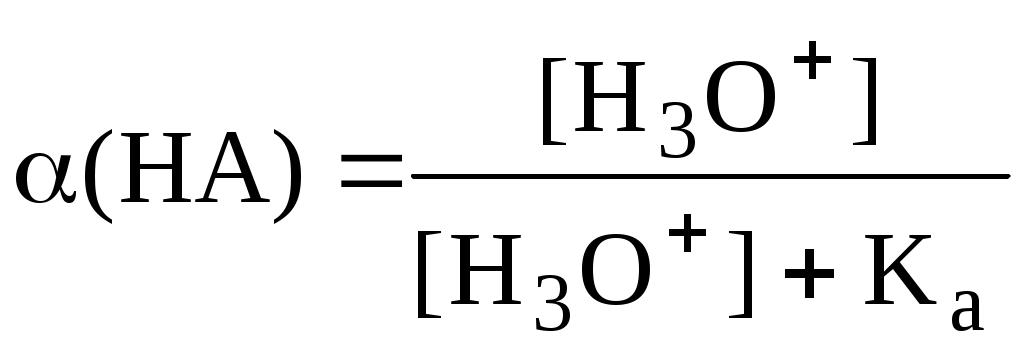
С учётом того, что
Из данных формул следует, что при рН = pKa (HA) = (A-) = 0,5. Если рН превышает рKa на 1, то молярная доля А- в 10 раз больше, чем HA, если на 2 - то в 100 раз, на 3 - в 1000 и т.д. При уменьшении рН аналогичным образом увеличивается (HA) (рис. 4.3).
Если значения Ka для некоторой многоосновной кислоты отличаются друг от друга на 4 и более порядка, то можно считать, что при любом значении рН в равновесной смеси будут присутствовать только два вида частиц, а концентрация остальных пренебрежимо мала. Например, если необходимо рассчитать молярную долю молекул H3PO4 (pKa1 = 2,15; pKa2 = 7,21) при рН 3, то можно принять, что в равновесной смеси присутствуют только частицы H3PO4 и H2PO4-.Рассчёт можно провести по той же формуле, что и для одноосновной кислоты.
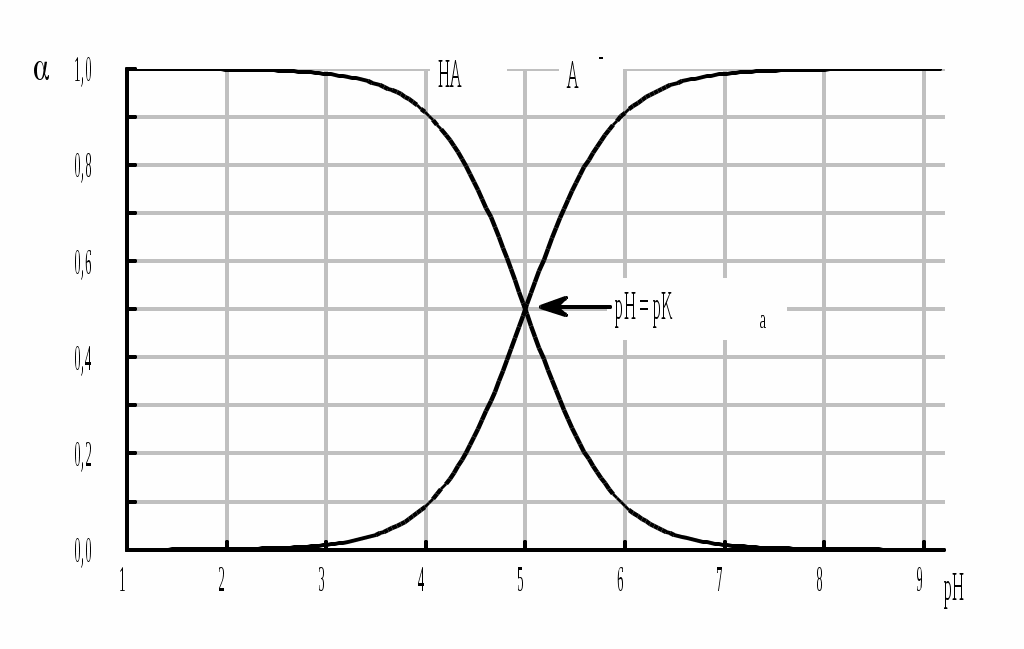
Рис. 4.3. Распределительная диаграмма для слабой кислоты (pKa = 5)
Пример 4.5. Рассчитать [NH3] в растворе с общей концентрацией аммиака 0,10 моль/л при рН 7,0.
6,310-3
4.7. Кислотно-основные буферные растворы
Буферными растворами, в широком смысле слова, называют системы, поддерживающие определённое значение какого-либо параметра (рН, потенциала системы, концентрации катионов металла), при изменении состава системы.
Кислотно-основным называется буферный раствор, сохраняющий примерно постоянным значение рН при добавлении к нему не слишком больших количеств сильной кислоты или сильного основания, а также при разбавлении или концентрировании.
Кислотно-основные буферные растворы содержат (в не слишком малых количествах) слабые кислоты и сопряжённые с ними основания.
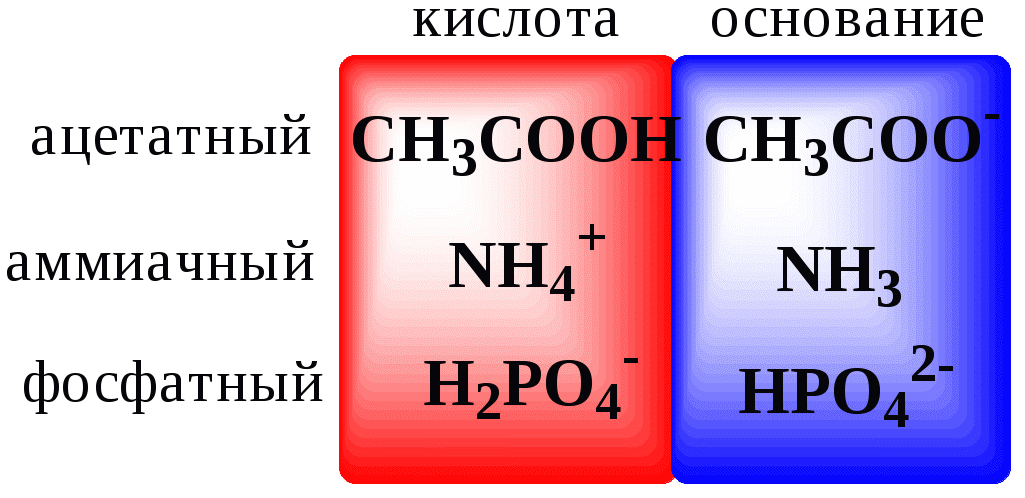
Причина буферного действия таких растворов заключается в следующем.
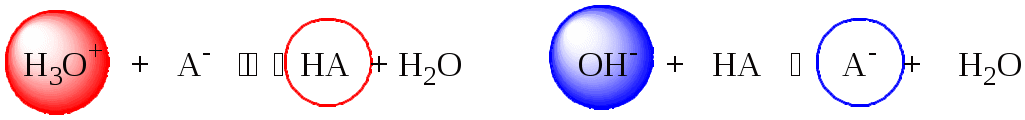
Сильная кислота при добавлении к буферному раствору «превращается» в слабую кислоту, а сильное основание - в слабое основание. Следовательно, заметного изменения рН раствора при этом не происходит.
Формулу для расчёта рН буферного раствора можно получить следующим образом.
Будем считать, что
Полученное уравнение называется уравнением Гендерсона - Хассельбаха. Из этого уравнения следует что, что рН буферного раствора зависит от отношения концентраций слабой кислоты и сопряжённого с ней основания и поэтому незначительно изменяется при разбавлении (или концентрировании).
Разбавление, само собой, не может быть безграничным. При значительном разбавлении рН раствора изменится, так как, во-первых, концентрации компонентов станут такими малыми, что нельзя будет пренебречь автопротолизом воды, во-вторых, коэффициенты активности незаряженных и заряженных частиц по-разному зависят от ионной силы.
Пример 4.6. Рассчитать рН растворов, полученных 1) при смешивании 100 мл 0,10 М HCOOH и 200 мл 0,10 М HCOONа; 2) 200 мл 0,10 М NH3 и 100 мл 0,10 М HCl.
Вместо концентрации в уравнение Гендерсона-Хассельбаха могут быть подставлены количества кислоты и основания или объёмы их растворов (если концентрация растворённых веществ в последних одинакова)
1)
Способность буферного раствора сопротивляться изменению рН зависит от соотношения концентраций слабой кислоты и сопряжённого с ней основания, а также от их суммарной концентрации в растворе и характеризуется буферной ёмкостью.
Буферной ёмкостью ( или ) называют отношение бесконечно малого увеличения концентрации сильной кислоты или сильного основания в растворе (без изменения его объёма) к вызванному этим увеличением изменению рН.
Буферную ёмкость раствора можно рассчитать по следующим уравнениям:
На рис. 4.4. приведён пример зависимости β от рН.
В сильнокислой и сильнощелочной среде буферная ёмкость значительно увеличивается. Растворы, в которых достаточно высока концентрация сильной кислоты или сильного основания, также обладают буферными свойствами, причём даже в большей степени, чем растворы, традиционно рассматриваемые в качестве «буферных». Для растворов сильных кислот = 2,3[H3O+], для растворов сильных оснований = 2,3[OH-].
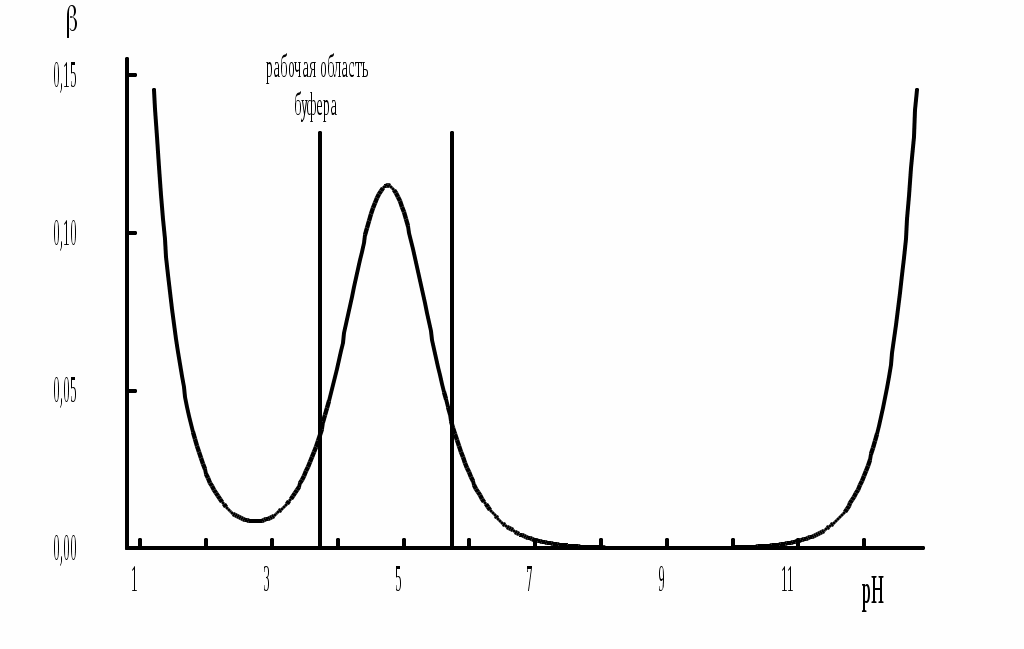
Рис. 4.4. Зависимость буферной ёмкости 0,2 М ацетатного буферного раствора от рН
Буферная ёмкость максимальна при рН = рКa и составляет 2,3·0,5·0,5 Cбуф = 0,575Cбуф. Для поддержания некоторого значения рН следует использовать такой буферный раствор, у которого величина рКa входящей в его состав слабой кислоты находится как можно ближе к этому рН.
Буферный раствор имеет смысл использовать для поддержания рН, находящегося в интервале рКa 1. Такой интервал называется рабочей областью буфера. Например, рабочая область рН для ацетатного буферного раствора составляет примерно 3,8 - 4,8. Совершенно бессмысленно использовать такой буферный раствор для рН, например, 9.
Пример 4.7. Рассчитать буферную ёмкость формиатного буферного раствора, упомянутого в примере 4.6. Каким станет рН этого раствора, если к 1 л его добавить 5,010-3 моль сильной кислоты?
ГЛАВА 5
5.1. Понятие о комплексном соединении
Чаще всего комплексом называют частицу, образованную в результате донорно-акцепторного взаимодействия атома (иона), называемого центральным атомом (ионом), или комплексообразователем, и заряженных или нейтральных частиц (лигандов). Комплексообразователь и лиганды должны быть способны к самостоятельному существованию в среде, где происходит реакция комплексообразования.
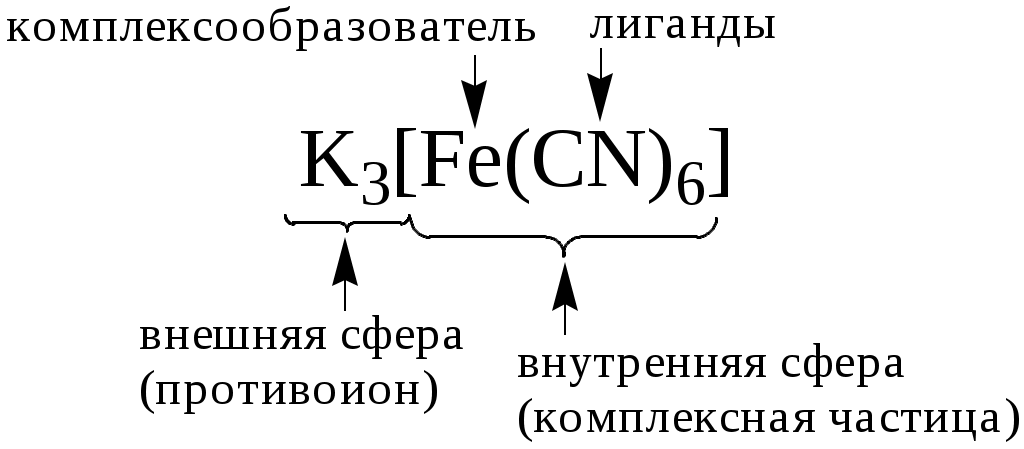
Реакцию комплексообразования можно рассматривать как реакцию взаимодействия кислоты и основания Льюиса.
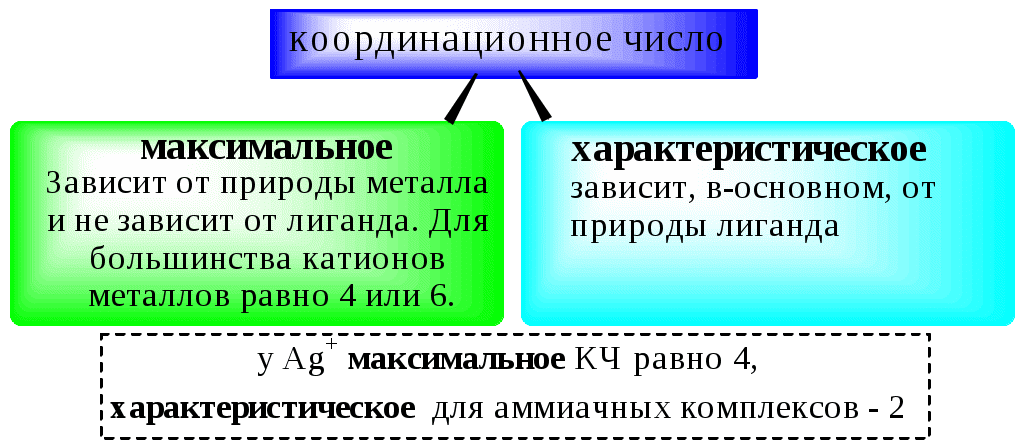
Количественной характеристикой способности комплексообразователя и лиганда участвовать в донорно-акцепторном взаимодействии при образовании комплексной частицы являются, соответственно, координационное число и дентатность.
Дентатностью лиганда называется число донорных центров (неподелённых электронных пар либо -связей) лиганда, участвующих в донорно-акцепторном взаимодействии при образовании комплексной частицы.
Лиганды бывают:
монодентатными (Cl-, H2O, NH3),
бидентатными (C2O42-, этилендиамин, 1,10-фенантролин)
...
полидентатными.
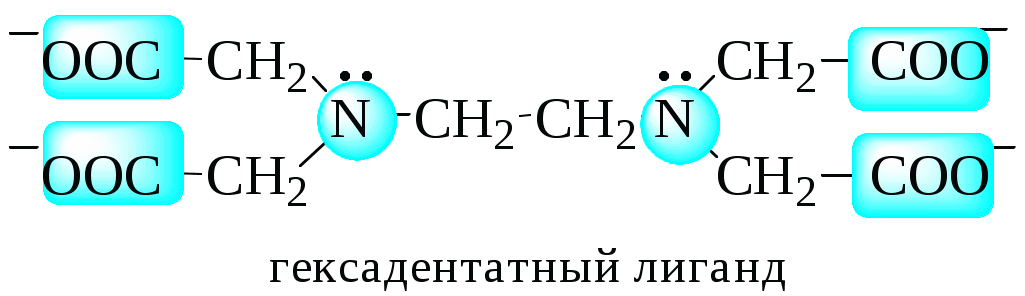
Координационным числом называется число донорных центров лигандов, с которыми взаимодействует данный центральный атом (ион).
5.2. Классификация комплексных соединений
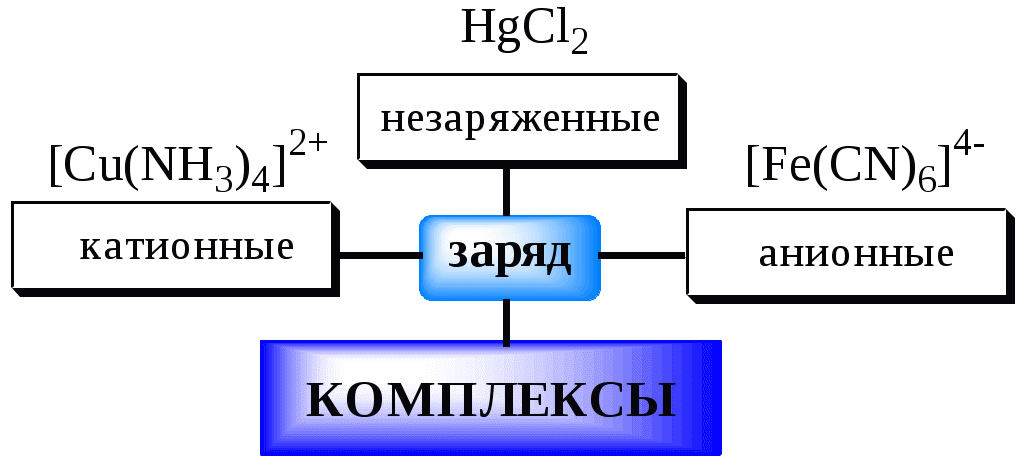
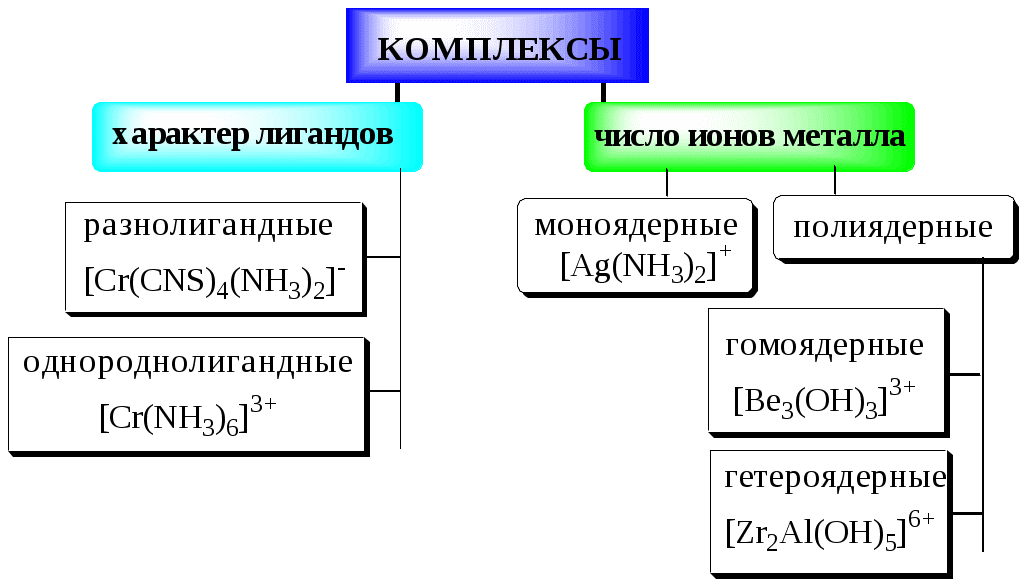
Соединения, образующиеся при взаимодействии насыщенных по координационному числу внутрисферных комплексов и любых частиц, находящихся во внешней сфере, называются
