ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 331
Скачиваний: 1
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
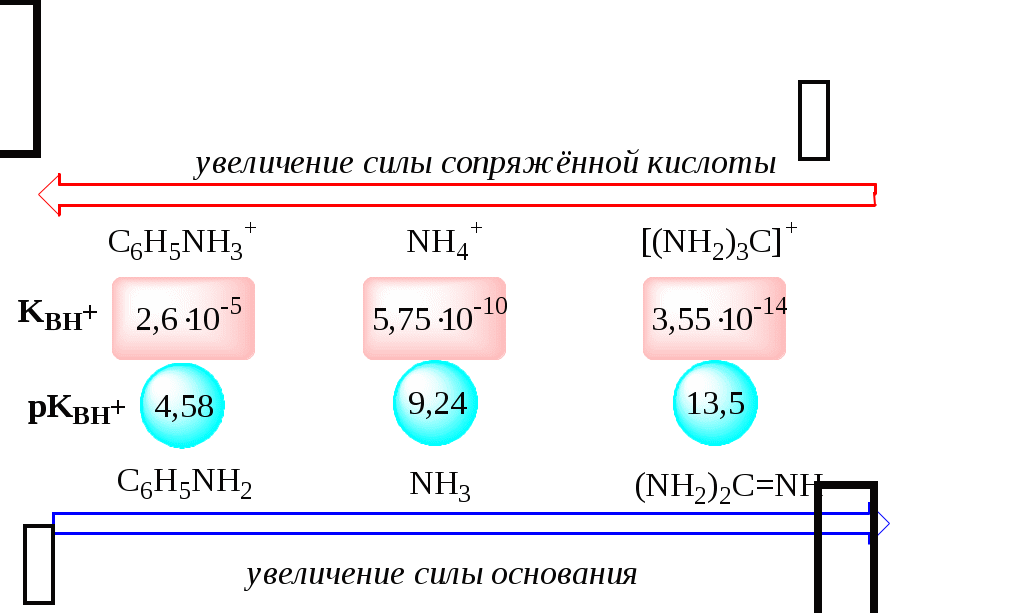
Обозначения KBH+ и Ka равнозначны между собой. Первый из них мы в дальнейшем будем использовать в тех случаях, когда речь идёт о характеристике силы основания через сопряжённую с ним кислоту. Это особенно удобно в случае сложных органических молекул, содержащих несколько кислотных и основных центров.
4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
Кислотно-основные свойства растворителя
Сила кислоты зависит от природы взаимодействующего с ней основания, а сила основания - от взаимодействующей с ним кислоты. Например, первичный амин в воде является более слабым основанием, чем в уксусной кислоте.

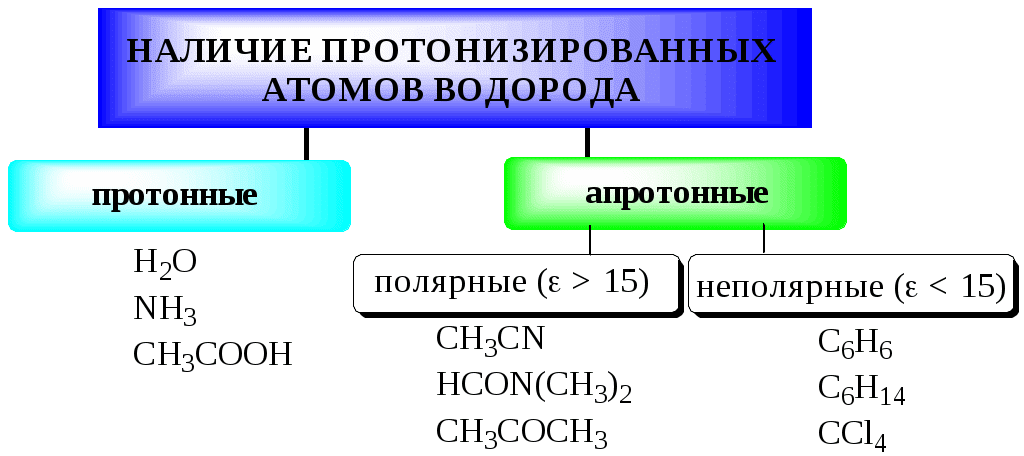
Протонизированным называют атом водорода, связанный с атомом сильно электроотрицательного элемента и способный легко отщепляться от молекулы в виде протона (поэтому иногда его называют «подвижным»).
В зависимости от кислотно-основных свойств растворители бывают:
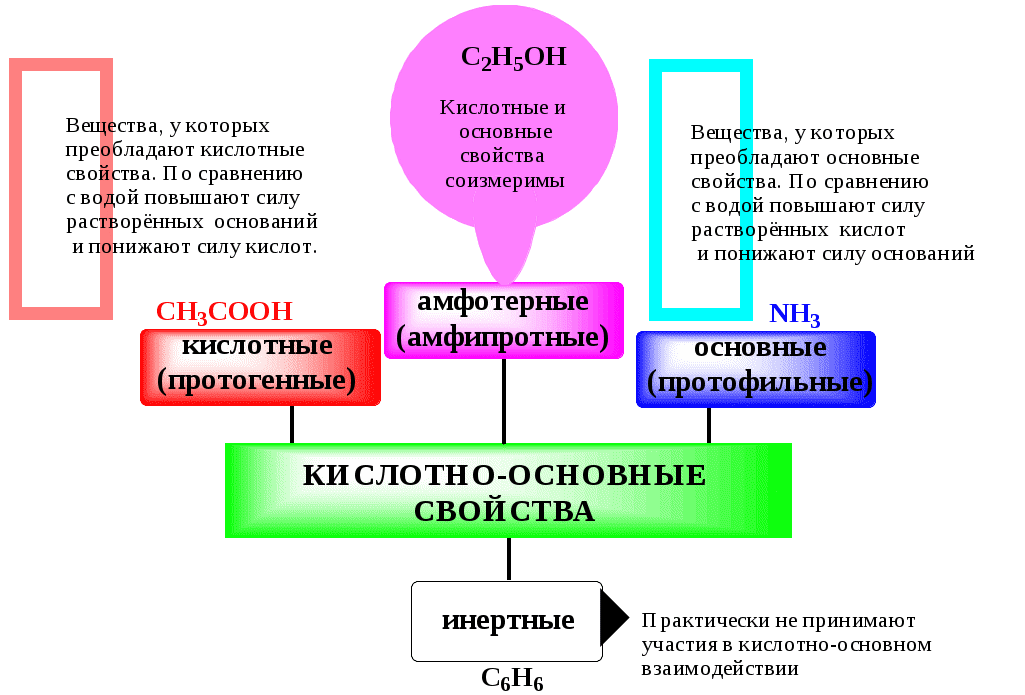
Протонные растворители могут относиться как к кислотным (уксусная кислота), так и к основным (аммиак) или амфотерным растворителям (вода). Одни из представителей полярных апротонных растворителей, например, диметилформамид, обладают основными свойствами, другие (кетоны, ацетонитрил, диметилсульфоксид), а также неполярные апротонные растворители вообще не склонны к реакциям кислотно-основного взаимодействия.
Автопротолиз растворителя. Константа автопротолиза
Автопротолизом называют процесс кислотно-основного взаимодействия между двумя молекулами вещества, при котором одна молекула ведёт себя как кислота, а вторая - как основание
.
H2O + H2O H3O+ + OH-
СH3COOH + СH3COOH СH3COO- + СH3COOH2+
C2H5OH + C2H5OH C2H5O- + C2H5OH2+
NH3 + NH3 NH2- + NH4+
Автопротолизу в той или иной степени подвергается большинство растворителей. Однако у одних веществ он идёт более интенсивно, у других - менее интенсивно.
Рассмотрим реакцию кислотно-основного взаимодействия между двумя молекулами растворителя
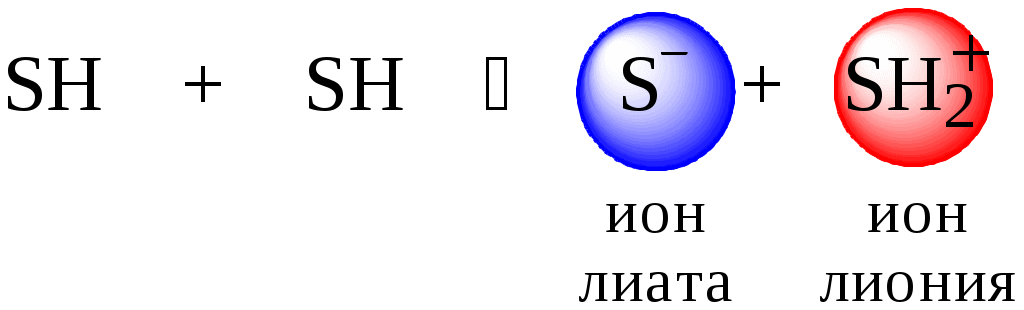
Для чистого растворителя
Полученная константа называется константой автопротолиза(KSH).
В случае воды выражения для константы автопротолиза (обычно обозначается как KW) выглядит следующим образом:
При 25 С
Показатель константы автопротолиза является мерой протяжённости шкалы кислотности (от
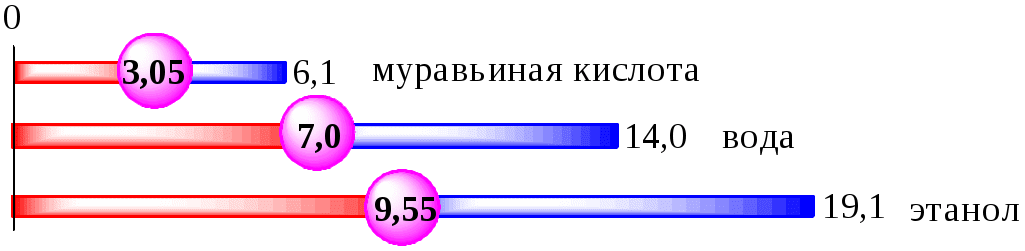
Константа автопротолиза растворителя связывает между собой константы кислотности и основности частиц, образующих сопряжённую кислотно-основную пару. Например, для водных растворов:
Диэлектрическая проницаемость
Диэлектрической проницаемостью среды () называют безразмерную величину, которая показывает, во сколько раз взаимодействие между двумя точечными электрическими зарядами в данной среде слабее, чем в вакууме.
Чем выше диэлектрическая проницаемость растворителя, тем лучше происходит диссоциация растворённого в нём электролита. Растворители, у которых > 15, называются полярными, а те, у которых < 15 - неполярными.
Диэлектрическая проницаемость влияет на величину константы автопротолиза.
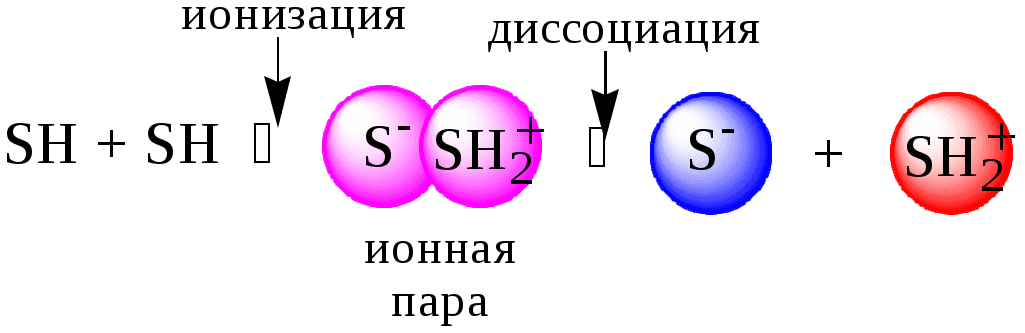
Если растворитель имеет малую диэлектрическую проницаемость, то константа диссоциации ионной пары будет также мала, следовательно, и значение константы автопротолиза будет небольшим.
| растворитель | | pKSH |
| HCOOH | 57,0 | 6,1 |
| CH3COOH | 6,2 | 14,4 |
Диэлектрическая проницаемость растворителя оказывает влияние на константу кислотности (или основности) растворённого вещества. При уменьшении величины данных констант уменьшаются. Причём у заряженных частиц они изменяются менее сильно, чем у незаряженных.
| кислота | H2O | CH3OH | pKa |
| C6H5COOH | 4,2 | 9,5 | 5,3 |
| C6H5NH3+ | 4,6 | 6,1 | 1,5 |
4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
Самая сильная кислота, которая может существовать и оставаться устойчивой в среде растворителя - ион лиония (в случае воды - это H3O+), а самое сильное основание - ион лиата (для воды ОН
-). Кислоты, проявляющие более сильные кислотные свойства, чем ион лиония, и основания, проявляющие более сильные основные свойства, чем ион лиата, называются сильными.
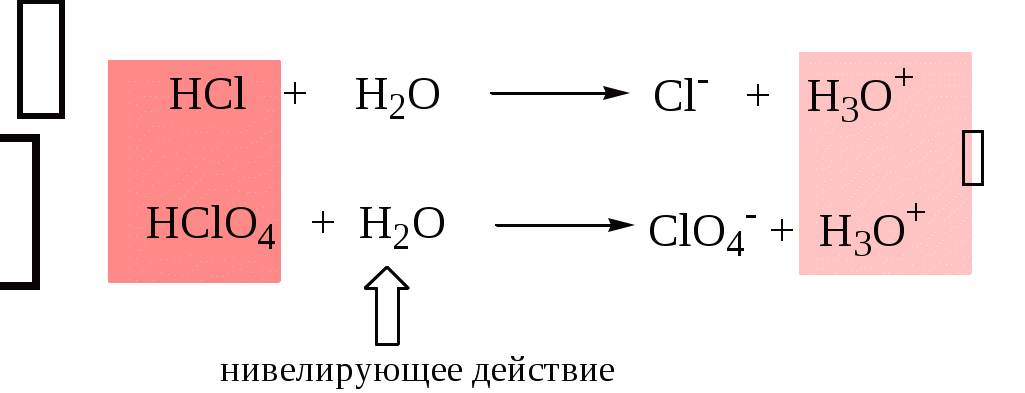
Для частицы H3O+ pKa = 0, сильными считаются кислоты, у которых pKa < 0. К ним относятся, например, HClO4, HI, HBr, HCl, H2SO4, HNO3. Экспериментально определить различия в силе кислотности у данных соединений практически невозможно. В водном растворе они все будут вести себя практически одинаково.
HClO4 + H2O H3O+ + ClO4-
Основания, проявляющие более сильные основные свойства, чем ион OH- (pKBH+ = 14), в водном растворе также уравниваются по силе. К таким основаниям относятся NH2-, O2-, CH3-, H- и др.
NH2- + H2O NH3 + OH-
Кислоты, являющиеся более слабыми, чем ион лиония, и основания, проявляющие более слабыми основными свойствами, чем ион лиата (если только они не являются слишком слабыми кислотами или основаниями), проявляют индивидуальные свойства. У кислот средней силы величина pKa находится в интервале примерно 0 - 4 (границы условны!).
HSO4- + H2O SO42- + H3O+ (pKa =1,94 )
У слабых кислот pKa > 4:
H2S + H2O HS- + H3O+ (pKa = 6,99)
Основания, имеющие pKBH+ от 10 до 14, иногда называют основаниями средней силы, а основания, у которых pKBH+ < 10, - слабыми.
S2- + H2O HS- + OH- (pKBH+ = 12,6)
C6H5NH2 + H2O C6H5NH3+ + OH- (pKBH+ = 4,6)
Уравнивание по силе кислот более сильных, чем ион лиония, и оснований более сильных, чем ион лиата, а также очень слабых кислот и оснований называется нивелирующим действием растворителя.
Не слишком сильные и не слишком слабые кислоты и основания можно практически различить по силе. Растворитель оказывает на них дифференцирующее действие (рис. 4.1).
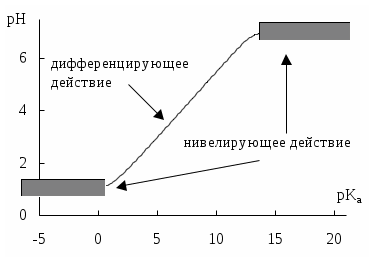
Рис. 4.1. Значения pH 0,1 М кислот в воде
Способность растворителя оказывать нивелирующее или дифференцирующее действие зависит от:
кислотно-основных свойств растворителя;
его склонности к автопротолизу.
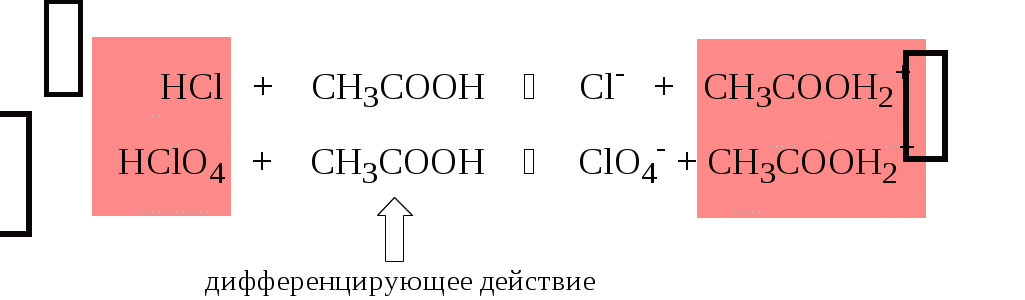
В аммиаке невозможно отличить по силе не только хлорную и хлороводородную кислоты, но и хлорную и уксусную, т.к. NH4+ является значительно более слабой кислотой, чем H3O+. Таким образом, аммиак обладает ещё более сильным, чем вода, нивелирующим действием на кислоты.
Растворитель с сильными основными свойствами нивелирует силу кислот и дифференцирует силу оснований. Сильно кислотный растворитель, наоборот, дифференцирует силу кислот и нивелирует силу оснований.
Чем меньше величина константы автопротолиза растворителя, тем больше вероятность того, что он будет оказывать дифференцирующее действие на силу кислот и оснований (рис. 4.2).
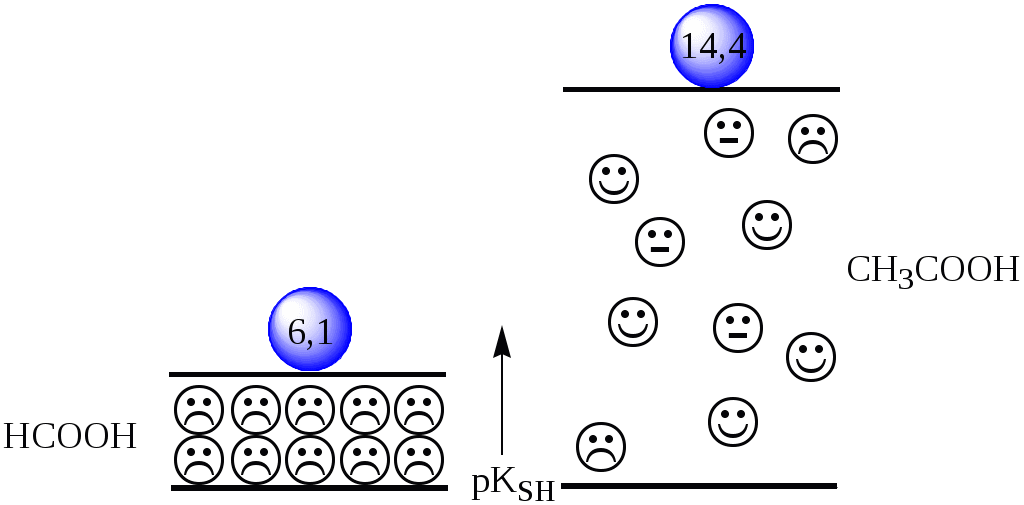
Рис. 4.2. Константа автопротолиза растворителя и его дифференцирующее действие
4.5. Расчёт рН водных растворов различных протолитов
Водородным показателем (рН) называется отрицательный десятичный логарифм активности (или молярной концентрации) ионов водорода в растворе.
pH
Для водных растворов
pH
Для концентрированных растворов величины рН, рассчитанные через активность и молярную концентрацию, отличаются, поэтому для них иногда даже используют разные обозначения, соответственно, paH и pcH. Обозначение рН используется для экспериментально определяемой величины, которая в точности не соответствует ни paH ни pcH, но ближе к первой, чем ко второй.
Для характеристики кислотности и щёлочности водных растворов используется интервал рН от 0 до 14. В более кислых и более щелочных растворах понятие рН теряет смысл, так как активность и концентрация H