ВУЗ: Казахский национальный медицинский университет им. С.Д. Асфендиярова
Категория: Шпаргалка
Дисциплина: Химия
Добавлен: 05.02.2019
Просмотров: 12607
Скачиваний: 45
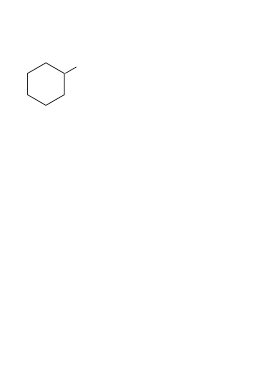
СН
3
ОH
CH≡C—СН
2
—OH
1 2 3 4 5
СН
3
—СН—СН
2
—СН
2
—СН
3
|
OH
метанол
пентанол-2
циклогексанол
пропин-2-ол-1
ОH

58. стрОение ОднОатОмных спиртОв
Структурная формула
молекулы этанола
характер связи в молекуле, как и в молекулах уг
леводородов (ковалентные у-связи), но распределе
ние электронной плотности в молекуле спирта не та
кое равномерное. Связь О—Н — полярная, так как
наибольшая электронная плотность ее оказывается
смещенной к атому кислорода. Атом водорода оказы
вается более подвижным по сравнению с другими
атомами водорода. Атом кислорода образует кова
лентные связи с другими атомами под некоторым уг
лом друг к другу, а не по прямой линии.
Оси этих электронных облаков взаимно перпенди
кулярны. В направлении их образуются ковалентные
связи атома кислорода с другими атомами.
Другие спирты имеют аналогичное строение. Коли
чественное содержание кислорода в молекулах спир
та резко уменьшается, а содержание углерода уве
личивается при переходе от низших членов гомо
логического ряда к высшим, поэтому метиловый и
этиловый спирты горят бесцветным, а высшие спир
ты — коптящим пламенем.
Н—С —С—О—Н
|
H
|
H
H
|
H
|

59. физические свОйства ОднОатОмных
спиртОв
Низшие спирты — жидкости; высшие, с числом уг
леродных атомов более 12 — твердые вещества. Все
спирты легче воды. Растворимость их в воде умень
шается с ростом молекулярной массы.
Вследствие неравномерного распределения элект
ронной плотности в молекуле спирта и наличия непо
деленных электронных пар у атома кислорода наблю
дается возникновение довольно высокого дипольного
момента (м
этанола
= 1,7). Дипольный момент воды
м = 1,87. Полярный характер молекул приводит к вза
имному притяжению. Молекулы спирта ассоциирова
ны вследствие возникновения между ними водород
ных связей подобно молекулам воды. Прочность водо
родных связей значительно меньше прочности обыч
ной ковалентной связи примерно в 10 раз. Для разрыва
водородной связи следует затратить определенную
энергию, этим объясняются высокие температуры ки
пения спиртов по сравнению с соответствующими уг
леводородами. Образованием водородных связей
между молекулами спирта и воды обусловливается хо
рошая растворимость спиртов в воде, в отличие от
соответствующих углеводородов, которые не дают во
дородных связей с водой и поэтому не растворяются в
ней. В углеводородах связи С—Н очень мало поляри
зованы, и положительный заряд на атоме водорода
недостаточен для образования таких связей.
Понижение растворимости спиртов в воде с ростом
молекулярной массы объясняется тем, что чем больше
углеводородный радикал в молекуле спирта, тем труд
нее гидроксильной группе удержать такую молекулу в
растворе за счет образования водородных связей.

60. пОлучение ОднОатОмных спиртОв
1. гидролиз галогенпроизводных углеводоро-
дов в присутствии водных растворов щелочей:
СН
3
Br + НОН ↔ СН
3
ОН + HBr.
бромметан метанол
По легкости отщепления галогены располагаются
в следующей последовательности: хлориды < броми
ды < иодиды.
2. гидролиз этиленовых углеводородов (при на
гревании в присутствии катализаторов: H
2
SO
4
, ZnCl
2
и др.):
CH
2
=CH
2
+ HOH → CH
3
—OH.
этилен метанол
Из этилена получают первичный спирт, гомологи
этилена образуют вторичные и третичные спирты,
причем присоединение молекулы воды идет по пра-
вилу Марковникова: атом водорода становится к
наиболее гидрогенезированному атому углерода:
CH
3
—CH=CH
2
+ HOH → CH
3
—CH(OH)—CH
3
.
пропен пропанол2
3. восстановление альдегидов и кетонов. Аль
дегиды превращаются в первичные, а кетоны — во
вторичные спирты:
CH
3
CHO + 2[H] → CH
3
CH
2
OH.
уксусный пропанол1
альдегид
4. Получение этанола из растительного сырья, со
держащего крахмал, а также из непищевого сырья.

61. химические свОйства ОднОатОмных
спиртОв
Спирты незначительно диссоциируют на ионы; ни
сами спирты, ни их водные растворы не проводят
электрический ток в заметной степени.
1. кислотно-основные свойства спиртов. Спир
ты взаимодействуют со щелочными металлами, в ре
зультате образуются алкоголяты:
2С
2
Н
5
ОН + 2Na → 2C
2
H
5
ONa + H
2
.
этилат натрия
В присутствии следов влаги алкоголяты разлагаются:
C
2
H
5
ONa + Н
2
О → С
2
Н
5
ОН + NaОН.
Это проявление кислотных свойств — отщепление
водорода в виде протона. Однако к классу кислот
спирты не могут быть причислены, поскольку их сте
пень диссоциации крайне незначительна, даже мень
ше, чем у воды, их растворы не изменяют окраски
индикаторов.
Степень диссоциации спиртов можно повысить,
если в молекулу ввести заместитель, притягивающий
к себе электроны химической связи.
2. дегидратация — отщепление воды (ионное рас
щепление ковалентной связи С—О) при нагревании
с катализатором (H
2
SO
4конц
): C
2
H
5
OH → C
2
H
4
+ H
2
O.
3. реакции окисления:
а) cпирты сравнительно легко окисляются такими
окислителями, как KMnO
4
, K
2
Cr
2
O
7
, кислородом возду
ха в присутствии катализаторов (Pt, Cu). Сказывается
влияние гидроксильной группы: кислород присоеди
няется к атому углерода, связанному с группой ОН:
C
2
H
5
OH + [O] → CH
3
—CHO + H
2
O;
б) cпирты горят: 2C
2
H
5
OH + 6O
2
→ 4CO
2
+ 6H
2
O.