ВУЗ: Казахский национальный медицинский университет им. С.Д. Асфендиярова
Категория: Шпаргалка
Дисциплина: Химия
Добавлен: 05.02.2019
Просмотров: 12636
Скачиваний: 45

89. химические свОйства двухОснОвных
карбОнОвых кислОт
I. свойства, общие с монокарбоновыми кисло-
тами: образуют соли, сложные эфиры, хлорангидри
ды и др. В зависимости от того, вступает в реакцию
одна карбоксильная группа или две, получаются кис
лые или средние соли, кислые и средние сложные
эфиры, полные и неполные хлорангидриды и др.
II. Cпецифические свойства.
При близком расположении карбоксильных групп
возможность их взаимодействия увеличивается. Если
карбоксильные группы разделены цепью из шести и
более атомов углерода, их взаимное влияние сказы
вается мало.
1. Отношение к нагреванию. Щавелевая кислота
при быстром нагревании декарбоксилируется, обра
зуя муравьиную кислоту и оксид углерода (IV). Если
нагревание вести в присутствии концентрированной
кислоты, то разлагается и муравьиная кислота.
2. Малоновая и другие кислоты, в молекулах кото
рых карбоксильные группы находятся в положе
нии 1,3, легко декарбоксилируются.
Близость карбоксильных групп обусловливает тер
мическую неустойчивость соединений.
3. дегидрирование — при нагревании янтарной и
глутаровой кислот
(карбоксильная группа в положе
ниях 1,4 и 1,5) образуются внутренние циклические
ангидриды с пяти и шестичленными циклами.
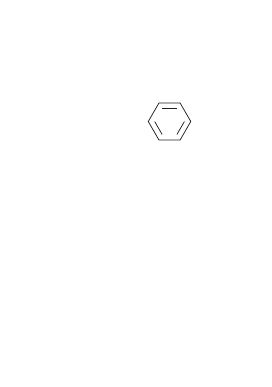
Так же ведет себя и ароматическая одикарбоновая
кислота — фталевая.

90. Общая характеристика
функциОнальных прОизвОдных
карбОнОвых кислОт
функциональными производными называют про
изводные карбоновых кислот, у которых ОНгруппа
замещена нуклеофильной частицей Z (
=
—
O
Z
R—С
).
Нуклеофильными реагентами бывают нейтральные
молекулы, имеющие в своем составе гетероатом с не
поделенной парой элекутронов.
Функциональные производные карбоновых кислот
могут вступать в реакции ацилирования, приводящие к
образованию других функциональных производных
карбоновых кислот. Реакционная способность зави
сит от природы частицы Z. Наибольшей ацилирующей
способностью обладают галогенангидриды и ангид
риды, сложные эфиры и амиды проявляют более низ
кую ацилирующую способность, так как алкоксид и
амиданионы — нестабильные анионы. Реакции аци
лирования протекают по тетраэдрическому механиз
му, включающему две стадии. Первая — медлен
ная — стадия состоит в присоединении нуклеофила
по двойной связи С=О и образовании тетраэдричес
кого интермедианта. На второй стадии происходит
отщепление группы. Реакции ацилирования катали
зируются кислотами или основаниями.
91. галОгенангидриды
галогенангидриды — функциональные производные
карбоновых кислот общей формулой:
=
—
O
Hal
R—C
номенклатура. Название галогенангидрида со
стоит из названия радикала аниона карбоновой кис
лоты и галогена (фторид, хлорид, бромид, йодид).
=
—
O
Cl
=
—
O
Cl
CН
3
— С
—С
бензоилхлорид
ацетилхлорид
физические свойства: жидкости или твердые ве
щества с резким запахом, сильно раздражают кожу и
слизистые оболочки.
получение:
а) действие галогенидов фосфора (PCl
5
, PCl
3
, PBr
5
,
PBr
3
) на карбоновые кислоты;
б) действие тионилхлорида SOCl
2
на карбоновые
кислоты;
в) действие других хлорангидридов на карбоновые
кислоты (реакция идет при ультрафиолетовом облуче
нии);
г) действие тионилхлорида на соли карбоновых
кислот.
92. химические свОйства
галОгенангидридОв:
химические свойства галогенангидридов.
1. реакции ацилирования. Галогенангидриды яв
ляются наиболее активными ацилирующими агента
ми. Для них характерна большая подвижность атомов
галогенов. Легко взаимодействуют с нуклеофильны
ми реагентами, так как на атоме углерода карбок
сильной группы имеется большой дефицит электро
нов:
=
O
Hal
δ
–
δ
+
R—С
Nu:
При взаимодействии галогенангидридов с водой
образуются карбоновые кислоты; со спиртами —
сложные эфиры; с аммиаком — амиды; с солями кар
боновых кислот — ангидриды; с пероксидами — пе
роксид ангидрида.
2. реакции восстановления. Галогенангидриды
восстанавливаются гидридами металлов в первичные
спирты:
=
—
O
Cl
R—C
R—CH
2
—OH
LiAlH
4

93. ангидриды
ангидриды — функциональные производные карбо
новых кислот с общей формулой
R—C—O—C—R��
′
||
O
||
O
физические свойства: жидкости или твердые ве
щества с раздражающим запахом.
получение ангидридов:
а) под действием водоотнимающего средства окси
да фосфора (V) карбоновые кислоты превращаются в
ангидриды;
б) при нагревании дикарбоновых кислот. Важно,
чтобы образующийся циклический ангидрид содер
жал пяти или шестичленный цикл;
в) взаимодействие галогенангидридов с натриевы
ми, калиевыми, серебряными, талиевыми солями
карбоновых кислот (соль берется в виде суспензии в
эфире), реакция ведется при нагревании.
химические свойства ангидридов.
реакции ацилирования. В результате получаются
функциональные производные карбоновых кислот.
Например, при взаимодействии уксусного ангидрида
с водой образуется уксусная кислота, при взаимо
действии со спиртом — ацетат, при взаимодействии с
аммиаком — ацетамид. Низшие ангидриды реагиру
ют энергичнее, чем высшие.