Файл: Конспект лекций для студентов специальности 1 48 01 02 Химическая технология органических веществ, материалов и изделий.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 12.01.2024
Просмотров: 1238
Скачиваний: 1
СОДЕРЖАНИЕ
Основные понятия и определения
Направленность ковалентной связи. Гибридизация орбиталей
Насыщаемость ковалентной связи
5 Общие свойства растворов. Идеальные растворы. Законы Рауля
Если в раствор добавить, например гидроксид натрия
Влияние pH на растворимость электролитов
Преимущественное направление ионно-молекулярных реакций
Получение заданного вещества реакцией обмена
Восстановители-металлы (простые вещества)
Составление материального баланса в полуреакциях
Комплексные соединения в окислительно-восстановительных реакциях
Электронный баланс в полуреакциях
Уравнение Нернста для металлического электрода
Электрохимический ряд металлов
Материальный баланс электрохимических реакций. Законы Фарадея
Таблица А.1 – Константы ионизации некоторых кислот и оснований
Если в реакции окисляются или восстанавливаются газообразные вещества, то получим уравнение:
 = = | (14.3) |
V(X) – объем газа, л;
Vm – молярный объем.
Пример 1. Рассчитать массу меди, выделившуюся на катоде при электролизе раствора сульфата меди в течение 2 часов при силе тока в 100 А.
Решение: Cu2+ + 2e Cu, fэкв = ½
Согласно уравнению (14.2)
 =
= тогда m(Cu) =
Пример 2. Рассчитать время электролиза раствора хлорида калия, если при силе тока 100 ампер на аноде выделилось 5,6 литра хлора.
Решение: 2Cl– Cl2 + 2e, fэкв = 1/2
Согласно уравнению (3)
 =
= тогда
 сек.
сек. -
Химические источники электрической энергии (ХИЭЭ)
Все ХИЭЭ подразделяются на источники однократного действия –«элементы» – и многократного действия – «аккумуляторы».
Разработано довольно много вариантов элементов; из них наиболее распространенными являются маргацево-цинковые элементы, схема устройства которых показана на рисунке 15.1.
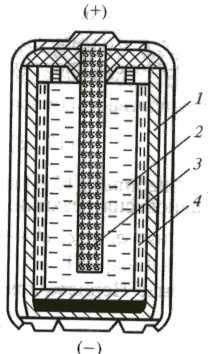
Рисунок 15.1 – Схема марганцево-цинкового элемента:
1 – анод (корпус, изготовленный из цинка);
2 – катод (диоксид марганца в смеси с графитовым порошком, для увеличения электропроводности);
3 – токоотвод из графита;
4 – электролит (паста из хлорида аммония в смеси с загустителем (крахмал или др.).
Анод (–): Zn = Zn2+ + 2e, далее Zn2+ + 4NH4+ = [Zn(NH3)4]2+ + 4H+
Катод(+): MnO2 + H+ + e = MnO(OH)
________________________________________________________
Аккумуляторы
Аккумуляторами называют устройства, позволяющие многократное повторение операций их зарядки-разрядки. В принципе регенерировать можно любое электрохимическое устройство, но при этом восстановленная емкость обычно невелика. В аккумуляторах эти операции можно повторять многократно. Наиболее распространены кислотные свинцовые, щелочные никель-кадмиевые и серебряно-цинковые аккумуляторы.
Свинцовый аккумулятор
Электроды свинцового аккумулятора выполнены в виде ячеистых пластин из свинцового сплава; ячейки заполнены смесью свинцового глета (PbO) с глицерином. После заполнения аккумулятора электролитом (H2SO4) оксид свинца превращается в сульфат.
Зарядка аккумулятора (преобразование электрической энергии в энергию химической реакции): при подключении электродов к внешнему источнику постоянного тока одни из них поляризуются катодно (–) и на нем протекает реакция восстановления свинца (II), другой – анодно (+), и на нем свинец (II) окисляется:
Катод (–): PbSO4 + 2e = Pb + SO42-
Анод (+): PbSO4 + 2H2O = PbO2 + SO42- + 4H+ + 2e
______________________________________________________________________
ЭДС заряженного аккумулятора – около 2 В. Из суммарного уравнения реакции видно, что одним из продуктов реакции является серная кислота, поэтому при зарядке аккумулятора концентрация электролита увеличивается (по изменению плотности электролита контролируют степень заряженности аккумулятора).
Разрядка аккумулятора – это превращение энергии окислительно-восстановительной реакции в электрическую энергию. При замыкании внешней цепи электроны с анода (Pb) переходят на электроды, заполненые PbO2 (катод):
Катод
(–): PbO2 + SO42– + 4H+ + 2e = PbSO4 + 2H2O
Анод (+): Pb + SO42- = PbSO4 + 2e
______________________________________________
Из полученного уравнения видно, что при разрядке аккумулятора плотность электролита уменьшается (на этом основан один из простых методов контроля заряда аккумулятора).
К основным преимуществам свинцового аккумулятора относятся большая электрическая емкость (А∙час/кг) и устойчивость в работе при многократных циклах перезарядки. Основные недостатки – массивность и негерметичность.
Кадмиево-никелевый аккумулятор
Схема его работы может быть показана следующими превращениями:
разряд
2NiO(OH) + Cd 2Ni(OH)2 + Cd(OH)2, ЭДС = 1,4 В
заряд
Серебряно-цинковый (СЦ) аккумулятор
Вследствие большой удельной емкости и большой ЭДС эти аккумуляторы чаще всего применяются для питания различных микроэлектронных устройств. Их работа основана на следующих окислительно-восстановительных реакциях:
разряд
AgO + Zn + H2O Ag + Zn(OH)2
заряд
Применение электролиза
Электрохимическое получение металлов (алюминий, щелочные и щелочноземельные металлы и др.); рафинирование (очистка) металлов; гальванопластика и гальваностегия; электрохимическая обработка поверхностей металлов.
Химические источники электрической энергии
Устройства непрерывного действия, в которых энергия химического окисления топлива непосредственно превращается в электрическую энергию, называют химическими источниками электрического тока или топливными элементами.
В качестве восстановителя (топлива) в таких элементах используют водород, окись углерода, метан и др. органические вещества, а в качестве окислителя, чаще всего, – чистый кислород, иногда воздух. В настоящее время наиболее изучен водородно-кислородный топливный элемент, схема которого показана на рисунке 15.2.
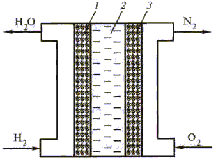
Рисунок 15.2 – Схема водородно-кислородного топливного элемента:
1 – анод; 2 – электролит; 3 – катод
Катод и анод такого элемента изготовлены из пористого графита и катализатора – металла платиновой группы. На катоде восстанавливается кислород, а водород окисляется на аноде. В зависимости от выбранного электролита (щелочи или кислоты) электрохимические реакции можно описать следующими уравнениями:
В щелочной среде (электролит – гидроксид калия):
Анод: 2H2 + 4OH– = 4H2O + 4e
Катод: O2 + 2H2O + 2e = 4OH–
_____________________________________________
В кислой среде (электролит – фосфорная кислота):
Анод: 2H2 = 4H+ + 4e
Катод: O2 + 4H+ + 4e = 2H2O
_______________________________________________
ЭДС такого элемента не зависит от pH:
П Р И Л О Ж Е Н И Е А
(справочное)
Таблица А.1 – Константы ионизации некоторых кислот и оснований
| Название | Формула | Ступень ионизации | К |
| Азотистая кислота | HNO2 | | 6,9.10–4 |
| Борная (орто) кислота | H3BO3 | I II III | 7,1.10–10 1,8.10–13 1,6.10–14 |
| Бромноватистая кислота | HBrO | | 2,2.10–9 |
| Иодноватистая кислота | HIO | | 2,3.10–11 |
| Дихромовая кислота | Н2Сr2O7 | II | 2,3.10–2 |
| Кремниевая (орто) кислота | H4SiO4 | I II | 1,3.10–10 1,6.10–12 |
| Муравьиная кислота | HCOOH | | 1,8.10–4 |
| Пероксид водорода | H2O2 | | 2,0.10–12 |
| Селенистая кислота | H2SeO3 | I II | 1,8.10–3 3,2.10–9 |
| Селеноводородная кислота | H2Se | I II | 1,3.10–4 1,0.10–11 |
| Серная кислота | H2SO4 | II | 1,15.10–2 |
| Сернистая кислота | H2SO3 | I II | 1,4.10–2 6,2.10–8 |
| Сероводородная кислота | H2S | I II | 1,0.10–7 2,5.10–13 |
| Синильная кислота | HCN | | 5,0.10–10 |
| Угольная кислота | H2CO3 | I II | 4,5.10–7 4,8.10–11 |
| Уксусная кислота | CH3COOH | | 1,7.10–5 |
| Фосфористая кислота | H3PO3 | I II | 37,1.10–2 1,6.10–7 |
| Фосфорная (орто) кислота | H3PO4 | I II III | 7,1.10–3 6,2.10–8 5,0.10–13 |
| Фосфорноватистая кислота | H3PO2 | | 5,9.10–2 |
| Фтороводородная кислота | HF | | 6,2.10–4 |
| Хлорноватистая кислота | HClO | | 2,95.10–8 |
| Хромовая кислота | H2CrO4 | I II | 1,6.10–1 3,2.10–7 |
| Щавелевая кислота | H2C2O4 | I II | 5,6.10–2 5,4.10–5 |
| Гидрат аммиака | NH3∙H2O | | 1,8.10–5 |