Файл: Билеты по общей и неорганической химии для студентов 125Ф3 озо (20222023учебный год) Билет 1.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.11.2023
Просмотров: 317
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
й одоводород, йодоводородная кислота (HI) степень окисления -1
йодноватистая кислота (HIO) степень окисления +1
й одноватая кислота (HIO3) степень окисления +5
й одная кислота (HIO4) степень окисления +7
й одоводород, йодоводородная кислота (HI) степень окисления -1
йодноватистая кислота (HIO) степень окисления +1
й одноватая кислота (HIO3) степень окисления +5
Применение в медицине
Ряд неорганических соединений алюминия используется в качестве лекарственных препаратов. Так гидроксид алюминия Al(OH)3 обладает антацидным действием, в основе которого лежит реакция нейтрализации ионов оксония
Al(OH)3 + 3H3O+ → Al3+ + 6H2O
Образующиеся ионы Al3+ выводятся из организма в виде осадка фосфата алюминия AlPO4. Фармацевтический препарат «Альмагель», состоящий из геля гидроксида алюминия и оксида магния, используется при лечении язвенной болезни.
Известно антисептическое, вяжущее и кровоостанавливающее действие алюминиевокалиевых квасцов (KAl(SO4)2×12H2O), которые применяются наружно в виде примочек, полосканий, промываний. Антисептическое действие квасцов обусловлено тем, что ионы Аl3+ образуют с фосфорсодержащими протеинами комплексные соединения, выпадающие в виде осадка фосфата алюминия:
Al3+ + P3- → AlP↓
Это приводит к гибели клеток микроорганизмов, что снижает воспалительный процесс. В результате осаждения белков и образования кислотных альбуминатов наблюдается вяжущее действие квасцов. Кровоостанавливающий эффект связан со свертыванием белков на раневой поверхности кровеносных сосудов. Как вяжущее и подсушивающее средство используются в виде присыпок жженые квасцы (КАl(SО4)2). Подсушивающий эффект связан с медленным процессом поглощения влаги из тканей:
КАl(SО4)2 + nH2О→КАl(SО4)2 × nH2О
-
Составьте химические формулы соединений углерода в соответствии с возможными степенями окисления.
Типичные соединения углерода.
о
 ксид углерода (валентность IV) CO2
ксид углерода (валентность IV) CO2угольная кислота H2CO3 степень окисления +4
карбонаты Cu2CO3, Na2CO3
гидрокарбонаты NaHCO3, Ca(HCO3)2
о
 ксид углерода (валентность II) СО степень окисления +2
ксид углерода (валентность II) СО степень окисления +2
муравьиная кислота HCOOH
м
 етан CH4
етан CH4карбиды металлов (карбид алюминия Al4C3) степень окисления -4
бинарные соединения с неметаллами (карбид кремния SiC)
Билет №10
-
Общая характеристика элементов III А группы. Бор и его соединения. Применение в медицине.
Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
… ns2nр1 — электронное строение внешнего энергетического уровня элементов IIIA группы.
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Характеристики элементов IIIA группы:
| Название | Атомная масса, а.е.м. | Заряд ядра | ЭО по Полингу | Радиус атома, нм | Энергия ионизации, Э → Э3+, эВ | Степень окисления в соединениях | Валентные электроны |
| Бор | 10,811 | +5 | 2,01 | 0,091 | 71,35 | +3, -3 | 2s22p1 |
| Алюминий | 26,982 | +13 | 1,47 | 0,143 | 53,20 | +3 | 3s23p1 |
| Галлий | 69,723 | +31 | 1,82 | 0,139 | 57,20 | +3 | 4s24p1 |
| Индий | 114,818 | +49 | 1,49 | 0,116 | 52,69 | +3 | 5s25p1 |
| Таллий | 204,383 | +81 | 1,44 | 0,171 | 56,31 | +1, +3 | 6s26p1 |
Бор и его соединения
Бор – первый p-элемент периодической системы элементов. Находится в IIIА группе второго периода, относится к типическим элементам. На внешнем электронном уровне имеет три электрона 2s22p1.
+5B 1s2 2s2 2p1
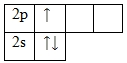
В возбужденном состоянии 2s12p2 орбитали трех неспаренных электронов подвергаются sp2-гибридизации и могут образовать три ковалентные связи по обменному механизму. При этом у бора остается одна свободная p-орбиталь, благодаря которой он может быть акцептором неподеленной электронной пары, и повысить свое координационное число до четырех. При переходе в sp3- гибридное состояние, плоская форма молекулы меняется на тетраэдрическую.
+5B 1s2 2s2 2p1
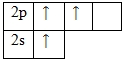
Характерные степени окисления бора -3 и +3.
Содержание бора в земной коре составляет 5·10-3% по массе. В природе бор встречается только в связанном состоянии. Соединения бора в составе минералов это: бура – Na2B4O7·10 H2O, борная кислота − H3BO3 и ее соли.
Д
 ля бора известны аморфная аллотропная модификация (порошок бурого цвета) и несколько кристаллических. Из кристаллических наиболее устойчивой является модификация с решеткой из структурных единиц в форме икосаэдра, образованного двенадцатью атомами бора. Это гранатово-красные кристаллы, по твердости близкие к алмазу, обладающие полупроводниковыми свойствами.
ля бора известны аморфная аллотропная модификация (порошок бурого цвета) и несколько кристаллических. Из кристаллических наиболее устойчивой является модификация с решеткой из структурных единиц в форме икосаэдра, образованного двенадцатью атомами бора. Это гранатово-красные кристаллы, по твердости близкие к алмазу, обладающие полупроводниковыми свойствами.В природе бор встречается в виде минералов:
-
Na2B4O7*10H2O - бура -
H3BO3 - сассолин
Способы получения
Бор получают путем пиролиза бороводородов, методом металлотермии (вытеснением активным металлом) и термическим разложением бромида бора в присутствии катализатора
B2H6 → (t) B + H2
B2O3 + Mg → MgO + B
BBr3 + H2 → (вольфрам, t = 1000-1200 С°) B + HBr
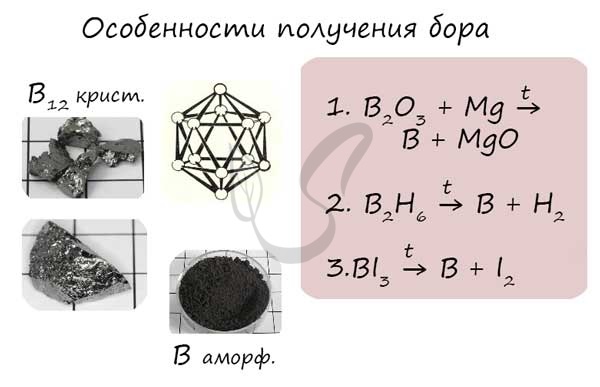
Типичные соединения
-
В степени окисления –3 – бор – окислитель. Эта степень окисления характерна в соединениях бора с металлами: Mg3B2, MgB2(диборид магния), ZrB2(диборид циркония), TiB2(диборид титана). -
В степени окисления +3 – бор – восстановитель В2О3(оксид бора), BF3(трифторид бора), H3BO3(борная кислота), BBr3 (трибромид бора)
Химические свойства
Реакции с фтором
Необходимо заметить, что бор довольно инертный неметалл. При комнатной температуре без нагревания он реагирует только со фтором:
B + F2 → BF3↑
Реакции с неметаллами
При нагревании бор реагирует с другими галогенами, азотом, фосфором, углеро-дом и кислородом.
B + Cl2 → BCl3
B + N2 → BN
B + P → BP
B + C → B4C
B + O2 → B2O3
Восстановительные свойства
При сильном нагревании бор способен восстановить кремний из его оксида:
SiO2 + 4B → Si + B2O3
Окраска пламени (качественная реакция)
Ионы бора окрашивают пламя в оттенки зеленого цвета.
Применение в медицине
Бор содержится в глазных каплях, антисептических средствах, стиральных порошках и глазури для плитки. Оксид бора часто используется при изготовлении стекловолокна.
Для особых медицинских операций (генетико- и онкодиагностики) производятся пипетки, пробирки из боросиликатного стекла, экраны, аспирационные емкости, лабораторная посуда и др.
Бор применяется и в медицине при бор- нейтронозахватной терапии (способ избирательного поражения клеток злокачественных опухолей
В медицине как антисептические средства находят применение бура и борная кислота (в виде водно-спиртовых растворов).
В быту буру или борную кислоту используют для уничтожения бытовых насекомых, в частности, тараканов (бура, попадая в органы пищеварения таракана, кристаллизуется, и образовавшиеся острые игольчатые кристаллы
разрушают ткани этих органов).
-
Составьте химические формулы соединений серы в соответствии с возможными степенями окисления.
Возможные степени окисления серы -2, -1, +4, +6
сероводород H2S, Na2S - степень окисления -2
дисульфид натрия Na2S2 - степень окисления -1
диоксид серы SO2, H2SO3, Na2SO3 - степень окисления +4
серная кислота H2SO4, SO3 - степень окисления +6
Билет №11
-
Общая характеристика щелочные и щелочноземельных металлов и их роль в организме человека.
Наиболее активными среди металлической группы являются щелочные и щелочноземельные металлы. Это мягкие лёгкие металлы, вступающие в реакции с простыми и сложными веществами.
Активные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и щелочноземельных металлов:
-
литий (Li); -
натрий (Na); -
калий (K); -
рубидий (Rb); -
цезий (Cs); -
франций (Fr); -
бериллий (Be); -
магний (Mg); -
кальций (Ca); -
стронций (Sr); -
барий (Ba); -
радий (Ra).
Электронная конфигурация щелочных металлов – ns1, щелочноземельных металлов – ns2. Соответственно, постоянная валентность щелочных металлов – I, щелочноземельных – II. За счёт небольшого количества валентных электронов на внешнем энергетическом уровне активные металлы проявляют мощные свойства восстановителя, отдавая внешние электроны в реакциях. Чем больше энергетических уровней, тем меньше связь с внешних электронов с ядром атома. Поэтому металлические свойства возрастают в группах сверху вниз.
Из-за активности металлы I и II групп находятся в природе только в составе горных пород. Чистые металлы выделяют с помощью электролиза, прокаливания, реакции замещения.