Файл: Билеты по общей и неорганической химии для студентов 125Ф3 озо (20222023учебный год) Билет 1.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 07.11.2023
Просмотров: 309
Скачиваний: 2
ВНИМАНИЕ! Если данный файл нарушает Ваши авторские права, то обязательно сообщите нам.
СОДЕРЖАНИЕ
й одоводород, йодоводородная кислота (HI) степень окисления -1
йодноватистая кислота (HIO) степень окисления +1
й одноватая кислота (HIO3) степень окисления +5
й одная кислота (HIO4) степень окисления +7
й одоводород, йодоводородная кислота (HI) степень окисления -1
йодноватистая кислота (HIO) степень окисления +1
й одноватая кислота (HIO3) степень окисления +5
й одоводород, йодоводородная кислота (HI) степень окисления -1
одоводород, йодоводородная кислота (HI) степень окисления -1
cоли йодноватой кислоты - йодаты NaI
йодноватистая кислота (HIO) степень окисления +1
й одноватая кислота (HIO3) степень окисления +5
одноватая кислота (HIO3) степень окисления +5
оксиды йода, пентаоксид (пятиокись) йода (I2O5)
й одная кислота (HIO4) степень окисления +7
одная кислота (HIO4) степень окисления +7
соли йодной кислоты - периодаты NaIO4
Способы получения йода
Получение йода осуществляют путем окисления ионов I- сильными окислителями:

Химические свойства йода
Химически йод довольно активен, хотя и в меньшей степени, чем хлор и бром.
-
Довольно известной качественной реакцией на йод является его взаимодействие с крахмалом, при котором наблюдается синее окрашивание в результате образования соединения включения. Эту реакцию открыли в 1814 году Жан-Жак Колен (Jean-Jacques Colin) и Анри-Франсуа Готье де Клобри (Henri-François Gaultier de Claubry). -
С металлами йод при легком нагревании энергично взаимодействует, образуя йодиды:
Hg + I2 → HgI2
-
С водородом йод реагирует только при нагревании и не полностью, образуя йодоводород:
H2 + I2 → 2HI
-
Йод является окислителем, менее сильным, чем фтор, хлор и бром. Сероводород H2S, Na2S2O3 и другие восстановители восстанавливают его до иона I−:
I2 + H2S → S + 2HI
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Последняя реакция также используется в аналитической химии для определения йода.
-
Реакция образования нитрида трийода:
3I2 + 5NH3 → 3NH4I + NH3⋅ NI3↓
Нитрид трийода в сухом кристаллическом состоянии разлагается с выделением фиолето-вых паров йода, что демонстрируется как эффектная химическая реакция.
-
Йодиды щелочных металлов очень склонны в растворах присоединять (растворять) молекулы галогенов с образованием полийодидов (перйодидов) — трийодид калия, дихлоройодат I калия:
KI + I2 → KI3
Биологическая роль йода.
Основная биологическая роль йода заключается в синтезе гормонов щитовидной железы (тироксина и трийодтиронина), через которые он и реализует следующие эффекты:
-
стимулирует рост и развитие организма -
регулирует рост и дифференцировку тканей -
повышает артериальное давление, а также частоту и силу сердечных сокращений -
регулирует (увеличивает) скорость протекания многих биохимических реакций -
регулирует обмен энергии, повышает температуру тела -
регулирует белковый, жировой, водно-электролитный обмен -
регулирует обмен витаминов -
повышает потребление тканями кислорода
Применение йода и его соединений в медицине и народном хозяйстве.
В медицине
-
- 5 % спиртовой раствор йода используется в качестве антисептического и кровеостанавливающего средства, однако обрабатывать йодной настойкой можно только небольшие раны, так как йод может вызвать омертвение ткани, что при больших ранах увеличит сроки их заживления. -
В рентгенологических и томографических исследованиях применяются йодсодержащие контрастные препараты
В технике
-
Галогенная лампа - лампа накаливания, в баллон которой добавлены пары галогенов (брома или йода) -
Лазерный термоядерный синтез иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах -
для получения высокочистого титана (Ti), циркония (Zr), гафния (Hf), ниобия (Nb) и других металлов (так называемое йодидное рафинирование металлов); -
применяют в пищевых добавках; -
в фотоделе; -
в аналитической химии - йодометрии;
-
Напишите электронно-графическую формулу электронных оболочек атома углерода.
+6

 C
C 2 4
Электронная конфигурация углерода в основном состоянии:
+6С 1s22s22p2 1s
Электронная конфигурация углерода в возбужденном состоянии:
+6С* 1s22s12p3 1s
Билет №13.
-
Общая характеристика элементов: сурьма и висмут. Применение в медицине.
С
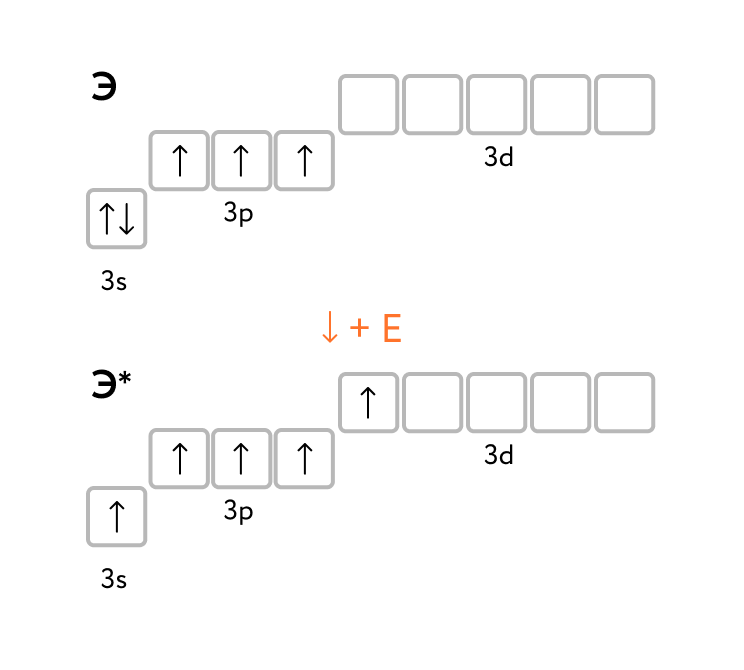 урьма и Висмут входят в состав подгруппы азота. Элементы этой группы называют также пниктогенами, что означает «дурно пахнущий». Происхождение название связано с тем, что эти элементы образуют водородные соединения, обладающие крайне неприятным запахом.
урьма и Висмут входят в состав подгруппы азота. Элементы этой группы называют также пниктогенами, что означает «дурно пахнущий». Происхождение название связано с тем, что эти элементы образуют водородные соединения, обладающие крайне неприятным запахом.На внешнем энергетическом уровне атомов элементов VA – группы содержится пять электронов, конфигурация внешнего энергетического уровня ns2ns3.
В невозбуждённом состоянии атомы элементов VA – группы содержат на внешнем энергетическом уровне три неспаренных электрона, поэтому имеют валентность.
В возбужденном состоянии у атомов элементов VA – группы, кроме азота, происходит "распаривание" валентных электронов и увеличение валентности:
ns1np3nd1 — валентность V
Высшая степень окисления пниктогенов равна +5. Высшие оксиды элементов VA -группы имеют общую формулу R2O5; высшим оксидам соответствуют кислоты состава HRO3 и H3RO4. С кислородом пниктогены образуют оксиды, проявляя различные степени окисления от +1 до +5.
Присоединяя три электрона, атомы элементов VA – группы проявляют низшую степень окисления, равную -3.
Первые представители подгруппы — азот и фосфор — типичные неметаллы, мышьяк и сурьма проявляют металлические свойства, висмут — типичный металл.
Сурьма — полуметалл серебристо-белого цвета с синеватым оттенком, грубозернистого строения. Известны четыре металлические аллотропные модификации сурьмы и три аморфные модификации (жёлтая, чёрная и взрывчатая сурьма). Соединения сурьмы похожи по химическим свойствам на соединения мышьяка, но отличаются более выраженными металлическими свойствами.
Висмут — тяжёлый серебристо-белый металл с розоватым оттенком. Со временем покрывается тёмно-серой оксидной плёнкой. Наряду со свинцом и оловом входит в состав большинства легкоплавких припоев и сплавов.
Cурьма и висмут в природе встречаются преимущественно в виде сульфидов. Известны следующие природные соединения этих элементов: Sb2S3 антимонит, Bi2S3 висмутит.
С
 урьму и висмут в свободном состоянии получают путем карбо- или металлотермического восстановления соответствующих оксидов (серосодержащие соединения предварительно подвергают обжигу):
урьму и висмут в свободном состоянии получают путем карбо- или металлотермического восстановления соответствующих оксидов (серосодержащие соединения предварительно подвергают обжигу):Желтая сурьма (неметаллическая модификация) неустойчива. Ее получают при пропускании воздуха через сжиженный SbH3. Желтая сурьма уже при 50 °С превращается в серую металлическую сурьму. Сурьма в чистом виде отличается металлическим блеском, кристаллической структурой и может образовывать твердые растворы с мышьяком и висмутом.
У висмута нет неметаллических модификаций. Обладает теплопроводностью и электрической проводимостью.
Химические свойства (вместо Э надо подставить Sb или Bi)
1. При нагревании с кислородом образуются оксиды Э2О3:
2. Легко взаимодействуют с галогенами (Г):
3. Взаимодействуют с серой, селеном, теллуром:
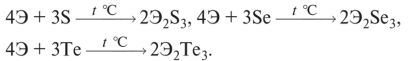
4. Взаимодействуют с металлами с образованием арсенидов и антимонидов:
5. Взаимодействие со сложными веществами:
Сурьма и висмут не взаимодействуют с минеральными кислотами, так как в электрохимическом ряду напряжений стоят правее водорода;
Сурьма и висмут взаимодействуют с кислотами-окислителями H2S04 (конц.) или HN03 (конц.):
2Sb + 10HNO3(конц.) →Sb2O5 + 10NO2↑ + 5H2O,
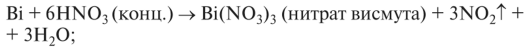
Сурьма и висмут не растворяются в воде.
Соединения
Гидриды. Сурьма и висмут образуют с водородом гидриды типа ЭН3 (стибин SbH3, висмутин BiH3), которые в обычных условиях представляют собой бесцветные ядовитые газы с неприятным запахом.
-
Напишите электронно-графическую формулу электронных оболочек атома алюминия.
+13


 Al
Al 2 8 3
Электронная конфигурация алюминияв основном состоянии:
+13Al 1s22s22p63s23p1 1s
Электронная конфигурация алюминияв возбужденном состоянии:
+13Al* 1s22s22p63s13p2 1s
Билет №14.
-
Соединения углерода. Биологическая роль углерода. Применение в медицине и народном хозяйстве углерода и его соединений.
Углерод расположен в главной подгруппе IV группы и во втором периоде периодической системы химических элементов Менделеева. В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Электронная конфигурация углерода в основном состоянии:
+6С 1s22s22p2 1s
Электронная конфигурация углерода в возбужденном состоянии:
+6С* 1s22s12p3 1s
Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома углерода — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Типичные соединения углерода.
о
 ксид углерода (валентность IV) CO2
ксид углерода (валентность IV) CO2угольная кислота H2CO3 степень окисления +4
карбонаты Cu2CO3, Na2CO3
гидрокарбонаты NaHCO3, Ca(HCO3)2
о
 ксид углерода (валентность II) СО степень окисления +2
ксид углерода (валентность II) СО степень окисления +2 муравьиная кислота HCOOH
м
 етан CH4
етан CH4карбиды металлов (карбид алюминия Al4C3) степень окисления -4
бинарные соединения с неметаллами (карбид кремния SiC)
Аллотропия углерода.
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Алмаз — это модификация углерода с атомной кристаллической решеткой. Алмаз — самое твердое минеральное кристаллическое вещество, прозрачное, плохо проводит электрический ток и тепло. Атомы углерода в алмазе находятся в состоянии sp3-гибридизации.
Графит — это аллотропная модификация, в которой атомы углерода находятся в состоянии sp2-гибридизации. При этом атомы связаны в плоские слои, состоящие из шестиугольников, как пчелиные соты. Слои удерживаются между собой слабыми связями. Это наиболее устойчивая при нормальных условиях аллотропная модификация углерода. Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода. Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
Качественные реакции:
Качественная реакция на карбонат-ионы CO32- — взаимодействие солей-карбона-тов с сильными кислотами. Более сильные кислоты вытесняют угольную кислоту из солей. При этом выделяется бесцветный газ, не поддерживающий горение –углекислый газ.
Например, карбонат кальциярастворяется в соляной кислоте:
CaCO3 + 2HCl → CaCl2 + H2O + CO2
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
CO2 + Ca(OH)2 → CaCO3 + H2O
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
CaCO3 + CO2 + H2O → Ca(HCO3)2
Химические свойства углерода
1. Углерод проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому углерод реагирует и с металлами, и с неметаллами.
1.1. Из галогенов углерод при комнатной температуре реагирует с фторомс образованием фторида углерода:
C + 2F2 → CF4
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглеродаикарбида кремниясоответственно:
C + 2S → CS2
C + Si → SiC
1.3. Углерод не взаимодействует сфосфором.
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
С + 2Н2 → СН4
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
4C + 3Al → Al4C3
2C + Ca → CaC2
1.6. При нагревании с избытком воздуха графит горит, образуя оксид углерода (IV):
C + O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C0 + H2+O → C+2O + H20
2.2. Углерод восстанавливает многие металлы из основных и амфотерныхоксидов. При этом образуются металл и угарный газ. Получение металлов из оксидов с помощью углерода и его соединений называют пирометаллургией.
Например, углерод взаимодействует с оксидом цинка с образованием металлического цинка и угарного газа:
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
Например, углерод взаимодействует с оксидом кальция с образованием карбида кальция и угарного газа. Таким образом, углерод диспропорционирует (является т окислителем и восстановителем) в данной реакции:
3С + СаО → СаС2 + СО
9С + 2Al2O3 → Al4C3 + 6CO
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV)и вода:
C + 2H2SO4(конц) → CO2 + 2SO2 + 2H2O
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV)и вода:
C + 4HNO3(конц) → CO2 + 4NO2 + 2H2O
2.5. Углерод проявляет свойства восстановителя и при сплавлении с некоторыми солями, в которых содержатся неметаллы с высокой степенью окисления.
Например, углерод восстанавливает сульфат натриядо сульфида натрия:
4C + Na2SO4 → Na2S + 4CO
Биологическая роль углерода.
Как и другие элементы - органогены, углерод в виде отдельного элемента не обладает биологическим значением, - биологической ролью обладают его соединения.
-
из различных соединений углерода (белки, жиры, углеводы, нуклеотиды, гормоны, амино- и карбоновые кислоты и др.) состоят все ткани организма;
-
является структурным компонентом всех органических соединений;
-
его соединения участвуют во всех биохимических процессах;
-
при окислении соединений углерода образуется необходимая для организма энергия;
-
оксид углерода (IV) CO2, образующийся в результате окисления соединений углерода, стимулирует дыхательный центр, регулирует значение рН крови.
Применение в медицине и народном хозяйстве углерода и его соединений.
В медицине:
В фармакологии и медицине широко используются различные соединения углерода - производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен (активированный уголь), применяется для абсорбции газов и выведения из организма различных токсинов; графит (в виде мазей) - для лечения кожных заболеваний; радиоактивные изотопы углерода - для научных медицинских исследований.
В народном хозяйстве:
Графит используется в карандашной промышленности, но в смеси с глиной, для уменьшения его мягкости. Также его используют в качестве смазки при особо высоких или низких температурах. Его невероятно высокая температура плавления, даёт возможность делать из него тигли для заливки металлов. Способность графита проводить электрический ток также даёт возможность изготавливать из него высококачественные электроды.
Алмаз, благодаря исключительной твердости, незаменимый абразивный материал. Алмазным напылением обладают шлифовальные насадки бормашин. Помимо этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области.
-
Напишите уравнение реакции между соляной кислотой и гидрокарбонатом натрия.
HCl + NaHCO3 → H2O + CO2 + NaCl
Билет №15
-
Азот, его важнейшие соединения. Биологическая роль азота. Применение в медицине и народном хозяйстве.
Азот расположен в главной подгруппе V группы и во втором периоде периодической системы химических элементов Менделеева. Электронная конфигурация азота в основном состоянии:

Атом азота содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом азота может образовать 3 связи по обменному механизму и 1 связь по донорно-акцепторному механизму. Таким образом, максимальная валентность азота в соединениях равна IV. Также характерная валентность азота в соединениях - III.
Степени окисления атома азота – от -3 до +5. Характерные степени окисления азота -3, 0, +1, +2, +3, +4, +5.
Азот в природе существует в виде простого вещества газа N2. Нет цвета, запаха и вкуса. Молекула N2 неполярная, следовательно, в воде азот практически нерастворим.
Азот – это основной компонент воздуха(79% по массе). В земной коре азот встречается в основном в виде нитратов. Входит в состав белков, аминокислот и нуклеиновых кислотв живых организмах.
Типичные соединения азота:
о ксид азота (валентность V) N2O5
ксид азота (валентность V) N2O5
азотная кислота HNO3 степень окисления +5
нитраты KNO3, AgNO3
оксид азота (валентность IV) NO2 степень окисления +4
о ксид азота (валентность III) N2O3
ксид азота (валентность III) N2O3
азотистая кислота HNO2 степень окисления +3
нитриты NaNO2, Ca(NO2)2
оксид азота (валентность II) NO степень окисления +2
оксид азота (валентность I) N2O степень окисления +1
а ммиак NH3
ммиак NH3
нитриды металлов Na3N, Ca3N2 степень окисления -3
бинарные соединения азота с неметаллами
Способы получения азота
1. Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита натрия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды. В колбу наливают раствор хлорида аммония, а капельную воронку раствор нитрита натрия. При приливании нитрита натрия в колбу начинается выделение азота. Собирают выделяющийся азот в цилиндр. Горящая лучинка в атмосфере азота гаснет.
NaNO2 + NH4Cl → NH4NO2 + NaCl
NH4NO2 → N2 + 2H2O
Суммарное уравнение процесса:
NaNO2 + NH4Cl → N2 + NaCl + 2H2O
Азот также образуется при горении аммиака:
4NH3 + 3O2 → 2N2 + 6H2O
2. Наиболее чистый азот получают разложением азидовщелочныхметаллов.
Например, разложением азида натрия:
2NaN3 → 2Na + 3N2
3. Еще один лабораторный способ получения азота — восстановление оксида меди (II) аммиаком при температуре
700 °C:
из различных соединений углерода (белки, жиры, углеводы, нуклеотиды, гормоны, амино- и карбоновые кислоты и др.) состоят все ткани организма;
является структурным компонентом всех органических соединений;
его соединения участвуют во всех биохимических процессах;
при окислении соединений углерода образуется необходимая для организма энергия;
оксид углерода (IV) CO2, образующийся в результате окисления соединений углерода, стимулирует дыхательный центр, регулирует значение рН крови.
Напишите уравнение реакции между соляной кислотой и гидрокарбонатом натрия.
Азот, его важнейшие соединения. Биологическая роль азота. Применение в медицине и народном хозяйстве.
3CuO + 2NH3 → 3Cu + N2 + 3H2O
В промышленности азот получают, буквально, из воздуха. При промышленном производстве очень важно, чтобы сырье было дешевым и доступным. Воздуха много и он пока бесплатный.
Используются различные способы выделения азота из воздуха — адсорбционная технология, мембранная и криогенная технологии.
Адсорбционные методыразделения воздуха на компоненты основаны на разделения газовых сред в азотных установках лежит явление связывания твёрдым веществом, называемым адсорбентом, отдельных компонентов газовой смеси.
Основным принципом работы мембранных систем является разница в скорости проникновения компонентов газа через вещество мембраны. Движущей силой разделения газов является разница парциальных давлений на различных сторонах мембраны.
В основе работы криогенных установок разделения воздуха лежит метод разде-ления газовых смеси, основанный на разности температур кипения компонентов воздуха и различии составов находящихся в равновесии жидких и паровых смесей.
Химические свойства азота
При нормальных условиях азот химически малоактивен.
1. Азот проявляет свойства окислителя (с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (с элементами, расположенными выше и правее). Поэтому азот реагирует с металлами и неметаллами.
1.1. Молекулярный азот при обычных условиях с кислородом не реагирует. Реагирует с кислородом только при высокой температуре (2000оС), на электрической дуге (в природе – во время грозы):
N2 + O2 ⇄ 2NO – Q
Процесс эндотермический, т.е. протекает с поглощением теплоты.
1.2. При сильном нагревании (3000оС - 5000оС или действие электрического разряда) образуется атомарный азот, который реагирует с серой, фосфором, мышьяком, углеродом с образованием бинарных соединений:
2С + N2 → N≡C–C≡N
Молекулярный азот, таким образом, не реагирует с серой, фосфором, мышьяком, углеродом
.
1.3. Азот взаимодействует сводородом при высоком давлении и высокой температуре, в присутствии катализатора. При этом образуется аммиак:
N2 + ЗН2 ⇄ 2NH3
Этот процесс экзотермический, т.е. протекает с выделением теплоты.
1.4. Азот реагирует с активными металлами: с литием при комнатной температуре, кальцием, натрием и магнием при нагревании. При этом образуются бинарные соединения - нитриды.
Например, литий реагирует с азотом с образованием нитрида лития:
N2 + 6Li → 2Li3N
2. Со сложными веществами азот практически не реагирует из-за крайне низкой реакционной способности.
Взаимодействие возможно только в жестких условиях с активными веществами, например, сильными восстановителями.
Например, азот окисляет гидрид лития:
N2 + 3LiH → Li3N + NH3
Биологическая роль азота.
Чистый (элементарный) азот сам по себе не обладает какой - либо биологической ролью. Биологическая роль азота обусловлена его соединениями. Так в составе аминокислот он образует пептиды и белки (наиболее важный компонент всех живых организмов); в составе нуклеотидов образует ДНК и РНК (посредством которых передается вся информация внутри клетки и по наследству); в составе гемоглобина участвует в транспорте кислорода от легких по органам и тканей.
Некоторые гормоны также представляют собой производные аминокислот, а, следовательно, также содержат азот (инсулин, глюкагон, тироксин, адреналин и пр.). Некоторые медиаторы, при помощи которых «общаются» нервные клетки также имеют в своем составе атом азота (ацетилхолин).
Такое соединения как оксид азота (II) и его источники (например, нитроглицерин – лекарственное средство для снижения давления) воздействуют на гладкую мускулатуру кровеносных сосудов, обеспечивая ее расслабление и расширение сосудов в целом (приводит к снижению давления).
Применение в медицине и народном хозяйстве
-
свободный азот применяют во многих отраслях промышленности: как инертную среду в химических и металлургических процессах; -
для заполнения свободного пространства в ртутных термометрах; -
жидкий азот применяют в холодильных установках; -
большое количество азота идет на синтез аммиака, из которого получают азотную кислоту, минеральные удобрения (мочевину, сульфаты и фосфаты аммония); -
производство взрывчатых веществ; -
жидкий азот в медицине; -
насыщение поверхности стали для повышения прочности.