Файл: 1. Элементарлы талдау а талданатын заттаы жеке компоненттерді анытайтын сапалы жне санды талдау дістері.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 1535
Скачиваний: 1
СОДЕРЖАНИЕ
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
*С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
A) Сұйылтылған азот қышқылымен.
A) Сұйылтылған хлорсутек қышқылы.
A) Калийдің гексанитрокупраты(II).
B) Қорғасынның гексанитрокупраты(II).
C) Натрийдің гексанитрокупраты(II).
*D) Калий және қорғасынның гексанитрокупраты(II).
*A) Қаныққан натрий карбонаты ерітіндісімен өңдеу
A) Концентрлі аммиак ерітіндісі.
B) Қаныққан натрий карбонаты ерітіндісі.
A) Концентрлі аммиак ерітіндісі.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
201. АmBn жүйесі үшін тұнбаның түзілу жағдайы ( ):
A) КS мәні температураға тәуелді емес.
B) Температура жоғарылаған сайын Кsмәні артады.
222. Комплекстүзу реакциясы арқылы ерітіндіге нашар өтетін тұнба:
*A) Оствальдтың сұйылту заңына.
*A) Оствальдтың сұйылту заңына.
D) Тұнбаға түсіру кезіндегі ортаның рН мәнімен.
А) Массаларының қатынасы 1:10.
В) Көлемдерінің қатынасы 1:10.
*Е) Эквивалент мөлшерлерінің қатынасы 1:1.
*C) Индикатормен де, индикаторсыз да.
*A) Жұтылу спектрі - жұтылған жарықтың толқын ұзындығы.
A) Электромагнитті сәулеленудің табиғатын білу үшін.
*A) Жұмысшы электроды потенциалы – титрант көлемі.
*A) Жартылай толқын потенциалдардың айырымын арттыру үшін
B) Оптикалық жұтылу мен жұтылу қабатындағы толқын ұзындығыарасындағы сызықтық байланыс.
C) Оптикалық жұтылу мен жарық жұтылуындағы толқын ұзындығы арасындағы сызықтық байланыс.
D) Молярлық жұтылу мен толқын ұзындығы арасындағы сызықтық байланыс.
A) Тұрақты ток күшіндегі кулонометрия.
*A) Ток күшінің уақытқа көбейтіндісі.
B) Кернеудің уақытқа көбейтіндісі.
С)
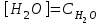
D) a=C
Е)
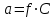
186. Химиялық реакцияның тепе-теңдік константасы тәуелді:
*А) Температураға.
В) Бастапқы заттар концентрациясына.
С) Аралық өнім концентрациясына.
D) Өнімнің концентрациясына.
Е) Бастапқы заттардың көлеміне.
187. Химиялық реакцияның лездік жылдамдығын анықтайтын өрнек:
А)

*В)
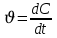
С) a=C
D)

Е)

188.
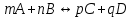 тепе-теңдіктегі реакциясы үшін концентрациялық және термодинамикалық константалар арасындағы байланыс:
тепе-теңдіктегі реакциясы үшін концентрациялық және термодинамикалық константалар арасындағы байланыс: *A)
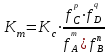
B)
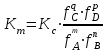
C)
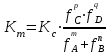
D)
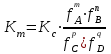

E)
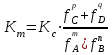
189. Қайтымды процестердегі mA + nB = pC + qD аналитикалық реакциясы үшін термодинамикалық константа мәні:
*А)
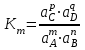
В)
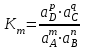
С)
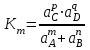
D)
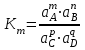
Е)
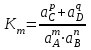
190. Массалар әрекеттесу заңы бойынша
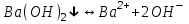 тепе-теңдік жүйесіне сәйкес келетін теңдеу:
тепе-теңдік жүйесіне сәйкес келетін теңдеу:A) Ks = [Ba2+] = [OH-]
B) Ks = [Ba2+] = [OH-]2
C) Ks = [Ba2+][OH-]
*D) Ks = [Ba2+][OH-]2
E) Ks = [Ba(OH)2] = [Ba2+][OH-]2
191. Барий сульфатының таза судағы молярлық ерігіштігі, оның 0,01 моль/л натрий сульфаты ерітіндісіндегі ерігіштігінен артық (Кs(BaSO4) = 1,1·10-10):
A) *1000 есе
B) 2200 есе
C) 3500 есе
D) 20 есе
E) 4772 есе
192. Ерігіштік көбейтіндісінің өлшем бірлігі:
A) г-моль/л
*B) Өлшемсіз шама.
C) г-моль/лn; мұндағы n молекуладағы иондар саны.
D) г-моль/л1/n;мұндағыn молекуладағы иондар саны.
E) г/л
193. Ag+, Pb2+, Ca2+, Ba2+ иондары бар ерітіндіге K2C2O4 ерітіндісін қосқан кезде тұнбалардың түзілу реті (Ks(Ag2C2O4) = 3,5·10-11; Ks(PbC2O4) = 4,8·10-10; Ks(CaC2O4) = 2,3·10-9; Ks(BaC2O4) = 1,1·10-7):
A) PbC2O4, BaC2O4, Ag2C2O4, CaC2O4
B) PbC2O4, Ag2C2O4, BaC2O4, CaC2O4
C) CaC2O4, Ag2C2O4, BaC2O4, PbC2O4
D) Тұнбаның түзілу реті Ks мәніне тәуелсіз.
E) PbC2O4, CaC2O4, Ag2C2O4, BaC2O4,
194. Кальций және барий хлоридтерін Na2SO4 және Na2CO3 ерітінділерімен өңдеген кезде түзілген тұнбаның құрамы (Ks(BaCO3) = 5,1·10-9; Ks(BaSO4) = 1,1·10-10; Ks(CaCO3) = 4,8·10-9; Ks(CaSO4) = 9,1·10-6):
*A) BaSO4+ CaCO3
B) BaSO4+ CaSO4
C) BaCO3 + CaCO3
D) BaCO3+ CaSO4
E) BaSO4 + CaCl2
195. Тұнбаның ерігіштігіне 1,5 есе артық қосылған тұндырғыштың әсері:
A) Ерігіштікті арттырады.
*B) Ерігіштікті кемітеді.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
E) Ерігіштік өзгермейді.
196. Сусыз еріткіштердің тұздар ерігіштігіне әсері:
A) Ерігіштікті арттырады.
*B) Ерігіштікті кемітеді.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
E) Ерігіштік өзгермейді.
197. Кальций фосфатының ерігіштігін есептейтін формула:
A)
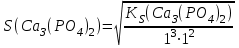
B)
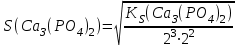
C)
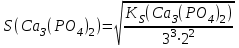
D) *
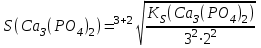
E)
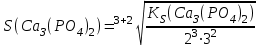
198. 0,01 М KCl мен 0,001 М AgNO3 ерітінділерінің бірдей көлемдерін араластырғанда тұнба түзіле ме Ks(AgCl) =1,78·10-10:
A) Түзілмейді.
B)*Түзіледі.
C) Ерітінді қанықпаған болады.
D) Ерітінді қаныққан болады.
E) Золь пайда болады.
199. Аттас иондардың нашар еритін қосылыстардың ерігіштігіне әсері:
A) Әсер етпейді.
B) *Ерігіштік төмендейді.
C) Ерігіштік артады.
D) Тұнба толық ериді.
E) Қанықпаған ерітінді түзіледі.
200. Нашар еритін қосылыстардың ерігіштігіне аттас емес иондардың әсері:
A) *Ерігіштік ұлғаяды.
B) Ерігіштік төмендейді.
C) Тұнба толық ериді.
D) Әсер етпейді.
E) Қаныққан ерітінді түзіледі.
201. АmBn жүйесі үшін тұнбаның түзілу жағдайы (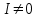 ):
):
A)
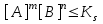
*B)

C)
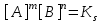
D)
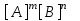 жүйесі Кs мәніне тәуелсіз.
жүйесі Кs мәніне тәуелсіз.E)
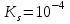 тең болғанда тәуелділік сақталады.
тең болғанда тәуелділік сақталады.202. Ерігіштік көбейтіндісі Кs мәнінің температураға тәуелділігі:
A) КS мәні температураға тәуелді емес.
B) Температура жоғарылаған сайын Кsмәні артады.
*C) Тұнба қасиеттеріне байланысты Кs мәні артады немесе кемиді.
D) Температура жоғарылаған сайын К
s мәні төмендейді.
E) Температура жоғарылаған сайын Кs мәні артады, соңынан төмендейді.
203. Солдан оңға қарай бағытта жүретін реакция (Ks(PbCl2) = 1,6·10-5; Ks(AgCl) = 1,78·10-10; Ks(AgJ) = 8,3·10-17, Ks(PbJ2) = 1,1·10-9):
A) PbCl2 + 2AgJ → 2AgCl + PbJ2
*B) PbCl2 + 2AgNO3 → Pb(NO3)2 + 2AgCl
C) AgJ + KCl → AgCl + KJ
D) Pb(NO3) 2 + 2AgJ → PbJ2 + 2AgNO3
E) 2AgCl + Pb(NO3) 2 → PbCl2 + 2AgNO3
204. Массалар әрекеттесу заңы бойынша Al(OH)3↓ ↔ Al3+ + 3OH-тепе-теңдіктегі жүйеге сәйкес келеді:
-
[Al3+] = [OH-] -
[Al3+] = [OH-]3 -
Ks = [Al3+][OH-] -
* Ks = [Al3+][OH-]3 -
Ks = [Al(OH)3] = [Al3+][OH-]3
205. Ерігіштік көбейтіндісі Ks(AgCl) = 1,78·10-10тең болатын AgClерігіштігі (моль/л):
-
10-10 -
10-7 -
*10-5 -
10-3 -
1
206. Ерігіштігі S(Ag2CrO4) = 5·10-5моль/лтең болатын Ag2CrO4 ерігіштік көбейтіндісі:
-
5·10-15 -
1·10-15 -
*5·10-13 -
1·10-10 -
5·10-5
207. KNO3 қосқанда PbSO4 тұзының ерігіштігі:
А) Кемиді.
В) Кемиді, содан соң артады.
С) Артады, содан соң кемиді.
D) Өзгермейді.
Е) *Артады.
208. Комплекстүзу реакциясы арқылы ерітіндіге оңай өткізуге болатын тұнба:
-
*Ks(AgBrO3) = 5,5·10-5 -
Ks(AgCl) = 1,78·10-10 -
Ks(AgBr) = 5,3·10-13 -
Ks(AgJ) = 8,3·10-17
Е) Ks(Ag2S) = 6,3·10-50
209. Ерігіштігі S(Mg(OH)2) = 5·10-5 моль/л тең болатын Mg(OH)2 ерігіштік көбейтіндісі:
-
*5·10-10 -
5·10-8 -
1·10-7 -
5·10-4 -
2·10-2
210. Ерігіштік көбейтіндісі Ks(PbJ2) = 1,1·10-9 тең болатын PbJ2 ерігіштігі (моль/л):
-
4·10-9 -
1·10-9 -
1·10-6 -
*1·10-3 -
1·10-1
211. Гидроксид - ионының қандай концентрациясында Mg2+-ионы Mg(OH)2 түрінде толық тұнбаға түседі (Кs(Mg(OH)2=1,6·10-11):
-
4·10-6 -
2·10-5 -
*4·10-3 -
5·10-2 -
1·10-1
212. 0,01 МNa2SO4 ерітіндісі қосылғаннан кейінгі барий сульфатының ерігіштігі (Ks(BaSO4) = 1,1·10-10):
-
10-10 моль/л -
*10-8 моль/л -
10-5 моль/л -
10-3 моль/л -
10-2 моль/л
213. 0,1 МKNO3 ерітіндісі қосылғаннан кейін барий сульфатының ерігіштігі:
-
*Артады. -
Өзгермейді. -
Төмендейді. -
Бастапқы кезде артады содан кейін өзгермейді. -
Бастапқы кезде төмендейді содан кейін өзгермейді.
214. K2SO4 қосылғаннанкейін барий сульфатының ерігіштігі:
-
Артады. -
Өзгермейді. -
*Төмендейді. -
Бастапқы кезде артады содан кейін өзгермейді. -
Бастапқы кезде төмендейді содан кейін өзгермейді.
215. Көлемдері бірдей 0,01 МPbCl2мен 0,01 МK2SO4ерітінділерін араластырғанда (Ks(PbSO4) = 1,6·10-8):
-
Тұнба түзілмейді. -
*Кристалды ақ тұнба түзіледі. -
Аморфты сары тұнба түзіледі. -
Біраз уақытқа қалдырғанда тұнба түзіледі. -
Ыдыс қабырғасын таяқшамен үйкелеген кезде ғана тұнба түзіледі.
216. 0,001 МAgNO3 ерітіндісіне бірдей көлемде қосылатын KClерітіндісінің тұнба түзілу үшін қажет болатын минималды концентрациясы (Ks(AgCl) = 1,78·10-10):
-
10-10 -
10-8 -
*10-6 -
10-4 -
10-2
217. Қорғасын концентрациясы көп болатын тұздың қаныққан ерітіндісі:
-
*Ks(PbMoO4) = 4,0·10-6 -
Ks(PbSO4) = 1,6·10-8 -
Ks(PbS) = 2,5·10-27 -
Ks(PbCO3) = 7,5·10-14 -
Ks(PbCrO4) = 1,8·10-14
218. Анықталатын ионды тұнбаға түсіру үшін тұндырғыш реагентті қосады:
-
Реакция теңдеуін теңестіргеннен кейінгі қажет мөлшерден кішкене аз алады. -
Реакция теңдеуін теңестіргеннен кейінгі эквивалент мөлшерін. -
*1,5 есе артық. -
5 есе артық. -
Көп мөлшерде.
219. Концентрациясы6·10-2моль/л магний хлориді ерітіндісіненMg(OH)2түрінде тұнбаға түсе бастайтын рН мәні (Ks(Mg(OH)2) = 6·10-10):
-
2 -
4 -
6 -
8 -
*10
220. Концентрациясы 5·10-4моль/лмыс нитраты ерітіндісіненСu(OH)2түрінде тұнбаға түсе бастайтын рН мәні (Ks(Cu(OH)2) = 2,2·10-20):
-
2 -
4 -
*6 -
8 -
10
221. Концентрациялары 0,01 моль/л
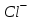 және
және 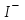 иондары бар ерітіндіге 0,01 моль/л AgNO3 ерітіндісімен әсер еткенде бірінші тұнбаға түседі (Ks(AgCl) = 1,78·10-10;Ks(AgJ) = 8,3·10-17):
иондары бар ерітіндіге 0,01 моль/л AgNO3 ерітіндісімен әсер еткенде бірінші тұнбаға түседі (Ks(AgCl) = 1,78·10-10;Ks(AgJ) = 8,3·10-17): -
AgCl -
*AgJ -
AgClжәнеAgJ бірге түседі. -
Екі тұз да тұнбаға түспейді. -
Қос тұз түрінде тұнбаға түседі.