Файл: 1. Элементарлы талдау а талданатын заттаы жеке компоненттерді анытайтын сапалы жне санды талдау дістері.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 1483
Скачиваний: 1
СОДЕРЖАНИЕ
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
*С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
A) Сұйылтылған азот қышқылымен.
A) Сұйылтылған хлорсутек қышқылы.
A) Калийдің гексанитрокупраты(II).
B) Қорғасынның гексанитрокупраты(II).
C) Натрийдің гексанитрокупраты(II).
*D) Калий және қорғасынның гексанитрокупраты(II).
*A) Қаныққан натрий карбонаты ерітіндісімен өңдеу
A) Концентрлі аммиак ерітіндісі.
B) Қаныққан натрий карбонаты ерітіндісі.
A) Концентрлі аммиак ерітіндісі.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
201. АmBn жүйесі үшін тұнбаның түзілу жағдайы ( ):
A) КS мәні температураға тәуелді емес.
B) Температура жоғарылаған сайын Кsмәні артады.
222. Комплекстүзу реакциясы арқылы ерітіндіге нашар өтетін тұнба:
*A) Оствальдтың сұйылту заңына.
*A) Оствальдтың сұйылту заңына.
D) Тұнбаға түсіру кезіндегі ортаның рН мәнімен.
А) Массаларының қатынасы 1:10.
В) Көлемдерінің қатынасы 1:10.
*Е) Эквивалент мөлшерлерінің қатынасы 1:1.
*C) Индикатормен де, индикаторсыз да.
*A) Жұтылу спектрі - жұтылған жарықтың толқын ұзындығы.
A) Электромагнитті сәулеленудің табиғатын білу үшін.
*A) Жұмысшы электроды потенциалы – титрант көлемі.
*A) Жартылай толқын потенциалдардың айырымын арттыру үшін
B) Оптикалық жұтылу мен жұтылу қабатындағы толқын ұзындығыарасындағы сызықтық байланыс.
C) Оптикалық жұтылу мен жарық жұтылуындағы толқын ұзындығы арасындағы сызықтық байланыс.
D) Молярлық жұтылу мен толқын ұзындығы арасындағы сызықтық байланыс.
A) Тұрақты ток күшіндегі кулонометрия.
*A) Ток күшінің уақытқа көбейтіндісі.
B) Кернеудің уақытқа көбейтіндісі.
*A) Метил қызыл-сарысы.
B) Фенолфталеин.
C) Әмбебап индикатор.
D) Крахмал.
E) Калий хроматы.
444. Алкалиметрия әдісіндегі негізгі индикатор:
A) Метил қызыл-сарысы.
*B) Фенолфталеин.
C) Әмбебап индикатор.
D) Крахмал.
E) Калий хроматы.
445. Түссізден малина түске өзгеретін фенолфталеин индикаторының рН мәні:
A) 8
B) 4
C) 7
*D) 9
E) 6
446. рН = 1,0 болғанда метил қызыл-сары индикаторының түсі:
A) Түссіз.
B) Сары.
*C) Қызыл.
D) Қызыл-сары.
E) Көк.
447. Фенолфталеин индикаторы рН мәнінің ауысу интервалы:
A) 4,2 - 6,2
*B) 8,2 - 10,0
C) 5,0 - 8,0
D) 3,2 - 4,4
E) 1,2 - 2,8
448. Қышқылдық-негіздік титрлеу бойынша судың карбонаттық кермектілігін анықтауда қолданылатын индикатор:
*A) Метил қызыл-сарысы.
B) Метил қызыл.
C) Фенолфталеин.
D) Әмбебап индикатор.
E) Көк лакмус.
449. Индикаторлар теориясының негізгі теңдеуі:
A)

*B)
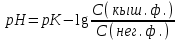
C)
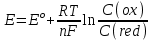
D)
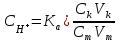
E)
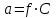
450. "Индикаторлар дегеніміз құрамында иондалмаған молекула түрінде және ион түрінде түстері әр түрлі болатын әлсіз органикалық қышқылдар мен негіздер" бұл индикаторлар теориясы бойынша негізделген:
-
Хромофорлы теорияға. -
*Иондық теорияға. -
Координациялық-иондық теорияға. -
Хинофенолятты теорияға. -
Барлық теорияларға.
451. "Органикалық қосылыстардың түстерінің өзгеруі молекула құрылысына байланысты, яғни ішкітоптасуларға байланысты молекула құрылысы өзгереді" бұл индикаторлар теориясы бойынша негізделген:
-
*Хромофорлы теорияға. -
Иондық теорияға. -
Координациялық-иондық теорияға. -
Хинофенолятты теорияға. -
Барлық теорияларға.
452. "Қышқылдық индикаторлар ерітінділерінде бір-бірімен байланысқан тізбек бар HІnd0 - HІnd - H+ + Іnd-" бұл индикаторлар теориясы бойынша негізделген:
-
Хромофорлы теорияға. -
Иондық теорияға. -
Координациялық-иондық теорияға. -
Хинофенолятты теорияға. -
Иондық-хромофорлы теорияға.
453. Индикатор түсін өзгертетін рН-тың белгілі бір аймағы:
-
Индикатордың иондану константасы. -
Титрлеу көрсеткіші. -
*Индикатор түсін өзгерту аймағы. -
Титрлеу қисығы. -
Титрлеу секірмесі.
454. Қышқылдық-негіздік индикаторлар үшін түс ауысу аймағының мәні:
-
pH = 1 - 14 -
pH = 1 - 7 -
pH = 7 - 14 -
pH = 7 1 -
*pH = pK 1
455. Титрлеу аяқталған кездегі рН мәні:
-
Индикатордың иондану константасы. -
*Титрлеу көрсеткіші. -
Индикатор түсін өзгерту аймағы. -
Титрлеу қисығы. -
Титрлеу секірмесі.
456. Қышқылдық-негіздік титрлеу әдісінде титрлеу қисығы көрсетеді:
-
Қышқыл көлемінің сілті көлеміне тәуелділігін. -
Жалпы көлемнің титрант көлеміне тәуелділігін. -
*Ерітінді рН-ының титранттың жалпы көлеміне тәуелділігін. -
Ерітінді электрөткізгіштігінің титрлеу процесіндегі ерітіндінің жалпы көлеміне тәуелділігін. -
Ерітінді потенциалының титрлеу процесіндегі ерітіндінің жалпы көлеміне тәуелділігін.
457. Күшті қышқылды күшті негізбен титрлеген кезде қолданылатын индикатор:
-
Титрлеу көрсеткішінің мәні титрлеудің бастапқы нүктесінің рН мәніне сәйкес келетін индикаторларды. -
Барлық индикаторларды. -
*Титрлеу көрсеткішінің мәні титрлеу қисығындағы титрлеу секірмесі аймағында жатқан рН мәніне сәйкес келетін индикаторларды. -
Титрлеу көрсеткішінің мәні титрлеудің аяқталу нүктесінің рН мәніне сәйкес келетін индикаторларды. -
Тек лакмус индикаторын.
458. Титрлеудің соңғы нүктесінде ерітіндіде күшті қышқылдың артық мөлшері болған кездегі индикаторлық қатенің түрі:
*A) Сутектік.
B) Қышқылдық.
C) Гидроксилдік.
D) Негіздік.
E) Молекулалық.
459. Сутектік қате пайда болатын жағдай:
*A) рТ < 7
B) рТ > 7
C) рТ = 7
D)
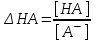
E)
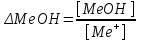
460. Титрлеудіңсоңғынүктесіндеерітіндідеәлсізнегіздіңартықмөлшеріболғанкездегіиндикаторлыққатеніңтүрі:
A) Сутектік.
B) Қышқылдық.
C) Гидроксилдік.
*D) Негіздік.
E) Молекулалық.
461. Титрлеудің соңғы нүктесінде ерітіндіде күшті сілтінің артық мөлшері болған кездегі индикаторлық қатенің түрі:
A) Сутектік.
B) Қышқылдық.
*C) Гидроксилдік.
D) Негіздік.
E) Молекулалық.
462. Эквивалентінің молярлық концентрациясы 0,1 моль/л хлорсутек қышқылын эквивалентінің молярлық концентрациясы 0,1 моль/л натрий гидроксидімен титрлеу кезіндегі бастапқы нүктедегі ерітіндінің рН:
*А) 1
В) 2
С) 7
D) 8
Е) 13
463. Күшті қышқылды күшті сілтімен титрлеу кезінде фенолфталеиннің түсі түссізден күлгінге өзгерген кездегі ерітіндідегі сутегі ионының концентрациясы:
А) 10-8
*В) 10-9
С) 10-10
D) 10-11
Е) 10-12
464. Күшті сілтіні күшті қышқылмен титрлеуде метил қызыл-сарысының түсі қызыл түске өзгерген кездегі ерітіндідегі сутек ионының концентрациясы:
А) 10-1
В) 10-2
*С) 10-4
D) 10-6
Е) 10-7
465. Циммерман-Рейнгард қоспасы қатысында титрлеуді жүргізетін жартылай реакция:
A)
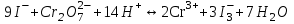
B)
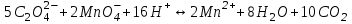
*C)
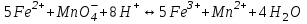
D)
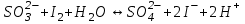
E)
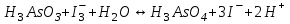
466. Бірнеше заттарды жеке-жеке титрлеу үшін редокс-жұптардың стандартты потенциалының айырмашылығы болуы керек:
*A) 0,2В
B) 1,0В
C) 0,1В
D) 0,01В
E) 0,02В
467. Тотығу-тотықсыздану индикаторының түс өзгеру ауданын есептейтін формула:
A)
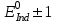
B)
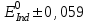
*C)
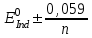
D)
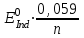
E)
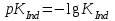
468. Нернст теңдеуіне сәйкес келетін формула:
A) *
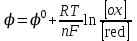
B)
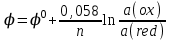
C)
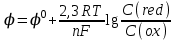
D)
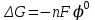
E)
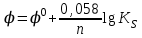
469. Надхром қышқылындағы хромның тотығу дәрежесі мен валенттілігі:
A) 2
B) 3
C) 4
D) 5
E) *6
470. SnO32- + 6H+ + 2e- → Sn2+ + 3H2O (E0 = +0,84 В), Cr2O72- + 14H+ + 6e-→ 2Cr3+ + 7H2O (E0 = +1,33 В) жартылай реакцияларда келтірілген иондардың дұрыс химиялық әрекеттесуі:
A) *Cr2O72- + Sn2+ + 14H+
B) SnO32- + 2Cr3+ + 6H+
C) Cr2O72- + SnO3- + 14H+
D) Sn2+ + 2Cr3+
E) Cr2O72- + SnO32- + 6H+
471. J2 + 2e- → 2J-(E0=+0,54 В), AsO43- + 2H2O + 2e-→ AsO2- + 4OH- (E0=-0,67 В) жартылай реакцияларда келтірілген иондардың дұрыс химиялық әрекеттесуі:
A) AsO43- + 2J-
B) *J2 + AsO2- + 4OH-
C) 2J- + AsO2-
D) AsO43- + J2
E) J2 + AsO2-
472. Перманганатометриялық титрлеу кезінде Mn2+ ионы түзілу үшін қажет:
A) Бейтарап орта
B) Сілтілік орта
C) Сілтілік орта фенолфталеин қатысында
D) *Қышқылдық орта
E) Қышқылдық орта, метилоранж қатысында
473. KMnO4 ерітіндісін стандартауға қолданылатын қосылыс:
*A) Na2C2O4
B) NaCl
C) K2Cr2O7
D) Na2S2O3·5H2O
E) Na2CO3
474. KMnO4 ерітіндісін титрлеуде индикатор қолданылады, егер концентрациясы тең болса:
A) 1,0
B) 0,1
C) 0,05
D) 0,02
*E) 0,01
475. Пероксидті перманганатометриялық анықтауда қолданылады:
*A) Тура титрлеу.
B) Кері титрлеу.
C) Орынбасу титрлеу.
D) Реверсивті титрлеу.
E) Комплексонометриялық титрлеу.
476. KMnO4 ерітіндісін стандарттаудың дұрыс шарты:
A) KMnO4 дәл өлшенген сынамасын судың белгілі көлемінде ерітеді.
B) KMnO4концентрациясын шамамен даярлап, бірден стандарттайды.
C) KMnO4 концентрациясын шамамен даярлап 20-30 мин қайнатады, салқындатады, қағаз фильтрмен сүзеді, содан соң стандарттайды.
*D) KMnO4 концентрациясын шамамен даярлап 7-10 күн күн түспейтін жерде сақтайды, шыны фильтрде сүзеді, содан соң стандарттайды.
E) KMnO4 концентрациясын шамамен даярлап 1-2 күннен кейін шыны фильтрде сүзеді, содан соң стандарттайды.
477. Жартылай реакциядағы
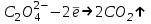 қымыздық қышқылының эквивалентінің молярлық массасы (М(H2C2O4·H2O)= 126,08 г/моль):
қымыздық қышқылының эквивалентінің молярлық массасы (М(H2C2O4·H2O)= 126,08 г/моль): A) 49,04
B) 31,61
C) 248,19
D) 127,11
*E) 63,04
478. Редоксиметрияда заттың химиялық эквиваленті - ол берілген зат бөлшегі эквивалентті: