Файл: 1. Элементарлы талдау а талданатын заттаы жеке компоненттерді анытайтын сапалы жне санды талдау дістері.docx
ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 03.12.2023
Просмотров: 1517
Скачиваний: 1
СОДЕРЖАНИЕ
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
*С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
С) 10-3 - 10-6 г; 10-1 - 10-4 мл
A) Сұйылтылған азот қышқылымен.
A) Сұйылтылған хлорсутек қышқылы.
A) Калийдің гексанитрокупраты(II).
B) Қорғасынның гексанитрокупраты(II).
C) Натрийдің гексанитрокупраты(II).
*D) Калий және қорғасынның гексанитрокупраты(II).
*A) Қаныққан натрий карбонаты ерітіндісімен өңдеу
A) Концентрлі аммиак ерітіндісі.
B) Қаныққан натрий карбонаты ерітіндісі.
A) Концентрлі аммиак ерітіндісі.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
201. АmBn жүйесі үшін тұнбаның түзілу жағдайы ( ):
A) КS мәні температураға тәуелді емес.
B) Температура жоғарылаған сайын Кsмәні артады.
222. Комплекстүзу реакциясы арқылы ерітіндіге нашар өтетін тұнба:
*A) Оствальдтың сұйылту заңына.
*A) Оствальдтың сұйылту заңына.
D) Тұнбаға түсіру кезіндегі ортаның рН мәнімен.
А) Массаларының қатынасы 1:10.
В) Көлемдерінің қатынасы 1:10.
*Е) Эквивалент мөлшерлерінің қатынасы 1:1.
*C) Индикатормен де, индикаторсыз да.
*A) Жұтылу спектрі - жұтылған жарықтың толқын ұзындығы.
A) Электромагнитті сәулеленудің табиғатын білу үшін.
*A) Жұмысшы электроды потенциалы – титрант көлемі.
*A) Жартылай толқын потенциалдардың айырымын арттыру үшін
B) Оптикалық жұтылу мен жұтылу қабатындағы толқын ұзындығыарасындағы сызықтық байланыс.
C) Оптикалық жұтылу мен жарық жұтылуындағы толқын ұзындығы арасындағы сызықтық байланыс.
D) Молярлық жұтылу мен толқын ұзындығы арасындағы сызықтық байланыс.
A) Тұрақты ток күшіндегі кулонометрия.
*A) Ток күшінің уақытқа көбейтіндісі.
B) Кернеудің уақытқа көбейтіндісі.
222. Комплекстүзу реакциясы арқылы ерітіндіге нашар өтетін тұнба:
-
Ni(OH)2; Ks(Ni(OH)2) = 2,0·10-15 -
NiCO3; Ks(NiCO3) = 1,3·10-7 -
NiC2O4; Ks(NiC2O4) = 4,0·10-10 -
NiS; Ks(NiS) = 3,2·10-19 -
*Ni(CN)2; Ks(Ni(CN)2) = 3,0·10-23
223. Сулы ерітіндідегі комплексті қосылыстың иондануы сипатталады:
А) Күшті электролиттер сияқты толық ионданады.
В) Комплексті тұздар алдымен әлсіз электролиттер сияқты ионданады, түзілген комплексті ион күшті электролиттер сияқты толық ионданады.
С) Комплексті тұздар әлсіз электролиттер сияқты ионданады.
D)* Комплексті тұздар алдымен күшті электролиттер сияқты ионданады, содан соң түзілген комплексті ион әлсіз электролиттер сияқты сатыланып ионданады.
Е) Комплекс тұздар бірінші және екінші сатысында да әлсіз электролиттер сияқты ионданады.
224. Комплекстүзу реакциясы арқылы ерітіндіге оңай өтетін тұнба:
А) Ni(OH)2; Ks(Ni(OH)2) = 2,0·10-15
В) *NiCO3; Ks(NiCO3) = 1,3·10-7
С) NiC2O4; Ks(NiC2O4) = 4,0·10-10
D) NiS; Ks(NiS) = 3,2·10-19
E) Ni(CN)2; Ks(Ni(CN)2) = 3,0·10-23
225. Металл сульфидтерінің ерігіштігі хлорсутекке қарағанда азот қышқылында жоғары, себебі:
A) Хлорсутекке қарағанда азот қышқылы күшті.
B) Металл сульфидтері күшті тотықсыздандырғыштар.
C) Хлорсутек қышқылының тотықсыздандырғыштық қасиеті сульфидтердің еруіне кедергі келтіреді.
*D) Азот қышқылының тотықтырғыштық қасиеті сульфидтердің еруіне мүмкіндік жасайды.
E) Азот қышқылының құрамындағы азоттың (ІV) оксиді сульфидтердің еруіне мүмкіндік жасайды.
226. AgC2O4↓ тұнбасы бар ерітіндідегі күміс ионының концентрациясын үш есе арттырса, тұнбаның ерігіштігі:
A) Өзгермейді.
B) Үш есе артады.
C) Үш есе кемиді.
*D) Тоғыз есе кемиді.
E) Тоғыз есе артады.
227. Концентрациялары бірдей KCl және K2CrO4 ерітінділеріне AgNO3 тамшылатып қосқан кезде, бірінші тұнбаға түседі (Ks(AgCl) = 1,78·10-10; Ks(Ag2CrO4) = 1,1·10-12):
A) Ag2CrO4
*B) AgCl
C) Тұнба түзілмейді.
D) Екі тұз бірге түзіледі.
E) Ag3CrO4Cl
228. Массасы 0,0069 г кальций карбонаты еріген 1 л қаныққан ерітіндінің ерігіштік көбейтіндісі Кs (М(CaCO3) = 100 г/моль):
A) 2,3·10-8
B) 7,5·10-3
*C) 4,8·10-9
D) 1,1·10
-5
E) 6,5·10-7
229. Ерігіштігі S = 1·10-3 моль/л тең, AB2 тұзының ерігіштік көбейтіндісі Ks:
A) 1·10-3
*B) 4·10-9
C) 2·10-6
D) 3·10-6
E) 4·10-6
230. Тұндырғыштың эквивалентті мөлшері қосылғанда Pb2+ ионының ерітіндіде қалатын мөлшері (Ks(PbSO4) = 1,6·10-8):
-
1,6·10-8 -
1,6·10-5 -
*1,6·10-4 -
1·10-2 -
1·10-1
231. Ерігіштік көбейтіндісі Ks = 1,08·10-23 тең, A2B3 тұзының ерігіштігі S (моль/л):
A) 2·10-23
*B) 1·10-5
C) 1·10-3
D) 1·10-7
E) 1·10-18
232. Ерігіштік көбейтіндісін есептейтін формула:
А)
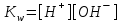
В)

С)

*D) Ks =[A]m[B]n
Е)
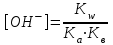
233. Нашар еритін хромат:
А) Ks(Ag2CrO4)=1,1·10-12
В) Ks(BaCrO4)=1,2·10-10
*С) Ks(PbCrO4)=1,8·10-14
D) Ks(SrCrO4)=3,6·10-5
Е) Ks(CaCrO4) = 7,1·10-4
234. Комплекстүзу реакциясы арқылы ерітіндіге өткізуге болмайтын тұнба:
-
AgBrO3; Ks(AgBrO3) = 5,5·10-5 -
AgCl; Ks(AgCl) = 1,78·10-10 -
AgBr; Ks(AgBr) = 5,3·10-13 -
AgJ; Ks(AgJ) = 8,3·10-17 -
*Ag2S; Ks(Ag2S) = 6,3·10-50
235. Қаныққан ерітіндіде:
А) ИК = Ks
*В) ИК >Ks
С) ИК < Ks
D) Белгілі бір заңдылық жоқ.
Е) Тұнба түзілмейді.
236. Аса қаныққан ерітіндіде:
А) ИК = Ks
*В) ИК >Ks
С) ИК
D) Спирт қосылғанда.
Е) Су қосылғанда.
237. Қанықпаған ерітіндіде:
А) ИК = Ks
*В) ИК
С) ИК >Ks
D) Спирт қосылғанда.
E) Қышқыл қосылғанда.
238. Протолиттік реакция:
А) Реагенттің молекуласындағы байланыс санының өзгеруі.
В) *Протонның бір бөлшектен екінші бөлшекке ауысуы.
С) Электрон жұбының ауысуынан комплексті қосылыстың түзілуі немесе бұзылуы.
Д) Электронның бір бөлшектен екінші бөлшекке ауысуы.
Е) Молекулалық бөлшектің бір реагенттен екінші реагентке ауысуы.
239. Протолиттік теория бойынша қышқыл болып табылатын бөлшек:
A)
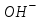
*B)
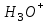
C)

D)
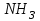
E)
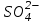
240. Протолиттік теория бойынша негіз болып табылатын бөлшек:
A)

B)
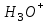
*C)
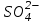
D)
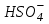
E) H2SO4
241. Протолиттік теория тұрғысынан лиат ионы:
*А)
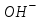
В)
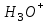
С)
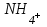
D)
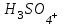
Е) 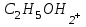
242. Протолиттік теория тұрғысынан лионий ионы:
*А)


В)
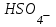
С)
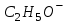
D)
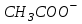
Е)
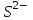
243. Бренстед-Лоури протолиттік теориясы бойынша сулы ерітінділердегі қышқыл:
*A) HClO4
C)

D) S2-
E)
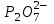
244. Бренстед-Лоури протолиттік теориясы бойынша сулы ерітінділердегі негіз:
A) HCOOH
*B)
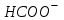
C)

D) H2CO3
E)

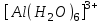
245. Бренстед-Лоури протолиттік теориясы бойынша сулы ерітінділерде негіз:
A) H2CO3
B) CH3COOH
*C) Cl-
D)

E) HCOOH
246. Бренстед-Лоури протолиттік теориясы бойынша сулы ерітінділердегі амфолит:
A) Cl-
B) S2-
C)

*D)
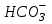
E)
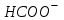
247. Бренстед-Лоури протолиттік теориясы бойынша қышқыл дегеніміз:
A) Суда ерігенде
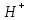 ионын бөліп диссоциацияланатын электробейтарап қосылыстар.
ионын бөліп диссоциацияланатын электробейтарап қосылыстар.B) Басқа атомның бос электрон жұбын пайдаланып, электрондық топтасудан кейін тұрақты атомдар түзетін қосылыстар.
C) Катионды бөліп шығаруға қабілетті бөлшек – протон, анионды бөліп шығаруға қабілетті бөлшек – электрон.
*D) Протонын беруге қабілетті бөлшек.
E) Сутегін еріткіштердің құрамындағы металл немесе электробейтарап бөлшектермен алмастырғанда түзілетін жаңа қосылыстар.
248. Бренстед-Лоури протолиттік теориясы бойынша негіз дегеніміз:
*A) Протонды қосып алуға қабілетті бөлшек.
B) Сутегін еріткіштердің құрамындағы металл немесе радикал бөлшектермен алмастырғанда түзілетін жаңа қосылыстар.
C) Суда ерігенде
 ионын бөліп диссоциацияланатын электробейтарап қосылыстар.
ионын бөліп диссоциацияланатын электробейтарап қосылыстар.D) Анионды бөліп шығаруға қабілетті бөлшек – электрон, катионды бөліп шығаруға қабілетті бөлшек – протон.
E) Басқа атомның бос электрон жұбын пайдаланып, электрондық топтасудан кейін тұрақты атомдар түзетін қосылыстар.
249. Бренстед-Лоури теориясы бойынша қышқылдық-негіздік реакциялар дегеніміз:
A)
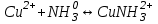
*B)
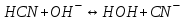
C)
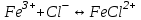
D)
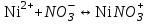
E)
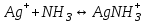
250. Амфолит болып табылады:
A) HCl
B) H2SO4
*C)

D) H2CO3
E)

251. Амфолит болып табылады:
A) H2SO4
B) HClO4
C) NaOH
*D)
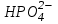
E)

252. Сулы ерітінділерінде амфолит болып табылады:
A) Na2C2O4
B) H2S
*C) KH2PO4
D) Na3PO4
E) HCN
253. 25 °С температурадағы судың иондық көбейтіндісі:
*А) 1·10-14
В) 1·1014
С) 1·10-7
D) 1·10+7
Е) 14
254. 25 °С температурадағы судың сутектік көрсеткіші: