ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.11.2019
Просмотров: 4046
Скачиваний: 98
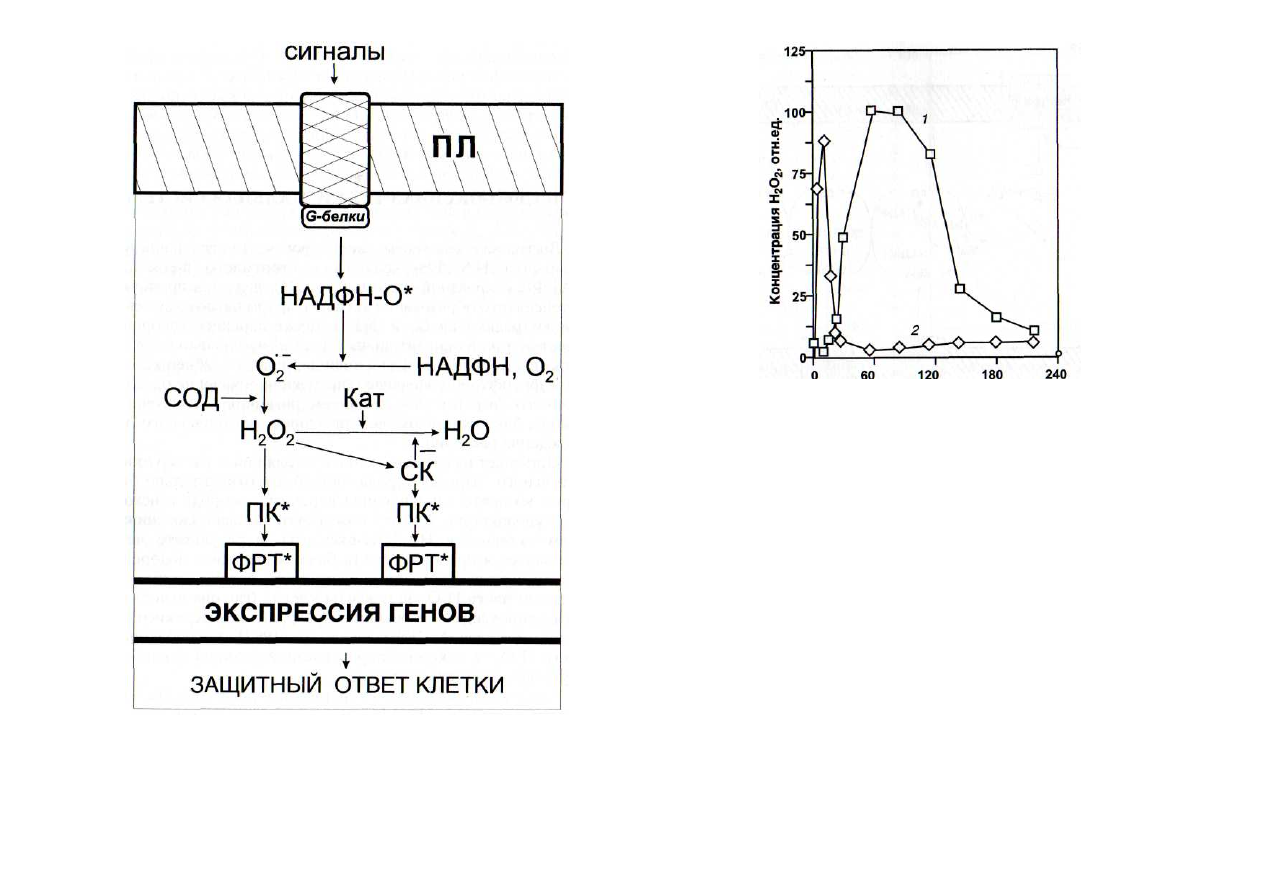
Рис. 24. Функционирование НАДФН-оксидазной сигнальной си-
стемы
Кат - каталаза; НАДФН-О* - активная форма НАДФН-оксидазы;
Of -
супероксиданион-радикал; ПК* - активные формы протеинки-
наз; СК - салициловая кислота; СОД - супероксиддисмутаза. Осталь-
ные обозначения - см. рис. 6
Время воздействия элиситора, мин
Рис. 25. Влияние белкового (/) и олигогалактуронатного (2) эли-
ситоров на образование перекиси водорода [Levine et al., 1994]
иероксидазы в клеточные стенки [McLusky et al., 1999]. Оба
нида ферментов катализируют реакции, в ходе которых об-
разуется перекись водорода. Но главное внимание исследо-
вателей механизмов окислительного "взрыва" продолжает
привлекать НАДФН-оксидаза плазмалеммы. Она представ-
ляет собой гетеродимерный цитохром 6-типа, состоящий из
субъединиц 22 и 91 кДа. Как и в случаях других сигнальных
систем, фермент (большая субъединица) оказался гомоло-
гичным ферменту животных объектов. Для активации фер-
мента требуется участие еще двух цитоплазматических бел-
ков _ 47 и 67 кДа. При действии патогенов или элиситоров
первый из этих двух белков фосфорилируется, затем они
мигрируют к плазмалемме и образуют активный комплекс
фермента.
Элиситориндуцируемое образование перекиси водоро-
да подавляется ингибиторами протеинкиназ, например
ставроспорином (рис. 27), но активируется ингибиторами
протеинфосфатазы 2А [Tenhaken et al., 1995], причем по-
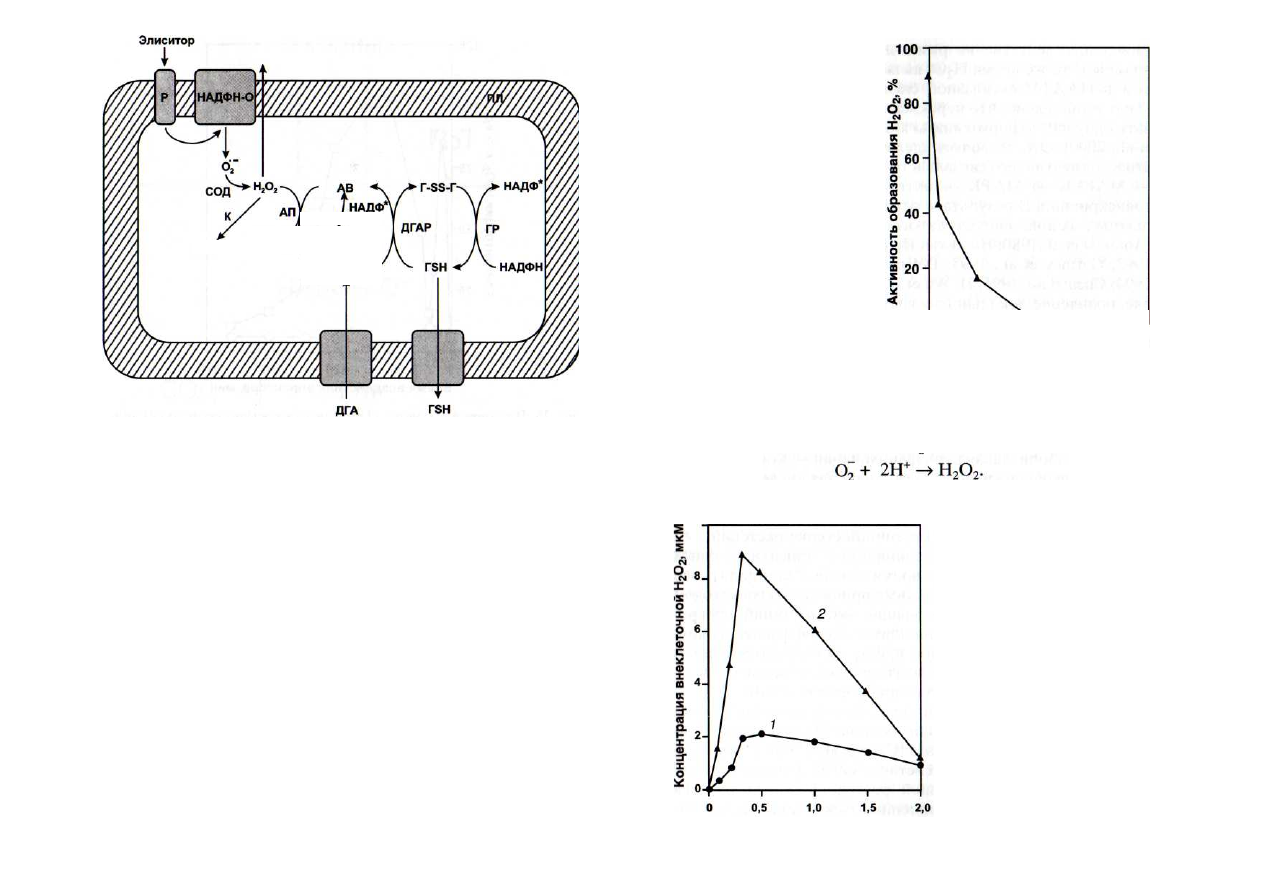
Рис. 26. Потребление перекиси водорода с помощью аскорбат-
глутатионового цикла [Vanacker et al., 1998]
АВ - аскорбат восстановленный; АП - аскорбатпероксидаза; ГР -
глутатион-редуктаза; TSH - глутатион восстановленный; Г-SS-T - ди-
сульфид глутатиона; ДГА - дегидроаскорбат; ДГАР - дегидроаскорбат-
редуктаза; К - каталаза; МДГА - монодегидроаскорбат; МДГАР - мо-
нодегидроаскорбат-редуктаза; ПЛ - плазмалемма; Р - рецептор; СОД -
супероксиддисмутаза
явление окислительного "взрыва" в этом случае происхо-
дит и в отсутствие элиситора. Все это свидетельствует о
важной роли фосфорилирования и дефосфорилирования
белков в осуществлении НАДФН-сигнального пути
[Levine et al., 1994; Chandra, Low, 1995; Chen et al., 1995;
Rajasekhar et al., 1999].
Для активации НАДФН-оксидазы требуется также уча-
стие G-белков, что подтверждается в опытах с активатором
G-
белков мастопараном (рис. 28). Стимулирующее влияние
фосфолипазы С на активность НАДФН-оксидазы позволя-
ет говорить о взаимодействии НАДФН-оксидазного пути с
кальциевой сигнальной системой. Это тем более вероятно,
Рис. 27. Влияние ставро-
спорина на образование
Н
2
О
2
[Chandra, Low, 1995]
Окислительный
взрыв
(накопление перекиси водо-
рода) в культуре клеток сои
индуцировался
олигогалак-
туронатным элиситором
Концентрация
мастопарана, мкМ
Рис. 28. Влияние мастопа-
рана на образование Н
2
О
2
в
культуре клеток петрушки,
индуцированное салицило-
вой кислотой [Kauss,
Jeblick, 1995]
1 -
контроль; 2 - клетки,
обработанные салициловой
кислотой
МДГА
Н
2
О«^ J
Н
2
О
МД
[
А
У
НАДФН
V
ДГА
что у с убъ единицы
91 кДа НАДФН-оксида-
{ы имеются два Са
2+
-
связывающих участка
| Keller et al., 1998].
Окисление НАДФН молекулярным кислородом
приводит к образованию супероксид-анионов, которые в
результате
реакции,
катализируемой
супероксиддисмутазой, превращаются в перекись водорода.
О
2
+ НАДФН -^ О~ + НАДФ
+
+ Н
+
;
■>
Ставроспорин, мкМ
Окислительный "взрыв" - это одна из самых быстрых
ответных реакций кле-
ток на действие элисито-
ров [Chandra, Low, 1995].
Значительное повы-
шение содержания ак-
тивных форм кислорода
О
2
и Н
2
О
2
оказывает по-
давляющее действие на развитие патогенных микроорга-
низмов. В то же время Н
2
О
2
является вторичным посредни-
ком в НАДФН-оксидазной сигнальной системе. Недавно
было установлено, что перекись водорода может активиро-
вать одну из изоформ киназы киназы МАР-киназы [Kovtun
et al.,
2000]. Это позволяет сделать предположение о веро-
ятности следующего сигнального пути: Н
2
О
2
—
> МАРККК —>
—
>
МАРКК —> МАРК —> активация факторов регуляции
транскрипции. В результате осуществляется экспрессия за-
щитных генов, синтез патогениндуцированных белков
[Antoniw et al.,1980; Hooft van Huijsduijnen et al., 1986; Raskin,
1992; Gaffney et al., 1993; Delaney et al., 1994; Levine et al.,
1994; Chen et al., 1995; H. Wu et al.,
1997; и др.] и, как следст-
вие, появление локального и системного иммунитета.
Большую роль в функционировании НАДФН-оксидаз-
ной системы играет салициловая кислота, концентрация ко-
торой при действии патогенов, элиситоров или экзогенной
перекиси водорода повышается в десятки раз [Leon et al.,
1995; Н. Wu et al., 1997; и др.]. Одной из причин "салицило-
вой вспышки" является элиситор-индуцируемое образова-
ние фенилаланин-аммиак-лиазы, в результате чего активи-
руется метаболическая цепь фенилаланин
—>
коричная кис-
лота —> бензойная кислота —> салициловая кислота. Второй
причиной может быть быстрая активация гидролазы, осво-
бождающей салициловую кислоту из О-|3-О-глюкозидсали-
цилата, локализованного в клеточной стенке растений.
Снижение содержания салицилата в элиситированных
клетках через некоторое время после "салицилатного
взрыва" объясняется несколькими причинами: его выходом
из клеток в апопласт и проводящие пути растений, превра-
щением в летучий метилсалицилат и его диффузией в окру-
жающее растение воздушное пространство, образованием
глюкозильного эфира салицилата и его отложением в кле-
точные стенки, деградацией салициловой кислоты.
Для выяснения функций салициловой кислоты начали
поиск салицилатсвязывающих белков. Оказалось, что та-
ким белком является каталаза [Chen et al., 1993]. Считается,
что салициловая кислота действует ингибирующе на ката-
лазу и, перекрывая основной расходный канал баланса
Н
2
О
2
, способствует ее накоплению. Некоторые исследова-
тели не разделяют этого мнения о роли салициловой кисло-
ты в НАДФН-оксидазной системе, однако полученные дан-
ные о существовании нескольких органоспецифичных изо-
форм катал азы, отличающихся способностью ингибиро-
ваться салицилатом, рассеяли эти сомнения. Кстати, было
обнаружено, что салициловая кислота - это ингибитор не
только каталазы, но и целого ряда других железосодержа-
щих ферментов [Chen et al., 1997] - аскорбат-пероксидаз,
аконитаз, АСС-оксидазы. Последнее объясняет, почему са-
лициловая кислота затормаживает синтез этилена [Leslie,
Romani,
1986; 1988]. Имеются результаты, свидетельствую-
щие о существовании активируемых салицилатом МАР-ки-
назах (SIPK) [Zhang, Klessig, 1997; Zhang et al., 1998; Romeis
et al., 1999; Mikolajczyk et al.,
2000] и о салицилатиндуцируе-
мых рецепторных киназах [Не et al., 1999], которые активи-
ровались также патогенами и окислительным стрессом
ICzernic et al.,
1999]. Если иметь в виду, что расположение
двух гидроксильных групп у салициловой кислоты и пере-
киси водорода может быть сходным [Тарчевский и др.,
i
999], то не исключено, что салицилатактивируемые проте-
инкиназы являются и Н
2
О
2
-
активируемыми протеинкиназа-
ми [Guyton et al., 1996].
Одним из важных последствий активации патогенами и
элиситорами НАДФН-оксидазной системы можно считать
появление так называемой сверхчувствительности инфици-
рованных и рядом расположенных клеток, что приводит к
их гибели и появлению некротических пятен. Отмирание
клеток - это результат включения специальной генетиче-
ской программы. У растений программируемая смерть кле-
ток (апоптоз) начала изучаться позднее, чем у животных,
причем было обнаружено, что механизмы апоптоза в ос-
новном идентичны [Самуилов и др., 2000; Shirasu, Schulze-
Lefert,
2000]. Необходимо отметить, что в апоптозе прини-
мают участие перекись водорода и салициловая кислота
НАДФН-оксидазной системы и некоторые интермедиаты
кальциевой, липоксигеназной, МАР-киназной и NO-синтаз-
ной сигнальных систем.
Ранее [Тарчевский и др., 19966] мы показали, что инфи-
цирование микоплазмой Acholeplasma laidlawii 118 приводит
к появлению ряда новых белков, синтез одного из которых
(38 кДа) индуцируется также салицилатом и янтарной кис-
лотой [Тарчевский и др., 1999]. Полученные данные позво-
ляют утверждать, что экзогенные салицилат и сукцинат
включают тот же сигнальный путь, который вызывает об-
разование части индуцируемых микоплазмами белков. Так
как это мог быть НАДФН-оксидазный путь, в котором
важную роль играет перекись водорода, то это побудило
нас провести сравнительное изучение действия экзогенных
салицилата (ингибитора каталазы) и сукцината на каталаз-
ную активность. Оказалось, что оба эти соединения в одних
и тех же концентрациях тормозят разложение Н
2
О
2
, т.е. яв-
ляются ингибиторами каталазы.
В связи с этим с помощью программы "Oxford molecular
modelling program"
мы построили молекулярные модели
Н
2
О
2
, салициловой и янтарной кислот. Близость расстояний
между водородными атомами гидроксильных групп во всех
трех типах молекул (у перекиси водорода - 2,62 А, салици-
лата - 2,56 А, у одной из возможных конформаций сукцина-
та - 2,64 А) позволяет предполагать, что салициловая и ян-
тарная кислоты могут связываться с активным центром ка-
талазы, выступая в роли конкурентных ингибиторов в реак-
ции разложения перекиси водорода.
Вполне вероятно, что экзогенная янтарная кислота, по-
добно салициловой, может приводить и к другим эффектам:
активации супероксиддисмутазы [Rao et al., 1997; Minibayeva
et al.,
2001] (а это приводит к повышению концентрации пе-
рекиси водорода), ингибированию аконитаз, пероксидаз и
оксидаз [Ruffer et al., 1995].
Не исключено, что освобождаемые из одних клеток са-
лициловая и янтарная кислоты могут в качестве первич-
ных сигналов взаимодействовать с одним и тем же рецеп-
торным белком плазмалеммы других клеток, изменяя его
конформацию и "включая" метаболические цепи преобра-
зования и умножения сигнального импульса, завершающи-
еся экспрессией генов и синтезом защитных белков и фи-
тоалексинов.
В нашей лаборатории при исследовании влияния экзо-
генной салициловой кислоты на полипептидный спектр и
(качественно, по почернению рентгеновской пленки) на
включение
|4
С-аминокислот в отдельные полипептиды ока-
залось, что салициловая кислота очень сильно повышала
содержание полипептида 29 кДа из группы кислых белков,
а также увеличивала набор щелочных белков, среди кото-
рых появлялись новые полипептиды 11, 38, 42 и 72 кДа
[Тарчевский и др., 1999].
Полипептиды 72 и 11 кДа можно отнести к белкам с вы-
сокой скоростью оборота (turnover), отличающимся интен-
сивным образованием (что определяет их высокую радио-
активность) и быстрым распадом (это приводит к столь низ-
кому содержанию этих полипептидов, что они не проявля-
ются на гелях). Обычно такие соединения играют в обмене
веществ роль оперативных регуляторов, достаточно чутко
реагирующих на изменение внутриклеточной или внешней
ситуации.
Обращает на себя внимание, что салицилатиндуциро-
ванный кислый белок 29 кДа имел очень высокую радиоак-
тивность, наивысшую среди всех рассматриваемых поли-
пептидов. В то же время в полипептидах 38 и 42 кДа не об-
наруживалось высокой радиоактивности. Не исключено,
что в двух последних случаях салициловая кислота не столь-
ко усиливала синтез этих полипептидов, сколько подавляла
интенсивность их деградации. Быть может, установленный
ранее факт стимулирования салицилатом образования ин-
гибиторов протеиназ [Jung et al., 1993] белковой природы
свидетельствует о возможности действия некоторых из
этих ингибиторов не только на протеиназы патогена, но и
на некоторые протеиназы растения-хозяина.
Нами не установлено случаев полной репрессии салици-
латом образования полипептидов, наблюдалось лишь силь-
ное снижение содержания полипептида 27 кДа.
Электрофоретическое разделение белков показало, что
салициловая и янтарная кислоты вызвали сходное измене-
ние набора полипептидов. Эти данные позволяют заклю-
чить, что экзогенные салицилат и сукцинат включают одни
и те же механизмы экспрессии генов. Особенности измене-
ния синтеза различных белков под влиянием экзогенного
салицилата изучались многими авторами [Antoniw, White,
1980; Van Loon, Antoniw, 1982; Pennazio et al.,
1983; и др.].
В одной из таких работ [Jung et al., 1993] было обнаружено
индуцирование ацетилсалициловой кислотой в растениях
подсолнечника синтеза полипептидов 17 кДа (из группы
PR
1 белков), 40 кДа (из группы PR 2 белков), 29 и 37 кДа
(из группы PR 3 белков) и 20 кДа (из группы PR 5 белков),
причем все они экскретировались в межклеточное прост-
ранство. Для белков группы PR 2 характерна (3-глюканазная
активность, для группы PR 3 - хитиназная, к белкам груп-
пы PR 5 относят ингибиторы протеиназ. По всей вероятности,
найденные нами в растениях гороха салицилатиндуцирован-
ные белки 29 и 38 кДа аналогичны белкам группы PR 3 под-
солнечника с близкими молекулярными массами.
Проведенные исследования позволяют считать, что ян-
тарная кислота является природным миметиком салицило-
вой кислоты, приводя в действие те же механизмы индук-
ции локальной и системной устойчивости растений к пато-
генам. Вероятно, этим и объясняется положительное воз-
действие обработок препаратами янтарной кислоты на ус-
тойчивость и продуктивность сельскохозяйственных расте-
ний [Тарчевский, 1997].
Как и ожидалось, сходным с салицилатом действием об-
ладает не только янтарная кислота, но и другие ди- и три-
карбоксиловые органические кислоты цикла Кребса со
сходным с салицилатом расположением гидроксильных
групп. Было показано, что салициловая, янтарная, яблоч-
ная, фумаровая и лимонная кислоты активируют внекле-
точную пероксидазу, что приводит к значительной интенси-
фикации образования супероксида [Minibayeva et al., 2001].
Можно предположить, что освобождение янтарной кисло-
ты и других ди- и трикарбоксиловых органических кислот
во внеклеточное пространство происходит при механиче-
ском повреждении клеток или начинающемся апоптозе. По
всей вероятности, эти соединения являются одними из тех
молекулярных "сигналов бедствия", которые включают за-
щитные механизмы в соседних клетках [Тарчевский, 1993].
Роль перекиси водорода и салицилата в растениях не ог-
раничивается их участием в функционировании НАДФН-
оксидазной системе клетки, подвергшейся действию элиси-
торов. Оказалось, что они активируют программируемую
смерть клеток (апоптоз), подавляют развитие патогенов.
Кроме того, салициловая кислота может быть одним из фак-
торов индукции системного иммунитета в частях растений,
удаленных от места инфицирования патогенами. Это объ-
ясняется ее способностью транспортироваться по флоэме
[Shulaev et al.,
1995] и служить элиситором, включающим
сигнальные системы клеток. Некоторые исследователи ос-
паривали роль салицилата в качестве индуктора системного
иммунитета, но опыты с использованием трансгенных рас-
тений [Gaffney et al., 1993; Delaney et al., 1994] с привнесен-
ным геном бактериальной салицилатгидроксилазы (не спо-
собных накапливать салициловую кислоту после инфици-
рования патогенами и осуществлять с ее помощью систем-
ный иммунитет) устранили эти возражения.
Салициловая кислота может метилироваться, а летучий
метилсалицилат - принимать участие в аллелопатических
взаимоотношениях в фитоценозах, наряду с летучими про-
изводными липоксигеназного метаболизма (гексеналями,
гексенолами, ноненалями, ноненолами, метилжасмонатом)
и летучими терпеноидными фитоалексинами.
Ознакомление с многочисленными публикациями поз-
воляет сделать вывод, что окислительный взрыв может иг-
рать одну из главных ролей в появлении разнообразных за-
щитных ответов [Grant, Loake, 2000] и что многие вопросы
функционирования НАДФН-оксидазной сигнальной систе-
мы остаются еще неизученными.