ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.11.2019
Просмотров: 4040
Скачиваний: 98
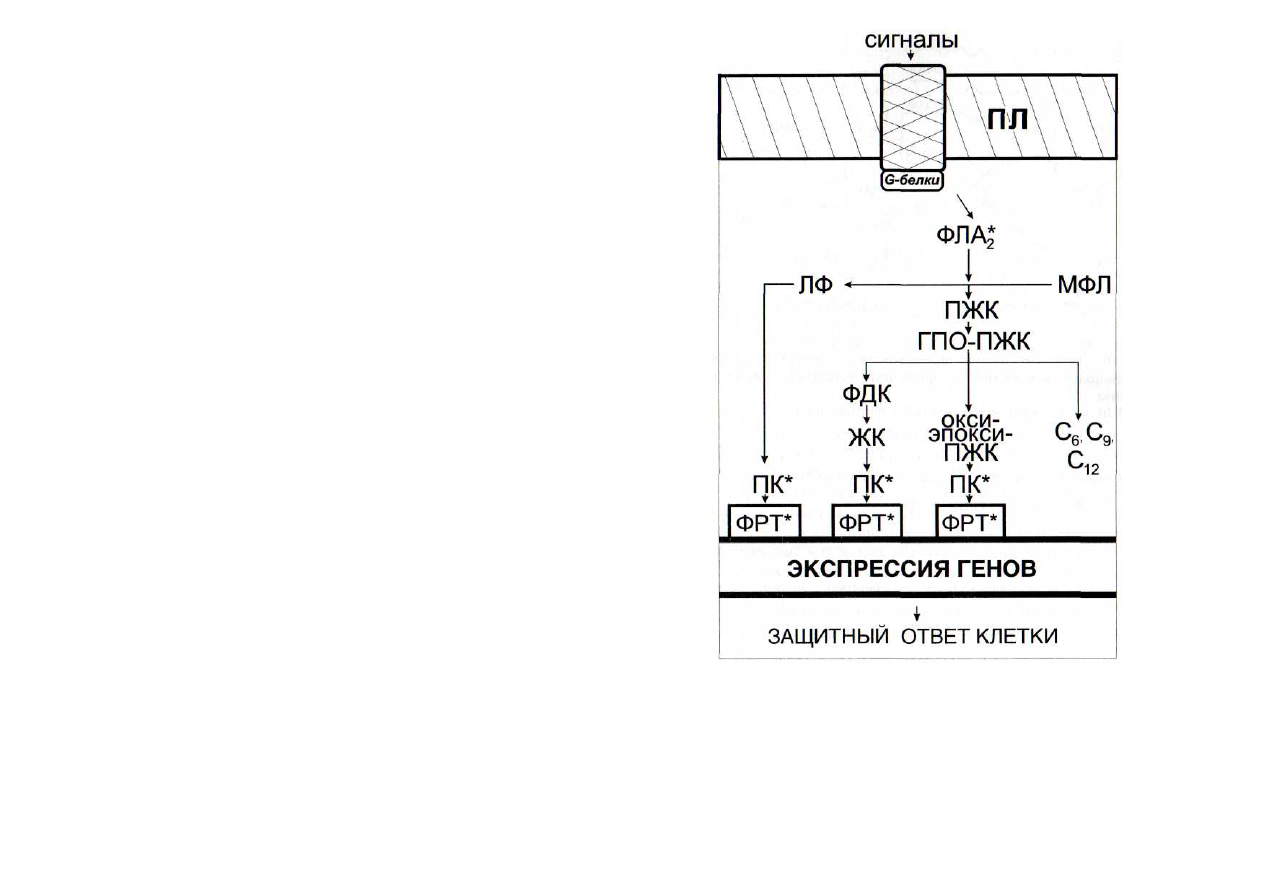
ЛИПОКСИГЕНАЗНАЯ СИГНАЛЬНАЯ СИСТЕМА
Известно, что многие мембранные липиды (в особенно-
сти фосфолипиды) могут освобождать входящие в их состав
жирные кислоты в ходе реакций, катализируемых липаза-
ми, например фосфолипазами А
2
. Фосфолипазы А
2
активи-
руются патогенами, стрессовыми фитогормонами, элисито-
рами, абиогенными стрессорами [Mueller et al., 1993;
Creelman, Mullet, 1995; Conconi et al.,
1996; Гречкин, Тарчев-
ский, 1999]. Освободившиеся из сложных липидов линоле-
вая и особенно линоленовая кислоты являются субстратами
липоксигеназной сигнальной системы (рис. 15). Ее название
обязано ферментам, катализирующим присоединение мо-
лекулярного кислорода к одному из атомов углерода
цис,
цис-пентадиенового радикала жирных кислот в клетках ми-
кроорганизмов, растений и животных. В результате проис-
ходит образование гидропероксидного производного, у ко-
торого наблюдается изменение г<мс-конфигурации двойной
связи в транс-конфигурацию. Большинство растительных
липоксигеназ отличается высокой специфичностью, окис-
ляя линолеат и линоленат по положению С-9 или С-13 (9- и
13-
липоксигеназы). Наиболее отзывчиво изменение экс-
прессии и активности 13-липоксигеназ [Eiben, Slusarenko,
1994; Royo et al.,
1996]. Субстратами липоксигеназ могут
быть не только свободные ненасыщенные жирные кисло-
ты, но и находящиеся в составе запасных триацилглицери-
нов [Feussner et al., 1997а] и фосфолипидов [Brash et al., 1987]
(рис. 16).
Гидроперекиси жирных кислот в ходе пероксигеназной
реакции с ненасыщенными кислотами превращаются в эпо-
ксидные формы и гидроксипроизводные (рис. 17) [Vick,
Zimmerman,
1987; В1ее,1996]. Это путь синтеза мономерных
субстратов гетерополимера кутина [В lee, 1995] - основного
Рис. 15. Схема функционирования липоксигеназной сигнальной
системы
ГПО-ПЖК - гидропероксиформы полиеновых жирных кислот;
ЖК — жасмоновая кислота; ЛФ — лизофосфатиды; МФЛ — мембранные
фосфолипиды; ПЖК - полиеновые жирные кислоты; окси-эпокси-
ПЖК - гидроксилированные и эпоксидированные формы ПЖК; ПК
-
протеинкиназы; ФДК - фитодиеновая кислота; ФЛА
2
-
фосфолипаза А
7
;
С
6
, С
9
, С
12
-
шести-, девяти- и двенадцатиуглеродные продукты лиазных
реакций превращения ГПО-ПЖК. Остальные обозначения - см. рис. 6
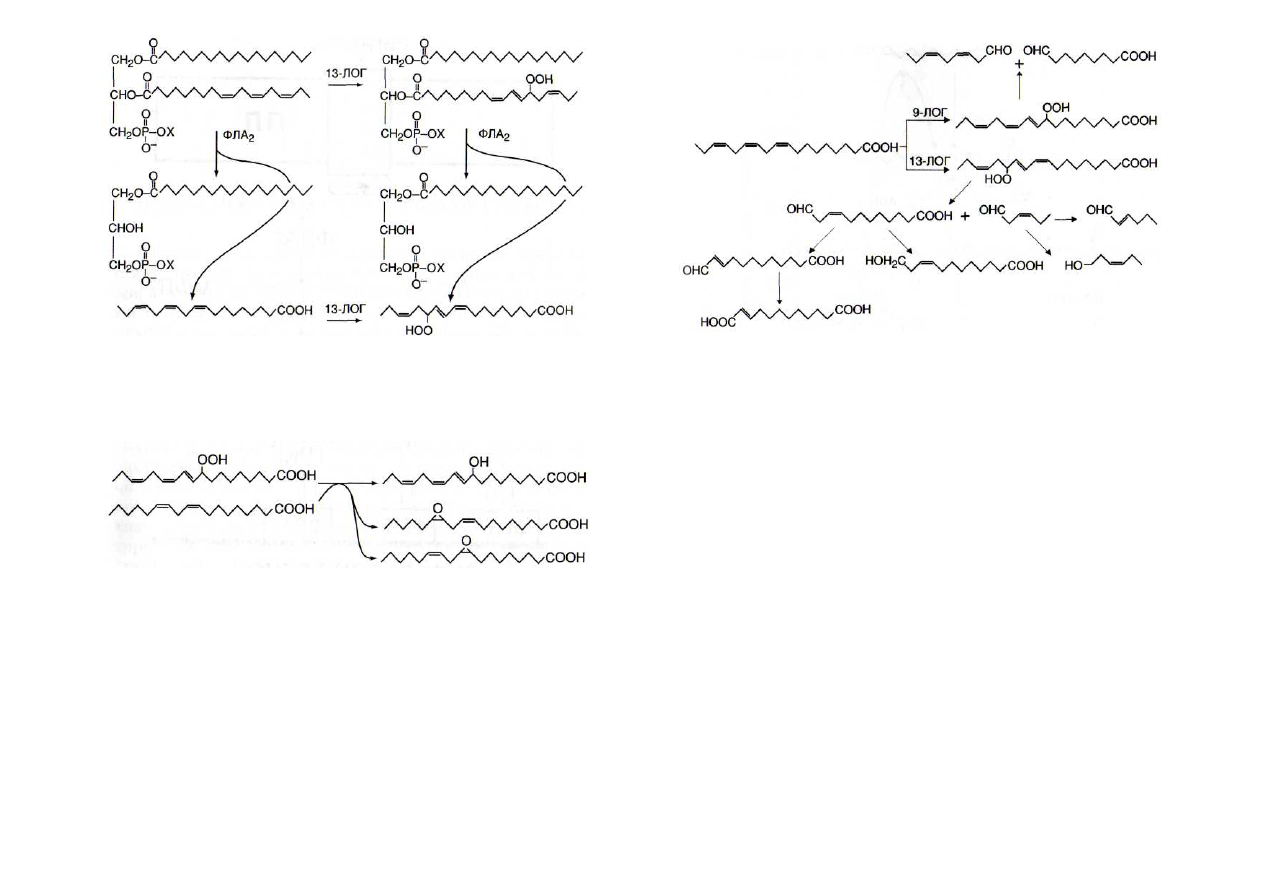
Рис. 16. Липоксигеназное превращение свободной (слева) и
находящейся в составе фосфолипида (справа) линоленовой
кислоты
13-
ЛОГ - 13-липоксигеназа; ФЛА
2
-
фосфолипаза А
2
Рис. 18. Гидропероксидлиазные реакции липоксигеназного мета-
болизма
9-
ЛОГ и 13-ЛОГ - соответственно 9- и 13-липоксигеназы
Рис. 17. Пероксигеназные реакции превращения гидроперокси-
линолената
компонента кутикулы, являющейся защитным покровом
надземных органов растений.
Важную роль в липоксигеназном метаболизме играют
гидропероксидлиазы высших растений, катализирующие
превращение 9-гидропероксилинолеата или 9-гидроперок-
силинолената в С
9
-
альдегиды и С
9
-
альдокислоты (рис. 18), а
также 13-гидропероксилинолеата или 13-гидропероксили-
нолената в С
6
-
альдегиды и С
12
-
альдокислоты [Gardner,
1991]. С
6
-
и С
12
-
соединения могут играть важную роль в за-
щите растений от патогенов и адаптации к абиогенным
стрессорам. К числу физиологически активных раститель-
ных оксилипинов относятся 2(2)-додецен-1,12-дикарбокси-
ловая (травматиновая) кислота и 12-оксо-10(Е)-додецено-
вая кислота (травматин), идентифицированные ранее как
раневые гормоны [Zimmerman, Coudron, 1979]. Они способ-
ны индуцировать деление клеток и образование каллуса в
местах повреждения растения. Еще одно близкое по струк-
туре соединение - 12-гидрокси-9(2)-додеценовая кислота,
было идентифицировано в экспериментах in vitro с пророст-
ками гороха [Гречкин и др., 1987]. Она является активным
стимулятором роста, вызывая прирост биомассы каллуса
сои до 400% по сравнению с контролем. Продуктами актив-
ности 13-гидропероксидлиазы также являются С
6
-
альдеги-
ды. Эти соединения, придающие специфический запах
свежескошенной траве - 3(2)-гексеналь, 2(Е)- и 3(Е)-гексе-
нали, образуются уже через 15 с после механического
повреждения листьев [Hildebrand et al., 1990], а так же как
продукты их восстановления - гексенолы (см. рис. 18). Под
влиянием 9-гидропероксидлиазы из линолевой кислоты появ-
ляется еще одна группа летучих 9-углеродных соединений
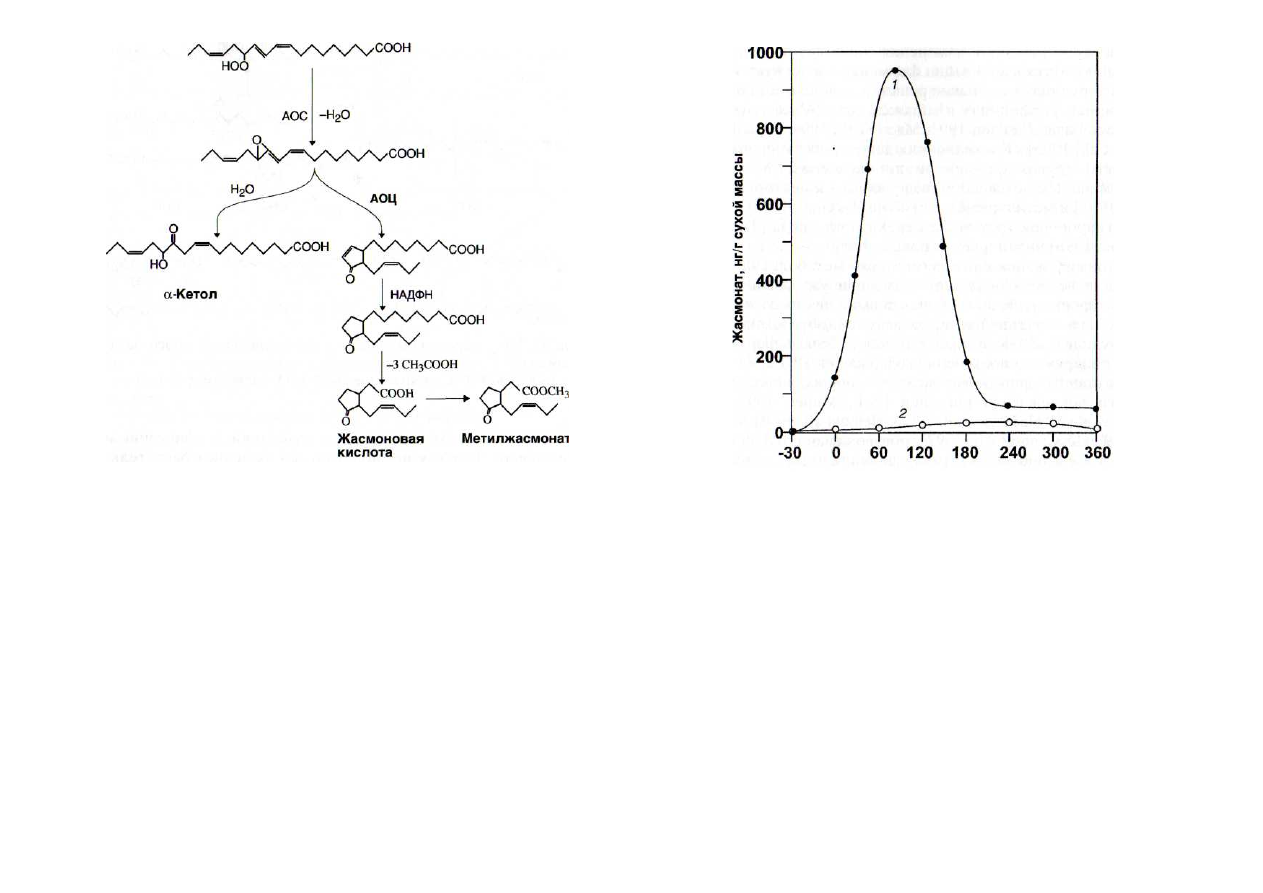
Рис. 19. Реакция образования кетола и жасмоната из гидропер-
оксилинолената
АОС - алленоксидсинтаза; АОЦ - алленоксидциклаза
(обусловливающих запах разрезанного огурца) - 2(Е)-ноне-
наль и 3(2)-ноненаль. Линоленовая кислота образует
3(Z), 6(2)-
нонадиеналь и 2(Е), 6(2)-нонадиеналь.
Обнаружено превращение летучих альдегидов в нелету-
чие: 4-гидрокси-2-гексеналь и 4-гидрокси-2-ноненаль, обла-
дающие свойствами физиологически активных соединений
[Gardner, Hamberg, 1993; Takamura, Gardner, 1996].
Алленоксидсинтаза катализирует образование кетолов
[Grechkin et al., 1991a],
способных затормаживать развитие
патогенов (рис. 19).
13-
Гидропероксилиноленат в ходе нескольких реакций
может претерпевать циклизацию с образованием 12-оксо-
10,15(7)-
фитодиеновой кислоты. В результате восстановле-
ния двойной связи в цикле и ^-окисления она превращается
Время воздействия элиситора, мин
Рис. 20. Элиситориндуцированное образование жасмоната
[Mueller et al., 1993]
1 -
элиситор (гидролизат клеточных стенок дрожжей);
2
-
контроль
в жасмоновую кислоту, причисляемую к стрессовым фито-
гормонам (см. рис. 19).
Изменение содержания жасмоната под влиянием элиси-
торов имеет одновершинный характер (рис. 20).
Сравнительно недавно были выявлены необычные ок-
силипины, содержащие простую эфирную связь в своих уг-
леводородных цепях, - дивиниловые эфиры: колнелевая и
колнеленовая [Galliard, Chan, 1980], а также этеролевая и
этероленовая кислоты [Grechkin et al., 1995; Grechkin,
Hamberg, 1996; Grechkin et al., 1997].
Абиотические и биотические стрессоры вызывают
сильную активацию липоксигеназного пути. Причина по-
вышения содержания и изменения соотношения оксилипи-
нов заключается в активации ферментов, в первую очередь
катализирующих начальные реакции липоксигеназного ме-
таболизма: фосфолипаз и липоксигеназ [Maccarone et al.,
1992; Sembdner, Parthier, 1993; Macri et al., 1994; Rosahl, 1996;
Royo et al.,
1996]. К сожалению, данных об изменениях ак-
тивности других ферментов липоксигеназной системы
очень мало. Имеются лишь сведения, что элиситоры [Kondo
et al.,
1995] и метилжасмонат [Adviushko et al., 1995] активи-
руют гидропероксидлиазу, а перекись водорода [Takamura,
Gardner,
1996] ингибирует пероксигеназу.
Интенсификация липоксигеназного метаболизма осуще-
ствляется не только за счет активации уже имеющихся в
клетках ферментов, но и за счет повышения их содержания,
вызванного индукцией экспрессии генов (образования соот-
ветствующих мРНК и с их помощью белков-ферментов).
Было обнаружено повышение содержания мРНК, кодирую-
щих различные формы липоксигеназ, под влиянием механи-
ческого повреждения растений [Bell, Mullet, 1991; 1993;
Geerts et al., 1994; Royo et al., 1996; Heitz et al., 1997; Mauch et
al., 1997; McConn et al.,
1997], обезвоживания [Bell, Mullet,
1991; Maccarrone et al.,
1995], повышенных температур
[Maccarrone et al.,
1992], патогенов [Melan et al., 1993; Peng et
al., 1994; Veronesi et al., 1996; Schweizer et al.,
1997], абсцизо-
вой кислоты [Maccarrone et al., 1995], жасмоновой кислоты
[Veronesi et al., 1996; Schweizer et al.,
1997], метилжасмоната
[Bell, Mullet, 1991; 1993; Melan et al.,
1993], гибберелловой ки-
слоты [Veronesi et al., 1996], ограничения потребления асси-
милятов репродуктивными органами [Jensen et al., 1997] и т.д.
При этом тот или иной стрессор или сигнал может вызывать
неодинаковую интенсивнось и временной ход накопления
транскриптов различных форм липоксигеназ [Eiben,
Slusarenko, 1994; Royo et al., 1996; Saravitz, Siedow, 1996].
Активация процессов транскрипции генов, кодирующих
липоксигеназы, приводит к повышению интенсивности ок-
сигенирования свободных и эстерифицированных (находя-
щихся в составе галактолипидов и фосфолипидов) ненасы-
щенных жирных кислот, а также дальнейших превращений
их оксигенированных форм.
Многие исследователи нашли, что гидроперокси- и гид-
роксипроизводные линолевой и линоленовой кислот, обра-
зующиеся в инфицированных растениях, обладают антими-
кробным действием [Kato et al., 1992; Namai et al., 1993]. Сре-
ди них самая высокая фунгицидная активность у гидропер-
окси- и гидроксикислот [Kato et al., 1983; 1986]. Антимикроб-
ные свойства обнаружены также у эпокси- и эпоксигидрок-
сипроизводных линолевой и линоленовой кислот [Kato et al.,
1986; и др.]. Гексенали и гексенолы являются одними из
наиболее важных антимикробных [Croft et al., 1993; Deng et
al.,
1993] и антигрибных [Hamilton-Kemp et al., 1992; Vaughn,
Gardner,
1993] агентов, обеспечивающих первичную хими-
ческую защиту раневой поверхности растения от атаки па-
тогенов [Croft et al., 1993]. Примечательно, что
транс-2-гек-
сеналь обладает большей бактерицидной активностью, чем
цмс-3-гексеналь. Нонадиенали также обладают бактери-
цидными и фунгицидными свойствами [Hamilton-Kemp et al.,
1992; Vaughn, Gardner,
1993]. Фунгицидную активность про-
являет 13-оксо-тридека-9,11 -диеновая кислота, образующа-
яся в растениях под влиянием элиситоров [Kondo et al.,
1995].
Оксилипины участвуют в механизмах защиты не только
против инфекции, но и листогрызущих насекомых [Doss et
al., 1989; Farmer, Ryan, 1990; Howe et al.,
1996]. Имеются све-
дения о том, что у некоторых видов растений сигналом, вы-
зывающим защитную реакцию в ответ на атаку насекомых,
является жасмонат [Farmer, Ryan, 1990; Howe et al., 1996]. В
растениях люцерны был обнаружен макролактон [Doss et
al.,
1989] упоминавшейся ранее 12-гидрокси-9^)-додецено-
вой кислоты, определяющий устойчивость люцерны по от-
ношению к насекомому-вредителю Medicago rugosa Desr.
Важен вопрос о внутриклеточной локализации различ-
ных реакций липоксигеназного метаболизма. В большинст-
ве клеток растений эта сигнальная цепь начинается в плаз-
малемме и продолжается в цитоплазме. Однако в клетках,
содержащих хлоропласты, ситуация сильно осложняется.
Дело в том, что хлоропласты являются основным вместили-
щем полиеновых жирных кислот (входящих главным обра-
зом в состав галактолипидов), которые освобождаются при
повышении активности липазных реакций, вызванном, на-
пример, атакой патогенов [Marechal et al.,1997]. В хлоропла-
стах имеется набор ферментов, участвующих в образовании
интермедиатов липоксигеназной сигнальной системы: деса-
туразы жирных кислот [Nishiuchi et al.,1997], липоксигена-
зы, алленоксидсинтазы [Song et al., 1993; Laudert et al., 1996;
Maucher et al., 2000; Froehlich et al.,
2001], алленоксидцикла-
зы [Ziegler et al., 2000], лиазы гидропероксипроизводных по-
лиеновых жирных кислот fBlee, Joyard, 1996; Zhuang et al.,
1996; Froehlich et al.,
2001]. Все перечисленные ферменты
имеют ядерное происхождение, и при транспорте в хлоро-
пласты от первых трех отщепляется сравнительно неболь-
шой "транзитный" полипептид [Ziegler et al., 2000; Froehlich
et al., 2001
]. Четвертые не имеют транзитного фрагмента и
поэтому не могут проходить внутрь хлоропласта через
внешнюю мембрану оболочки [Froehlich et al., 2001]. Место
локализации первых двух - мембраны тилакоидов, треть-
их - внутренняя мембрана оболочки хлоропластов, четвер-
тых - цитоплазматическая поверхность внешней мембраны
оболочки. Давно установлено, что индукция синтеза неко-
торых ферментов липоксигеназного метаболизма биотиче-
скими и абиотическими стрессорами в большей степени ха-
рактерна для хлоропластных изоформ (например, липокси-
геназ [Bell, Mullet, 1993; Maccarrone et al., 1994; Bell et al.,
1995; Heitz et al., 1997; Voros et al.,
1998]). Все это позволяет
считать, что хлоропласты могут вносить существенный
вклад в функционирование липоксигеназной сигнальной си-
стемы и в формирование адаптационного синдрома в фото-
синтезирующих клетках. Имеются основания полагать, что
алленоксидциклазное и гидропероксидлиазное направления
липоксигеназного метаболизма обеспечиваются в хлоро-
филлсодержащих клетках главным образом хлоропласта-
ми. До сих пор не решено, каким образом "включается" ли-
поксигеназный метаболизм хлоропластов, особенно в тех
случаях, когда рецептор внешнего химического сигнала ло-
кализован в плазмалемме. Неясно, какова природа сигна-
лов, участвующих в быстрой передаче информационного
импульса от плазмалеммы к хлоропластам. Относительно
недавно обнаружено, что при действии патогенов, элисито-
ров и механического повреждения тканей листьев происхо-
дит быстрое освобождение фосфатидной кислоты вследст-
вие активации фосфолипазы Д (см. раздел Фосфотидатная
сигнальная система) и только после этого - появление лизо-
фосфатидов благодаря активации фосфолипазы А
2
. Инте-
ресно, что ингибирование фосфолипазы Д приводило к тор-
можению индукции синтеза хлоропластной липоксигеназы
(ЛОГ2), алленоксидсинтазы и интенсивности образования
жасмоната [Wang, 2000]. Эти данные позволяют выстроить
следующую вероятную сигнальную цепь: элиситор —> ре-
цептор плазмалеммы —> активация ассоциированной с плаз-
малеммой фосфолипазы Д —> фосфатидная кислота —>
транспорт фосфатидата в хлоропласты —> активация хлоро-
пластных фосфолипазы А
2
и ацилгидролаз —> освобожде-
ние линоленовой и линолевой кислот —> липоксигеназный
метаболизм. Передача информации по этому сигнальному
пути должна осуществляться достаточно быстро, так как
появление значительных количеств гексеналей регистриру-
ется через десятки секунд после механического воздействия
на листья (запах свежескошенной травы).
Не исключено, что в сигнальную цепь между плазма-
леммой и хлоропластами входит повышение концентрации
ионов кальция в цитозоле (кальциевая волна от плазмалем-
мы к хлоропластам), но этот механизм вызывает опреде-
ленные сомнения, если принять во внимание относитель-
ную автономность ионного режима хлоропластов. С другой
стороны, наличие в оболочке хлоропластов кальциевых
каналов и помп заставляет с вниманием отнестись к этой ги-
потезе. Поддерживают необходимость поисков в этом на-
правлении результаты специальных опытов по изучению
возможности передачи воспринимаемого плазмалеммой
сигнала в другие клеточные органеллы - митохондрии.
Оказалось, что сигналиндуцированное преходящее повы-
шение содержания ионов кальция в цитозоле приводит к
быстрому и также временному возрастанию их концентра-
ции в митохондриях [Rizzuto et al., 1992].
Нельзя исключить не опосредованного плазмалеммой
включения липоксигеназного метаболизма в хлоропластах.
Известно, что различные стрессоры вызывают нарушения
В функционировании системы фотосинтетического элек-
тронного транспорта и это приводит к существенным нару-
шениям структуры тилакоидных мембран, проявляющимся
В распаде белка Д1 фотосистемы II. Возможно, что конфор-
мационные изменения мемран тилакоидов при фотострессе
и являются первичным сигналом, способным активировать
гидролазы и, вследствие этого, освобождать полиеновые
жирные кислоты из галактолипидов и фосфолипидов и