ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.11.2019
Просмотров: 4044
Скачиваний: 98
вызывал снижение рН в цитозоле и повышение рН в сус-
пензионной среде даже в отсутствие элиситора. Это свиде-
тельствует об участии процессов фосфорилирования-де-
фосфорилирования в элиситации изменений рН и заставляет
с большим вниманием отнестись к представлениям о сиг-
нальной роли трансмембранного изменения концентрации
протонов [Скулачев, 1989; Polevoi et al., 1996], тем более что
оно приводило к синтезу классических патогениндуцируе-
мых белков. Примером может служить искусственное под-
кисление цитозоля, которое вызывало образование фенил-
ал анин-аммиак-лиазы [Mathieu et al., 1994]. Продолжают
оставаться невыясненными интермедиаты протонной сиг-
нальной системы. Обнаружение протонозависимой актива-
ции некоторых изоформ МАР-киназ [Тепа, Renaudin, 1998]
позволяет выстроить ранее скрытую последовательность
звеньев протонной сигнальной системы: сигнал —> рецептор —>
—>
активация протонных каналов —> подкисление цитозоля —>
—
> активация МАР-киназ —> активация факторов регуляции
транскрипции —> изменение программы экспрессии генов.
Обнаружены также активные при пониженных значени-
ях рН изоформы фосфолипазы Д [Munnik et al., 1995] и аде-
нилатциклазы [Carricarte et al., 1988], что может рассматри-
ваться в качестве аргумента в пользу существования протон-
ной системы. С другой стороны, эти эффекты можно расце-
нивать лишь как рычаг дополнительной активации подкис-
лением цитозоля элиситориндуцируемых фосфатидатной,
МАР-киназной и аденилатциклазной сигнальных систем.
Имеются также данные о том, что ингибиторы МАР-киназ
приводят к подавлению подщелачивания внеклеточной сре-
ды, вызванного действием элиситоров [Zhang et al., 1998]. В
этом случае не протонный импульс находится "выше по те-
чению" сигнальной системы, а МАР-киназное звено.
Важным представляется решение вопроса о том, из ка-
кого источника протоны поступают в цитозоль. С одной
стороны, имеются данные, что взаимодействие элиситоров
с липидной фазой плазмалеммы может приводить к неспе-
цифическому входу протонов снаружи внутрь клетки и к
подкислению цитозоля [Klusener, Weiler, 1999]. С другой
стороны, показано, что после контакта клеток с элисито-
ром подкисление цитозоля и ядерной области происходит в
первую очередь за счет подщелачивания вакуоли [Roos et
al.,
1998]. "Протонная вспышка" начиналась практически
без лаг-фазы и продолжалась в течение десятков минут. Ис-
тощение вакуолярного протонного пула предотвращало
как элиситорное подкисление цитозоля, так и синтез фито-
алексинов. Подщелачивание внеклеточной среды обнару-
живалось только при более высоких концентрациях элиси-
тора. По мнению авторов, подкисление цитозоля за счет
выхода протонов из вакуоли - необходимый и достаточный
шаг в сигнальной системе синтеза фитоалексинов. Насыща-
ло образование фитоалексинов в суспензионных клетках
мака изменение концентрации протонов, соответствующее
0,6 единицы рН.
Протонные каналы и Н
+
-
АТФазы не были обнаружены в
мембранах ядерной оболочки [Matzke et al., 2001], в отличие
от кальциевых каналов и помп, что свидетельствует о прин-
ципиальных различиях в механизмах регуляции концентра-
ции этих ионов в ядрах клеток, по сравнению с вакуолями.
Преходящий характер протонной вспышки объясняется
усиливающимся при подкислении цитозоля (рис. 34) функ-
ционированием протонных помп (Н
+
-
АТФаз) плазмалеммы
|Palmgren,
1991] и тонопласта. Можно отметить, что АТФа-
за была первым клонированным мембранным белком рас-
тений. В настоящее время уже многие растительные АТФа-
зы клонированы (например, у арабидопсиса - более 40) и
подразделяются на пять типов [Palmgren, Harper; 1999;
Palmgren,
2001]. Структура Н
+
-
АТФаз проще, чем у других
ионных помп, и в большинстве случаев содержит только одну
каталитическую субъединицу. Трансмембранный домен
представлен десятью спиралями, причем и N- и С-концы по-
липептида обращены в цитозоль. АТФазы имеют регуля-
торные домены (в том числе автоингибиторные) на С-кон-
це молекулы и, по-видимому, места связывания с регуля-
торными белками, в первую очередь с белком 14-3-3 (акти-
вирующим разнообразные ферменты). Предполагается,
что важную роль в активации Н
+
-
АТФаз играет их фосфо-
рилирование протеинкиназами, но, с другой стороны, обна-
ружена и их активация при дефосфорилировании.
Интересно, что работа Н
+
-
АТФаз плазмалеммы стимули-
ровалась Са
2+
-
активируемыми протеинкиназами [Schaller,
Oecking,
1999]. Если иметь в виду, что обычно под влиянием
элиситоров происходит одновременное повышение содержа-
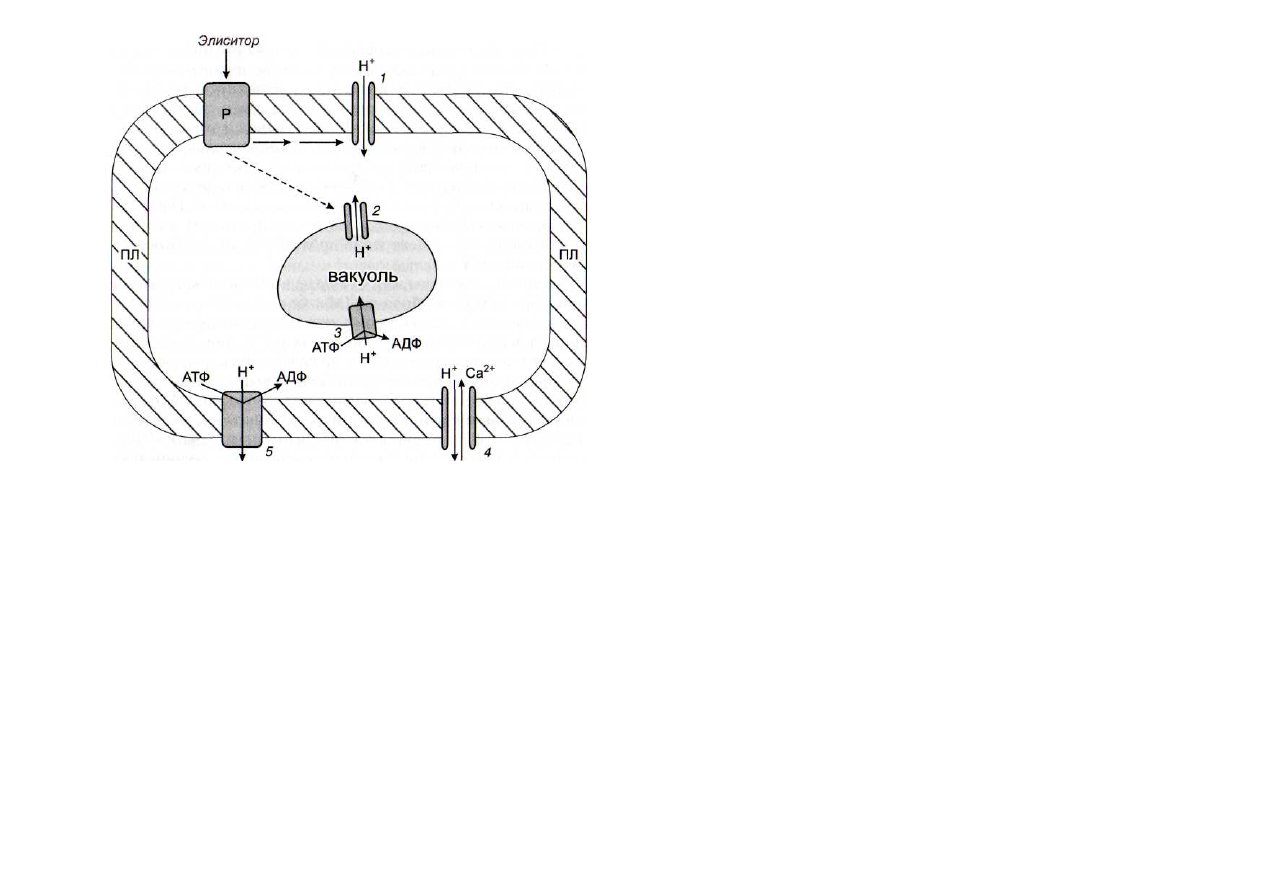
Рис. 34. Схема участия протонных каналов и помп в преходящем
подкислении цитозоля
1
и 2 - Н
+
-
каналы;
3
и 5 - протонные помпы;
4
-
Н
+
/Са
2+
-
антипор-
тер; ПЛ - плазмалемма; Р - рецептор
ния протонов и ионов кальция в цитоплазме, то опосредован-
ная стимуляция последними Н
+
-
АТФаз может играть роль
дополнительного рычага снижения содержания протонов.
Основное назначение Н
+
-
АТФаз - перенос протонов
против градиента концентрации, создание трансмембранно-
го протонного градиента и, в связи с этим, электрогенного
мембранного потенциала (положительного снаружи и отри-
цательного с внутренней стороны плазмалеммы).
Итак, можно сделать вывод, что за элиситориндуцирован-
ной активацией протонных каналов следует интенсификация
функционирования протонных помп. Необходимо, однако, за-
метить, что имеются также данные об элиситориндуцируемом
подавлении Н
+
-
АТФаз как причине подкисления цитозоля.
МЕХАНИЗМЫ ПАТОГЕНИНДУЦИРУЕМОЙ
СМЕРТИ КЛЕТОК
Одним из распространенных результатов взаимодейст-
вия патогенов и растений являются локальные разрушения
клеток в инфицированных участках тканей хозяина. Види-
мая картина этого - появление темных, бурых, иногда свет-
лых пятен в местах проникновения в ткань патогенов.
Существуют два типа смерти клеток, вызываемые раз-
личными непосредственными причинами и осуществляю-
щиеся по различным сценариям. Первый и наиболее прос-
той - это некроз клеток, который происходит благодаря на-
рушению целостности плазмалеммы и других мембран кле-
ток, что приводит к невосстанавливаемым нарушениям
трансмембранных ионных градиентов плазмалеммы, осво-
бождению лизосомальных ферментов, вызывающих дегра-
дацию белков, нуклеиновых кислот и липидов. Наблюдает-
ся также снижение интенсивности синтеза АТФ в хлороплас-
тах и митохондриях.
Одними из главных ультраструктурных проявлений нек-
роза являются набухание клеток, лизис их составляющих,
разрушение плазмалеммы и вытекание содержимого кле-
ток [Cohen, 1993]. Этот процесс не регулируется генетиче-
ским аппаратом.
Второй тип гибели клеток - это генетически программи-
руемая смерть (апоптоз), вызванная действием элиситоров и
опосредованная сигнальными системами [Dangl et al., 1996;
Greenberg, 1997; Hammond-Kosack, Jones, 1997; Mittler et al.,
1997; Pennell, Lamb, 1997; Green, 1998; Lam et al.,
1999; Самуи-
лов и др., 2000; Shirasu, Schulze-Lefert, 2000]. Кстати, апоптоз
может быть вызван тем же агентом, что и некроз, например
перекисью водорода, но в последнем случае требуется гораз-
до большая концентрация агента. О начале процесса можно
судить по изменению ультраструктуры: вакуолизации
[Shirasu, Schulze-Lefert,
2000] и съеживанию цитоплазмы,
вздутиям ядерной оболочки, фрагментации ядер, конденса-
ции хроматина [Aoyagi et al.,1998; Gao, Showalter, 1999], уп-
лотнению матрикса митохондрий и т.д. Необходимо отме-
тить, что плазмалемма сохраняет свою целостность. Апопто-
зу подвергаются клетки, окружающие инфицированный учас-
ток, причем наибольшей восприимчивостью отличаются
клетки, примыкающие к проводящим пучкам листьев. Апоп-
тоз и, вследствие этого, высыхание клеток создают механи-
ческий барьер для распространения инфекции по растению,
в том числе системно по проводящим путям.
Принципиально важен вопрос о том, участвуют в про-
цессе апоптоза белки, уже имевшиеся в клетках до воспри-
ятия ими элиситора - сигнала смерти, или этот сигнал вы-
зывает экспрессию генов апоптоза с помощью сигнальных
систем, и уже затем образовавшиеся протеазы, нуклеазы и
другие ферменты апоптоза приводят к смерти клетки.
Вторая возможность подтверждается тем, что процесс
апоптоза подавляется при действии на клетки ингибиторов
синтеза белков, например циклогексимидом. Известны ге-
ны, экспрессия которых приводит к апоптозу клеток у жи-
вотных и растений; он не происходит, если синтез белков
подавлен с помощью ингибиторов [Greenberg, 1996; Mittler et
al., 1997].
В исследовании процесса апоптоза все большую роль иг-
рают параноидные мутанты растений, образующие некро-
тические пятна самопроизвольно, без действия патогенов, и
трансгенные растения с привнесенными генами апоптоза
или генами ферментов, влияющих на содержание небелко-
вых соединений, принимающих участие в процессе апопто-
за, например интермедиатов сигнальных систем, таких как
салициловая кислота.
Культура клеток - хорошая модель для изучения
апоптоза [McCabe, Leaver, 2000], так же как трансгенные
растения со спонтанным образованием апоптозных пятен
без действия патогенов [Mittler, Rizhsky, 2000].
Исследования апоптоза вышли на новый, более высокий
уровень после установления основополагающих фактов ге-
нетического контроля за протеканием апоптоза у нематоды
Caenorhabditis elegans.
Оказалось, что этот контроль осуще-
ствляется тремя основными генами: ced-3, ced-4 и ced-9 (аб-
бревиатура от С. elegans death). Первый кодирует каспазы,
третий - белок-ингибитор каспаз, гомологичный белкам се-
мейства Вс1-2 (например, Bcl-xL) у млекопитающих. Для
осуществления своих функций ингибитор каспаз нуждается
в белке, кодируемом геном ced-4, действующим в качестве
моста между каспазой и ее ингибитором. Существует и не-
сколько вспомогательных генов ced. Эндогенные белковые
активаторы апоптоза - Bad, Bax и Bcl-X
s
,
ингибиторы -
Вс1-2 и Bcl-X
L
.
Основной механизм апоптоза у животных и растений
консервативен, но в геноме арабидопсиса отсутствуют мно-
гие гены, кодирующие регуляторы апоптоза, характерные
для человека, червей, насекомых, что показывает, что рас-
тения используют и другие регуляторы для контроля над
этим процессом [Lam et al., 2001]. В то же время обработка
кеточной суспензии томатов химическими индукторами
апоптоза животных клеток приводила к апоптозу и клеток
растений [De Jong et al., 2000].
Очень важным этапом апоптоза является активация цис-
теиновых протеиназ - каспаз (сокращение от кальцийзави-
симых протеиназ). С помощью ингибиторного анализа по-
казано, что сериновые протеиназы не отвечают за развитие
этих событий [Green,1998]. Гибель клеток затормаживалась
под влиянием экзогенного ингибитора цистеиновых проте-
иназ [Vardi et al., 1999] и при активации экспрессии гена эн-
догенного белкового ингибитора цистеиновых протеиназ
ISolomon et al.,
1999]. Еще один существенный этап апопто-
за - активация эндонуклеаз.
Растения имеют два основных класса ДНКаз: Zn
2+
-
и
Са
2+
-
зависимые, и оба принимают участие в процессе апоп-
тоза [Sugiyama et al., 2000]. Их активация приводит к фраг-
ментации ядерной ДНК [Mittler et al., 1997; Gao, Showalter,
1999; Vardi et al., 1999; De Jong et al., 2000; Pedroso et al., 2000;
Xu, Roossinck,
2000]. Исследование апаптоза животных кле-
ток позволило установить, что существуют программы
апоптоза и их начальными звеньями можно считать лиган-
ды (первичные сигналы) апоптоза - своеобразную "черную
метку" и семейство рецепторов этих лигандов.
Эти события проявляются достаточно быстро, напри-
мер, фрагментация ДНК обнаруживалась через 12 ч после
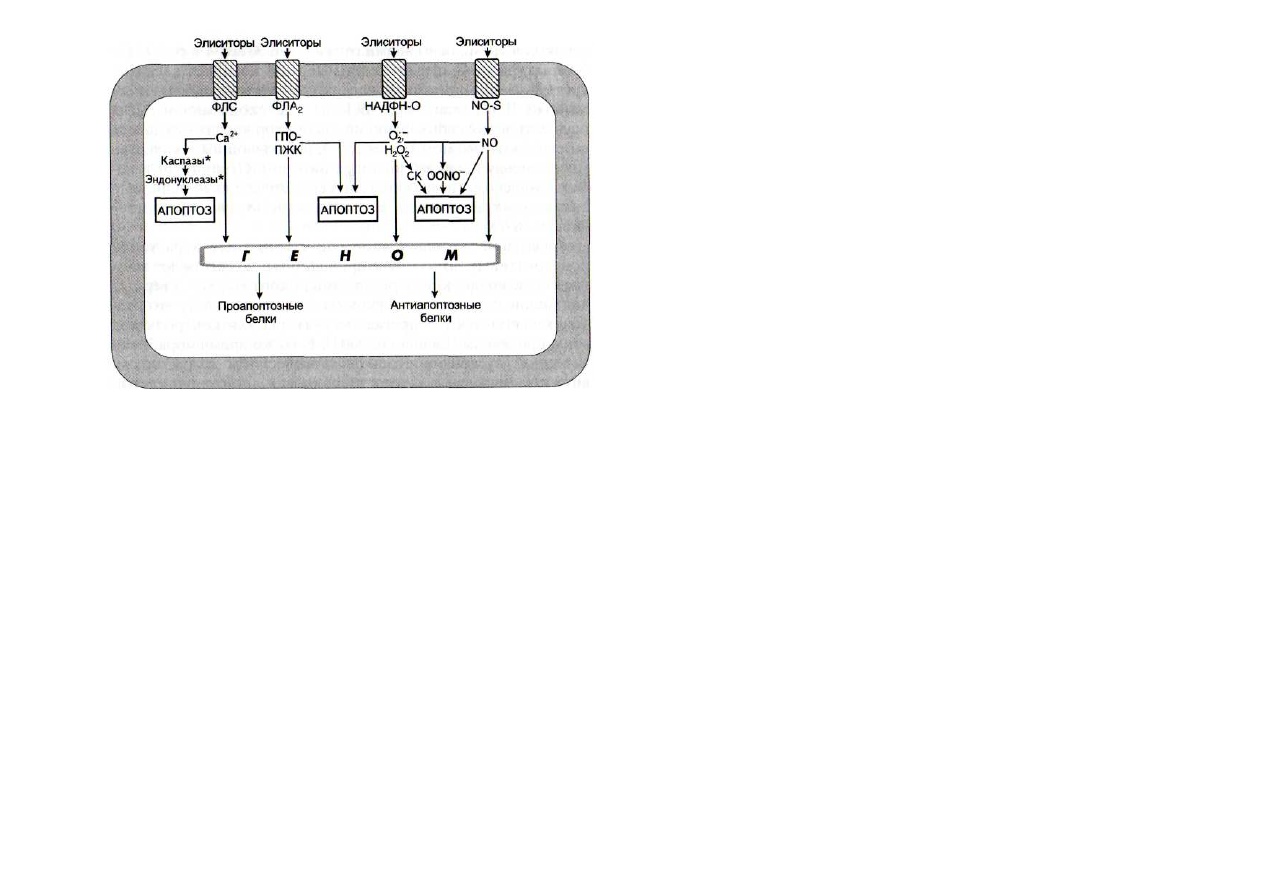
Рис. 35. Схема участия кальциевой, липоксигеназной, НАДФН-
оксидазной и NO-синтазной сигнальных систем в процессе апоп-
тоза клеток
ГПО-ПЖК - гидропероксипроизводные полиеновых жирных кис-
лот; НАДФН-О - НАДФН-оксидаза; ФЛА
2
-
фосфолипаза А
2
;
ФЛС - фосфолипаза С; NO-S - NO-синтаза;
Of
-
супероксиданион-
радикал; OONO" - пероксинитрит
воздействия перекиси водорода на протопласты из корней
чечевицы, достигая максимальной величины еще через 12 ч
[Maccarrone et al., 2000].
Имеются доказательства, что начальные этапы процесса
апоптоза осуществляются с помощью сигнальных систем
клеток растений, "включаемых" элиситорами или(и) токси-
нами патогенов. Об этом свидетельстуют, например, дан-
ные, что малые G-белки могут регулировать интенсивность
процесса апоптоза [Kawasaki et al., 1999], так же как проте-
инкиназы и протеинфосфатазы.
Доказано, что основное участие в инициировании апоп-
тоза принимают такие сигнальные системы клеток, как
кальциевая [Mittler et al., 1995; и др.], НАДФН-оксидазная
[Mittler et al., 1998; 1999], NO-
синтазная [Pedroso et al., 2000;
и др.] и липоксигеназная [Rusterucci et al., 1999; Maccarrone et
al.,
2000] (рис. 35). О последнем свидетельствует предотвра-
щение фрагментации ДНК при действии ингибиторов липо-
ксигеназ на клетки, осуществляющие Н
2
О
2
-
индуцируемый
апоптоз [Maccarrone et al., 2000].
Имеются немногочисленные свидетельства участия в
апоптозе МАР-киназной сигнальной системы [Suzuki et al.,
1999]. МАРК-каскад регулирует апоптоз. МАРКК располо-
жена выше SIPK и WIPK. У мутанта табака конститутивно
экспрессируемая МАРКК индуцировала апоптоз [Yang et
al., 2001].
NO
независимо от АФК вызывал апоптоз у суспензии
клеток арабидопсиса со всеми его атрибутами: конденсаци-
ей хроматина, каспазной активностью, а ингибитор каспаз
блокировал апоптоз [Clarke et al., 2000].
Предполагается, что в апоптозе животных клеток мо-
жет принимать участие и аденилатциклазная сигнальная си-
стема [Северин и др., 2001].
Сигнальные интермедиаты перечисленных выше систем
могут активировать предсуществующие в клетках фермен-
ты, а также инициировать экспрессию главных генов апоп-
тоза, кодирующих эндонуклеазы [Mittler, Lam, 1995; 1997;
Aoyagi et al.,1998; Tada et al.,
2001] и протеиназы [De Silva et
al., 1998; Solomon et al., 1999; De Jong et al., 2000; Tada et al.,
2001], в том числе представителей семейства каспаз, не
только специфичных для животных объектов [De Jong et al.,
2000], но обнаруживаемых и у растений. Получены данные
об элиситориндуцируемой экспресии генов белков, осуще-
ствляющих тонкую регуляцию процесса апоптоза [Polyak et
al., 1997; Pontier et al., 1998].
Патогены или элиситоры могут не только активиро-
вать, но и затормаживать экспрессию некоторых генов, на-
пример, катал азы и аскорбатпероксидазы [Mittler et al.,
1998; 1999] -
ферментов, принимающих участие в снижении
уровня перекиси водорода в цитоплазме, что повышает со-
держание этого сигнального соединения и, возможно, явля-
ется определяющим в индукции экспрессии генов апопто-
за - эндонуклеаз и протеиназ. Кстати, накапливается все
больше фактов экспрессии генов, вызывающих торможе-
ние развития апоптоза [Gallois et al., 1997; Gray et al., 1997;
Tanaka et al., 1997; Mayda et al., 1999; Mitsuhara et al., 1999].
В активации предсуществующих ферментов на первом
этапе апоптоза (после рецепции клеткой элиситора - сигна-
ла смерти) важную роль играет кальциевая сигнальная сис-
тема в связи с тем, что основные ферменты, отвечающие за
программируемую смерть клеток протеазы семейств каспаз
и эндонуклеаз, - это кальцийактивируемые ферменты.
У животных одной из мишеней сигнального Са
2+
, инду-
цирующего апоптогенный сигнал, являются митохондрии.
Обнаружено, что сигналы, приводящие к апоптозу, вызыва-
ют раннее, еще до появления первых ультраструктурных
симптомов гибели клетки, повышение проницаемости внут-
ренней митохондриальной мембраны, одним из последст-
вий которого может считаться потеря митохондриями ци-
тохрома
с
[Северин и др., 2001]. В цитозоле он вызывает
"включение" каскада каспаз, разрушающих топоизомеразу
и гистон HI, который защищает ДНК от действия эндону-
клеаз на межнуклеосомальном уровне. Повышение кон-
центрации ионов кальция в цитозоле может привести так-
же к непосредственной активации Са
2+
, Mg^-
зависимых
эндонуклеаз.
У растений освобождение цитохрома
с
тоже предшест-
вует морфологическим изменениям, связанным с апопто-
зом [Balk, Leaver, 2001]. Оказалось, что цитохром
с
индуци-
рует апоптоз только в окисленном состоянии. Высокий
уровень цитоплазматического восстановленного глутатио-
на (GSH) поддерживает его в неактивном состоянии, а
Н
2
О
2
, снижая содержание GSH, вызывает апоптоз [Hancock
et al., 2001].
В целом ряде работ были получены свидетельства уча-
стия стрессовых фитогормонов салициловой кислоты, жас-
моновой кислоты и этилена в развитии процесса апоптоза.
В опытах с использованием трансгенных растений арабидоп-
сиса с чужеродным геном NahG (что приводило к деградации
салициловой кислоты), а также с мутантами, нечувствитель-
ными к жасмоновой кислоте или этилену, было обнаружено,
что апоптоз медиируется сигнальными путями, включающи-
ми салицилат, жасмонат и этилен [Asai et al., 2000].
Этилен вызывал апоптоз [Mergemann, Sauter, 2000] -
фрагментацию ДНК, съеживание ядра [Herbert et al., 2001],
у клеток табака в культуре. Тот же эффект вызывала обра-
ботка перекисью водорода [Houot et al., 2001]. Салицилат и
этилен вовлечены в регуляцию апоптоза у арабидопсиса
[Greenberg et al.,
2000]. В отношении салицилата это было
подтверждено в опытах и других исследователей [Heath,
2000; Ludwig, Tenhaken, 2000].
Салицилат-опосредованная активация апоптоза у топо-
ля ингибировалась жасмоновой кислотой [Koch et al., 2000].
Существует большая литература о взаимодействии этих
двух сигнальных метаболитов. Экзогенный салицилат, в за-
висимости от концентрации, может приводить как к апоп-
тозу, так и к антиоксидантным защитным путям. Озон
вызывал апоптозный ответ через салицилатзависимый и
независимый (жасмонатный и этиленовый) пути. Если ли-
стья тополя перед действием озона подвергались раневому
воздействию или действию жасмоната, то уровень повреж-
дений был меньше. Озониндуцированное образование по-
вреждений (lesion) происходит двумя отдельными путями у
двух клонов тополя. У устойчивого клона - это апоптоз,
связанный со сверхчувствительностью, а у чувствительно-
го - некроз, вызванный потерей антиоксидантной защиты
от активных форм кислорода.
На листьях трансгенного арабидопсиса с привнесенным
геном NahG (салицилатгидроксилазы) было показано [Rao,
Davis,
1999], что смерть клеток наступает из-за неспособно-
сти поддерживать достаточный уровень антиоксидантной
защиты.
Участие топоизомеразы в качестве одного из критиче-
ских звеньев осуществления апоптоза подтверждено с по-
мощью ингибиторного анализа. В суспензии клеток томата
ингибитор топоизомеразы I камптотецин вызывал апоптоз.
Каспазный ингибитор уменьшал эффект, а этилен - усили-
вал его [Orzaez et al., 2001]. Камптотецин вызывал также
межнуклеосомальную деградацию ДНК у клеток культуры
томата [Hoeberichts et al., 2001].
Использование трансгенных растений табака с привне-
сенными антиапоптозными генами человека Вс1-2 и Bcl-xl,
а также нематодным геном ced-9 [Dickman et al., 2001] пока-
зало, что у них грибная инфекция не приводила к фрагмен-
тации ДНК, в отличие от контрольных растений.
В последнее время предпринимаются усилия для рас-
шифровки механизмов регуляции апоптоза, что может
иметь и большое практическое значение для изменения ус-
тойчивости растений к патогенам.