ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.11.2019
Просмотров: 4037
Скачиваний: 98
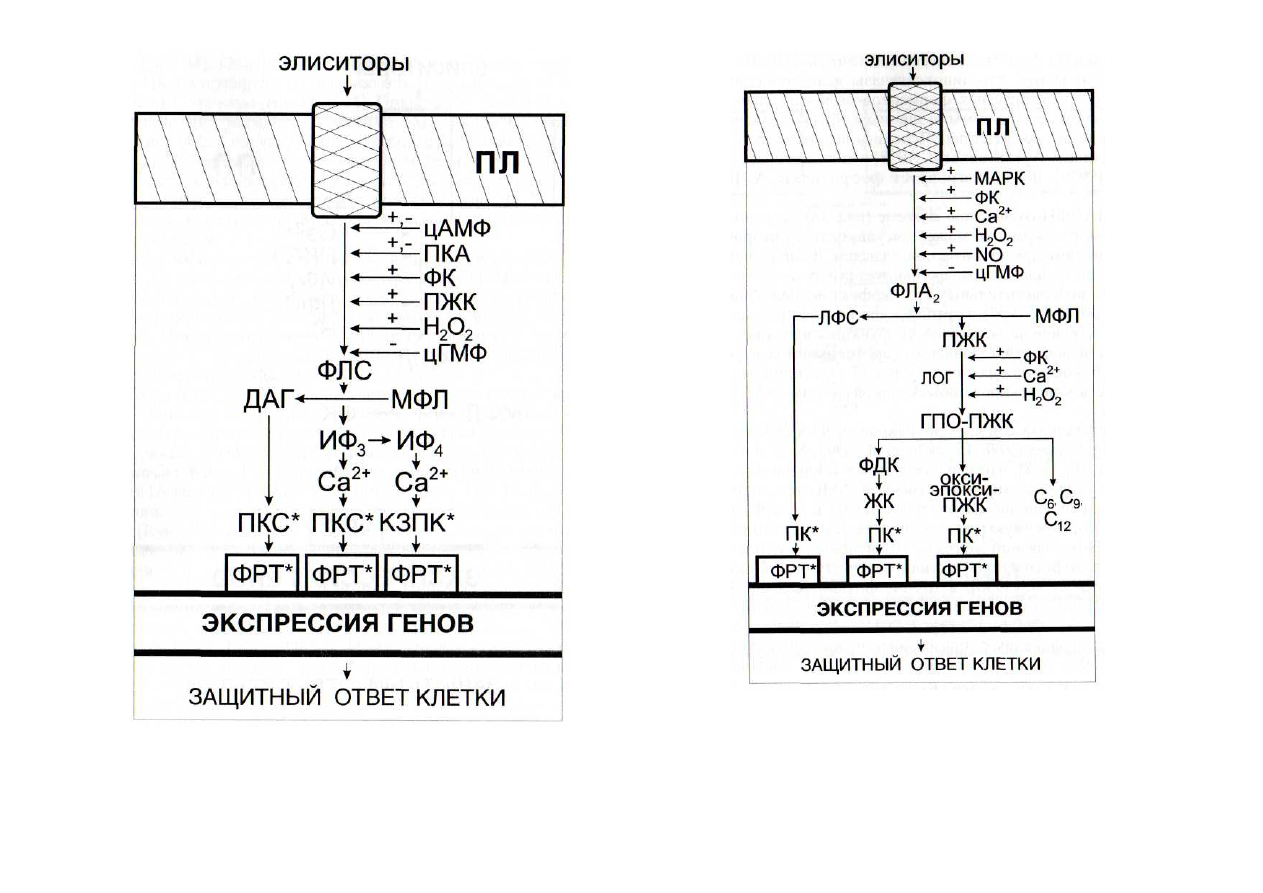
Рис. 46. Регуляция функционирования кальциевой сигнальной
системы интермедиатами других сигнальных систем
ИФ
4
-
инозитолтетракисфосфат; КЗПК - кальцийзависимая проте-
инкиназа; МФЛ - мембранные фосфолипиды; ПКА - протеинкиназа А;
ПКС
-
протеинкиназы С; ПЛ - плазмалемма; ФЛС - фосфолипаза С.
Остальные обозначения - см. рис. 42
Рис. 47. Регуляция функционирования липоксигеназной сигналь-
ной системы интермедиатами других сигнальных систем
ГПО-ПЖК - гидропероксипроизводные полиеновых жирных кис-
лот; ЖК - жасмоновая кислота; ЛФС - лизофосфатиды; МФЛ - мемб-
ранные фосфолипиды; окси-эпокси-ПЖК - гидропероксиформы поли-
еновых жирных кислот; ПЛ - плазмалемма; ФЛА
2
-
фосфолипаза А
2
;
С
6
, С
9
, С
12
-
шести-, девяти- и двенадцатиуглеродные продукты лиазных
реакций. Остальные обозначения - см. рис. 42
фосфолипазу А
2
и липоксигеназу [Macri et al., 1994]. Необ
ходимо отметить, что липоксигеназы являются одними из
наиболее регулируемых ферментов всех сигнальных сис
тем, причем ее изоформы различным образом отвечают на
одни и те же воздействия. Перекись водорода активирует
фосфолипазу А
2
[Stennis et al.,
1998] и липоксигеназу [Doares
et al., 1995b],
цГМФ ингибирует фосфолипазу А, [Ванин,
1998].
'
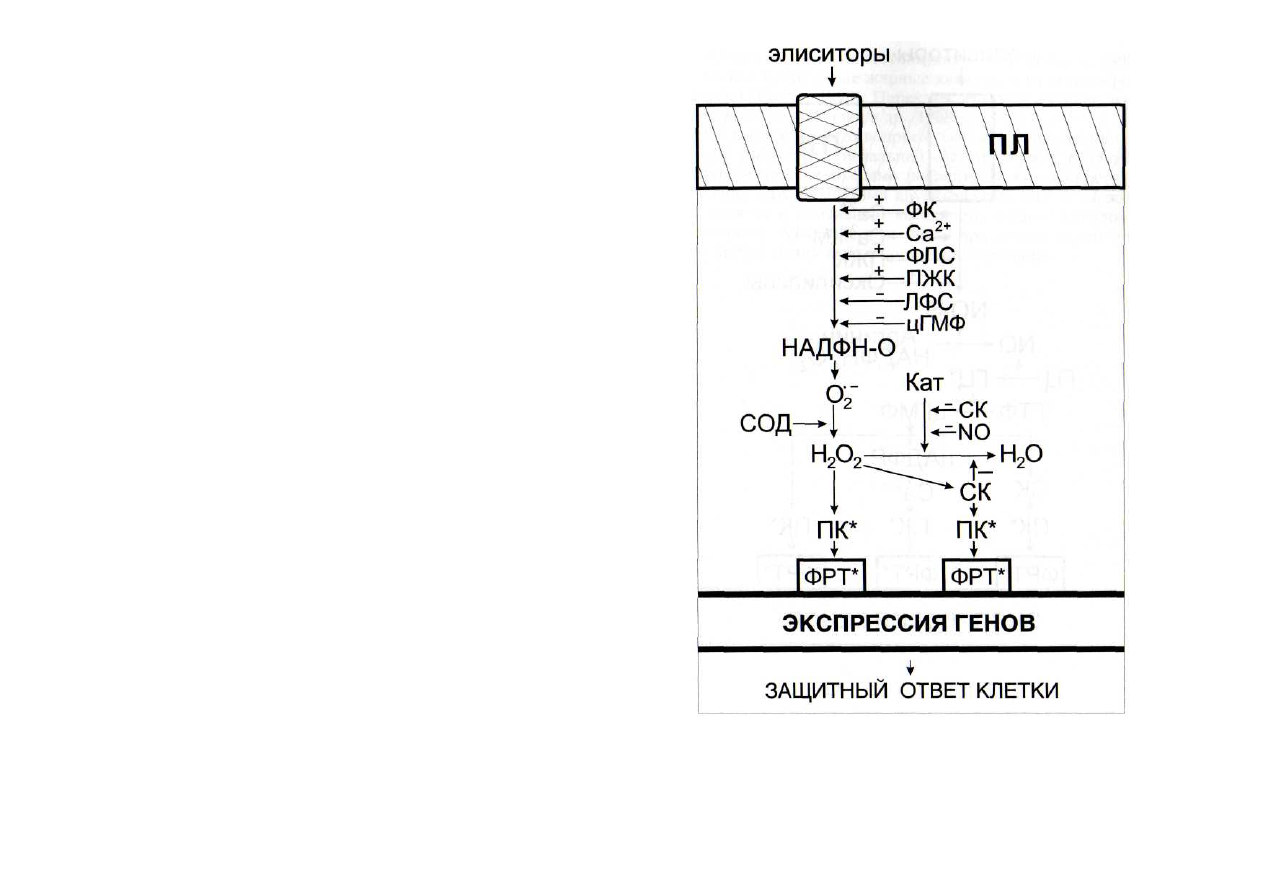
В НАДФН-оксидазной системе (рис. 48) активность од-
ноименного фермента может регулироваться вторичными
посредниками других сигнальных систем. В животных клет-
ках фосфатидная кислота активирует супероксидсинтазную
систему, но в растительных этот эффект не был обнаружен
[Schroeder et al.,
1997], хотя и предполагается [Wang, 1999],
что не исключена возможность функционирования специ-
фической фосфатидатзависимой протеинкиназы, осуществ-
ляющей фосфорилирование белка 47 кДа, принимающего
участие в конструировании активной формы НАДФН-ок-
сидазы.
Фосфолипаза С и Са
2+
активировали НАДФН-оксидазу
[Harding, Roberts, 1998; Legendre et al., 1993; Xing et al., 1997;
Keller et al.,
1998], что свидетельствует о влиянии кальцие-
вой системы. Кальмодулинзависимая НАД-киназа стимули-
ровала превращение цитозольного НАД в НАДФ, обеспе-
чивая достаточную интенсивность функционирования
НАДФН-оксидазной системы. Полиеновые жирные кисло-
ты и лизофосфатиды активировали НАДФН-оксидазу
[Brightman et al.,
1990], а цГМФ ингибировал ее [Ванин,
1998]. Возрастание концентрации оксида азота может при-
вести к повышению интенсивности его связывания с супер-
оксидным радикалом с образованием пероксинитрита [Волин
и др., 1998]. В результате этого снижаются концентрация
О
2
и скорость образования из него перекиси водорода в ходе
реакции, катализируемой супероксиддисмутазой. В то же
время N0 ингибирует каталазу [Волин и др., 1998], что
должно привести к повышению содержания перекиси водо-
рода. По всей вероятности, итог этого противоположного
влияния на содержание Н
2
О
2
зависит от концентрации
оксида азота.
В настоящее время интенсивно исследуется
регуляция ферментов NO-синтазной системы (рис. 49). Са
2+
активиро-
Рис. 48. Регуляция функционирования НАФН-оксидазной сиг-
нальной системы интермедиатами других сигнальных систем
Кат - каталаза; ЛФС - лизофосфатиды; НАДФН-О - оксидаза
НАДФН; ПЛ - плазмалемма; ФЛС - фосфолипаза С. Остальные обо-
значения - см. рис. 42
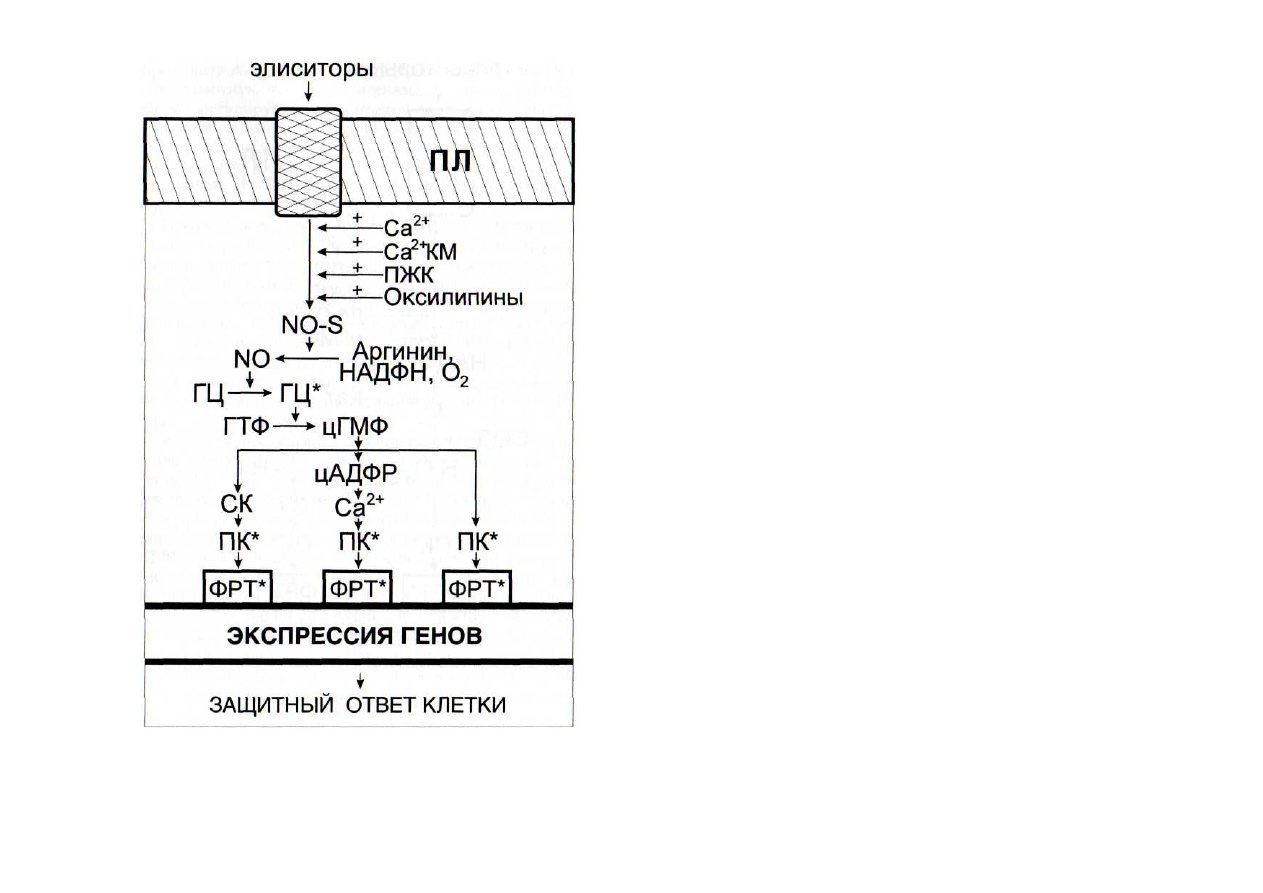
Рис. 49. Регуляция функционирования NO-синтазной сигнальной
системы интермедиатами других сигнальных систем
ГЦ - гуанилатциклаза; КМ - кальмодулин; ПЛ - плазмалемма; NO-S - NO-
синтаза. Остальные обозначения - см. рис. 42
вал NO-синтазу [Малышев, Манухина, 1998; Cho et al., 1998],
так же как полиеновые жирные кислоты и их гидроперок-
сиформы [Ванин, 1998]. Перекись водорода активировала
гуанилатциклазу [Волин и др., 1998].
Несмотря на то что вопрос о существовании самостоятельной
протонной
сигнальной
системы
может
считаться
дискуссионным, необходимо рассмотреть возможности ее
регуляции интермедиатами других систем. Эти возможности
сводятся к изменению активности ионных каналов и
мембранных АТФаз (в том числе протонных помп), что было
проанализировано в предыдущем разделе.
ПАТОГЕНИНДУЦИРУЕМЫЕ БЕЛКИ
При изучении особенностей влияния патогенов на рас-
тения (с использованием методов хроматографии и элек-
трофореза) было обнаружено интенсивное накопление в
инфицированных тканях нескольких так называемых па-
тогениндуцируемых полипептидов (PR) [Neumann et
al.,1989].
В дальнейшем в результате применения все боль-
шего арсенала методов удалось значительно расширить
круг патогениндуцируемых полипептидов, в том числе за
счет минорных полипептидов, содержание которых может
быть невысоким. Назрел вопрос о классификации патоген-
индуцируемых и элиситориндуцируемых белков по их
функциональной принадлежности, по роли в формирова-
нии иммунитета у растения-хозяина и в подавлении разви-
тия патогена.
При инфицировании патогенами в клетках растений
происходит репрограммирование экспрессии генов, прояв-
ляющееся в замедлении синтеза одних белков и усилении
образования или появлении других, отсутствующих в тка-
нях неинфицированных растений. Было выявлено, что это
происходит с помощью сигнальных соединений - элисито-
ров. Некоторые из них продуцируются микроорганизмами
(например, белок криптогеин - фитопатогенным грибом
Phytophthora cryptogea [Ricci et al.,
1989]), другие образуют-
ся в клетках растений.
Можно подразделить все патоген(элиситор)индуцируе-
мые белки на несколько групп по тем функциям, которые
они выполняют. Одни являются участниками сигнальных
систем растений, и их интенсивное образование обеспечива-
ет усиление восприятия, преобразования и передачи в гене-
тический аппарат элиситорного сигнала, другие ограничи-
вают питание патогенов. Третьи патогениндуцируемые
белки катализируют образование низкомолекулярных рас-
тительных антибиотиков - фенилпропаноидных или терпе-
ноидных фитоалексинов. Четвертые катализируют реак-
ции укрепления клеточных стенок растений, пятые вызыва-
ют самоубийство инфицированных и соседних клеток.
Функционирование всех этих патогениндуцированных бел-
ков может существенно ограничивать распространение ин-
фекции по растению. Наконец, шестая группа белков мо-
жет непосредственно действовать на структуры и функции
патогенов, прекращая или подавляя их развитие. Некото-
рые из этих белков вызывают деградацию клеточной стен-
ки грибов и бактерий, другие дезорганизуют функциониро-
вание их клеточной мембраны, изменяя ее проницаемость
для ионов, третьи подавляют работу белоксинтезирующей
машины, блокируя синтез белков на рибосомах грибов и бак-
терий или действуя на вирусную РНК.
Патогениндуцируемые белки - участники сигнальных
систем клеток.
Результаты многочисленных исследований
убеждают в возможности элиситориндуцируемого образо-
вания как начальных белковых участников сигнальных сис-
тем - рецепторов [Warren et al., 1998], и функционально свя-
занных с ними G-белков [Terryn et al., 1993; Ichinose et
al.,1999],
а также ингибиторов диссоциации G-белков [Kim
et al., 1999],
так и конечных - факторов регуляции транс-
крипции [Da Costa de Silva et al.,1993; Rushton, Somssich,
1998; Eulgem et al., 1999; Lee et al.,
2001] (рис. 50 ).
Имеются данные и об элиситориндуцируемой актива-
ции синтеза белковых промежуточных продуктов раз-
личных сигнальных систем, в частности об экспрессии ге-
нов фосфолипазы Д [Young et al., 1996], МАР-киназы
[Takezawa,1999],
экспрессии генов кальмодулина, участвую-
щего в функционировании кальциевой сигнальной системы
[Bergey, Ryan,1999; Heo et al.,1999],
генов ретикулоплазми-
нов (белков эндоплазматической сети) - BIP и кальретику-
лина, играющего определенную роль в связывании ионов
кальция и в связи с этим способного участвовать в регуля-
ции функционирования кальциевой сигнальной системы
[Denecke et al.,1995].
При грибной инфекции индуцируется
мессенджерный белок 29,2 кДа, аналогичный многофунк-
циональным кальцийзависимым протеинкиназам [Brandt et
al.. 1992].
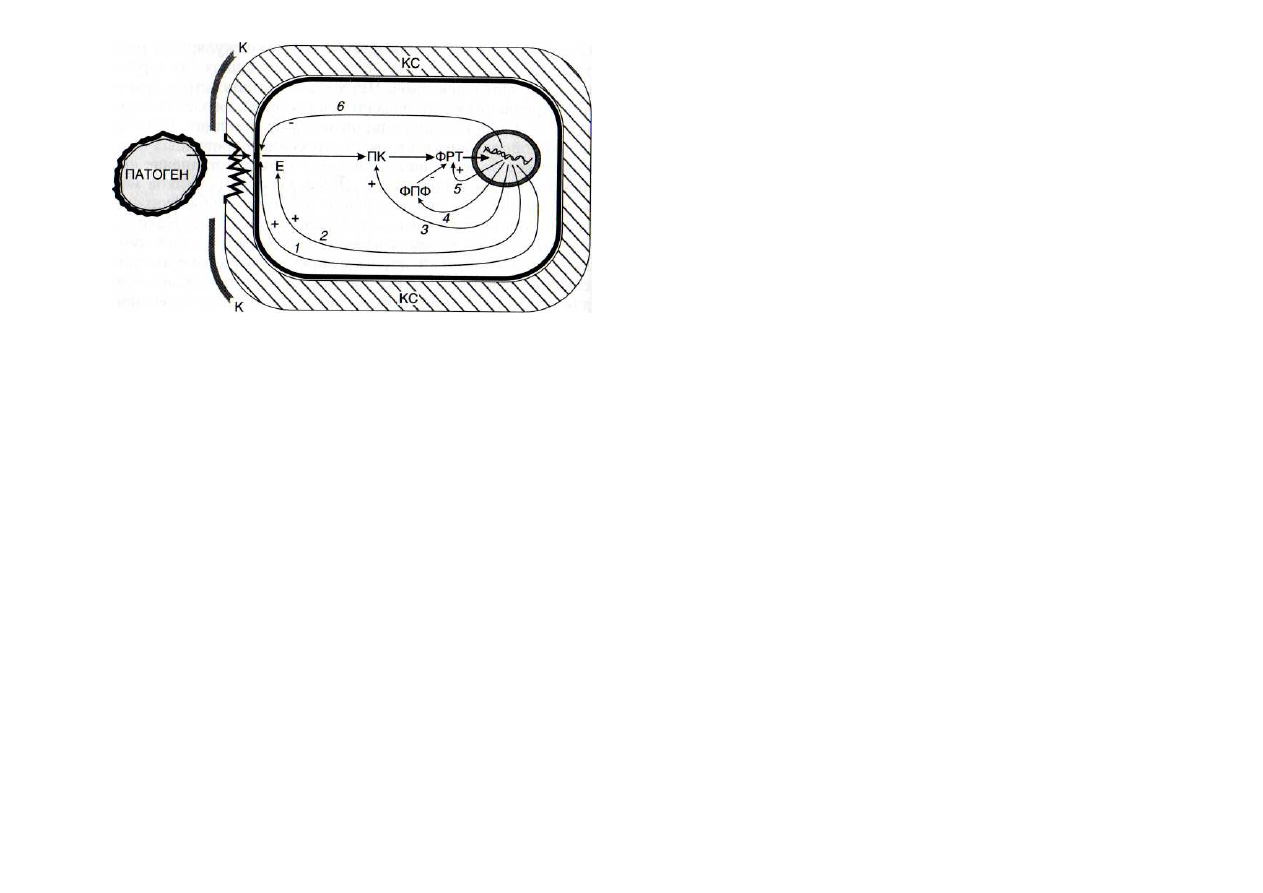
Рис. 50. Схема патогениндуцируемого образования интермедиа-
тов сигнальных систем
1 —
рецепторный белок; 2 - стартовый фермент сигнальной систе-
мы;
3
-
протеинкиназы (ПК);
4
-
фосфопротеинфосфатазы (ФПФ); 5 -
факторы регуляции транскрипции (ФРТ);
6
-
протеиназы, разрушаю-
щие рецептор. (+) - активация, (-) - ингибирование сигнальных систем.
Е - стартовый фермент сигнальной системы; К - кутикула; КС - кле-
точные стенки
В липоксигеназной сигнальной системе было обнару-
жено патоген- и элиситориндуцируемое повышение содер-
жания мРНК, кодирующих различные формы липоксиге-
наз [Melan et al.,1993; Peng et al.,1994; Veronesi et al.,1996;
Schweizer et al.,1997;
Гречкин, Тарчевский, 1999]. Анало-
гичный эффект обнаруживался при действии экзогенных
абсцизовой [Melan et al., 1993] и салициловой [Feussner et
al., 1997b]
кислот, а также метилжасмоната [Bell, Mullet,
1993; Bergey, Ryan,
1999]. Показано патогениндуцирован-
ное накопление в растениях циклооксигеназы, гомологич-
ной простагландиновому ферменту у животных [Sanz et
al.,1998],
а также представителей семейства цитохромов
Р-450, к которым относят и некоторые ферменты липок-
сигеназной сигнальной системы [Song, Brash, 1991]. Необ-
ходимо отметить, что тот или иной стрессор или сигнал
может вызывать неодинаковую интенсивнось и временной
ход накопления транскриптов различных форм липоксиге-
наз [Saravitz, Siedow,1996]. Патогены [Kirsch et al., 1997],
так же как метилжасмонат [Nishiuchi et al., 1997], вызыва-
ли экспрессию генов десатураз, обеспечивая образование
полиеновых жирных кислот из насыщенных, необходи-
мых для осуществления начальных реакций липоксигеназ-
ной сигнальной системы. Еще один автокаталитический
цикл - это индукция метилжасмонатом экспрессии генов
десатуразы, катализирующей превращение линолевой
кислоты в линоленовую. По всей вероятности, это самый
протяженный автокаталитический оксилипиновый цикл
(см. рис. 21). Недавно [Seo et al., 2001] был обнаружен еще
один автокаталитический цикл, заключающийся в индук-
ции метилжасмонатом экспрессии гена метилтрансферазы
(S-
аденозил-метионин: жасмоновая кислота - карбоксил
метилтрансферазы), катализирующей реакцию метилиро-
вания жасмоновой кислоты.
В супероксидсинтазной системе патогены индуцировали
экспрессию генов супероксиддисмутазы, глутутион-S-
трансферазы, глутатион-пероксидазы [Levine, 1994;
Vanacker et al.,
1998], но подавляли экспрессию генов аскор-
бат-пероксидазы и каталазы (т.е. антиокислительные меха-
низмы), вызывая повышение содержания активных форм
кислорода, что, в свою очередь, приводило к образованию
патогениндуцированных белков [Mittler et al., 1999]. Однако
имеются сведения о том, что содержание транскриптов ци-
топлазматической аскорбат-пероксидазы, с помощью кото-
рой происходит в значительной степени детоксикация пере-
киси водорода, повышается при инфицировании патогена-
ми, в то время как синтез фермента подавляется посттранс-
крипционно [Mittler et al., 1998].
В NO-синтазной сигнальной системе возможна не толь-
ко активация предсуществующей NO-синтазы элиситором -
протеогликаном из крокуса [Escribano et al., 1999], но и эли-
ситориндуцированная экспрессия этого фермента. Имеют-
ся также факты противоположного влияния. Сесквитерпе-
новые лактоны из некоторых мексиканских и индийских
лекарственных растений подавляли экспрессию NO-синта-
зы в животных клетках [Wong, Menendez, 1999]. Таким же
действием обладало и кумариновое соединение скополетин
[Kang et al., 1999].
Триптохинон растений подавлял липопо-
лисахарид-индуцированную экспрессию индуцибельной
NO-
синтазы в животных тканях [Niwa et al,, 1996].