ВУЗ: Не указан
Категория: Не указан
Дисциплина: Не указана
Добавлен: 27.11.2019
Просмотров: 4036
Скачиваний: 98
мента находился в области рН 4,8-5,2 [Carricarte et al., 1988].
Получены данные об изоформе аденилатциклазы с оптиму-
мом рН, равным 8,8 [Simonin et al., 1988].
Аденилатциклаза может модифицироваться с внешней
стороны мембраны гликозилированием, а с внутренней -
фосфорилированием А-киназой [Северин, 1991]. Актив-
ность мембранной аденилатциклазы зависит от фосфоли-
пидного окружения - соотношения фосфатидилхолина, фо-
сфатидил-этаноламина, сфингомиелина, фосфатидилс'ери-
на и фосфатидилинозитола.
Содержание цАМФ в клетках определяется соотноше-
нием активности двух ферментов - аденилатциклазы и
фосфодиэстеразы 3',5'-цАМФ (ФДЭ). При действии послед-
ней фосфодиэфирная связь цАМФ подвергается гидролизу,
что приводит к появлению неактивного нециклического 5'-
АМФ.
Элиситориндуцируемое повышение содержания цАМФ
в клетках имеет преходящий характер, что объясняется ак-
тивацией ФДЭ и, возможно, связыванием цАМФ-зависимы-
ми протеинкиназами. Действительно, повышение концент-
рации цАМФ в клетках активирует различные цАМФ-зави-
симые протеинкиназы, которые могут фосфорилировать
различные белки, в том числе факторы регуляции транс-
крипции, что приводит к экспрессии различных генов и от-
вету клетки на внешнее воздействие.
Коэффициент умножения сигнала, достигаемый при его
передаче в геном и экспрессии генов, составляет многие ты-
сячи. Схема умножения сигнала при функционировании
аденилатциклазной сигнальной системы часто используется
в учебниках биохимии [Lehninger et al., 1993]. Эта сигналь-
ная система продолжает интенсивно исследоваться на раз-
личных объектах, пополняя представления об информаци-
онном поле клеток и его связи с внешними информацион-
ными потоками.
Необходимо заметить, что вопрос о функционировании
аденилатциклазной сигнальной системы в растительных
объектах на протяжении почти четверти века продолжал
оставаться дискуссионным, разделяя исследователей на ее
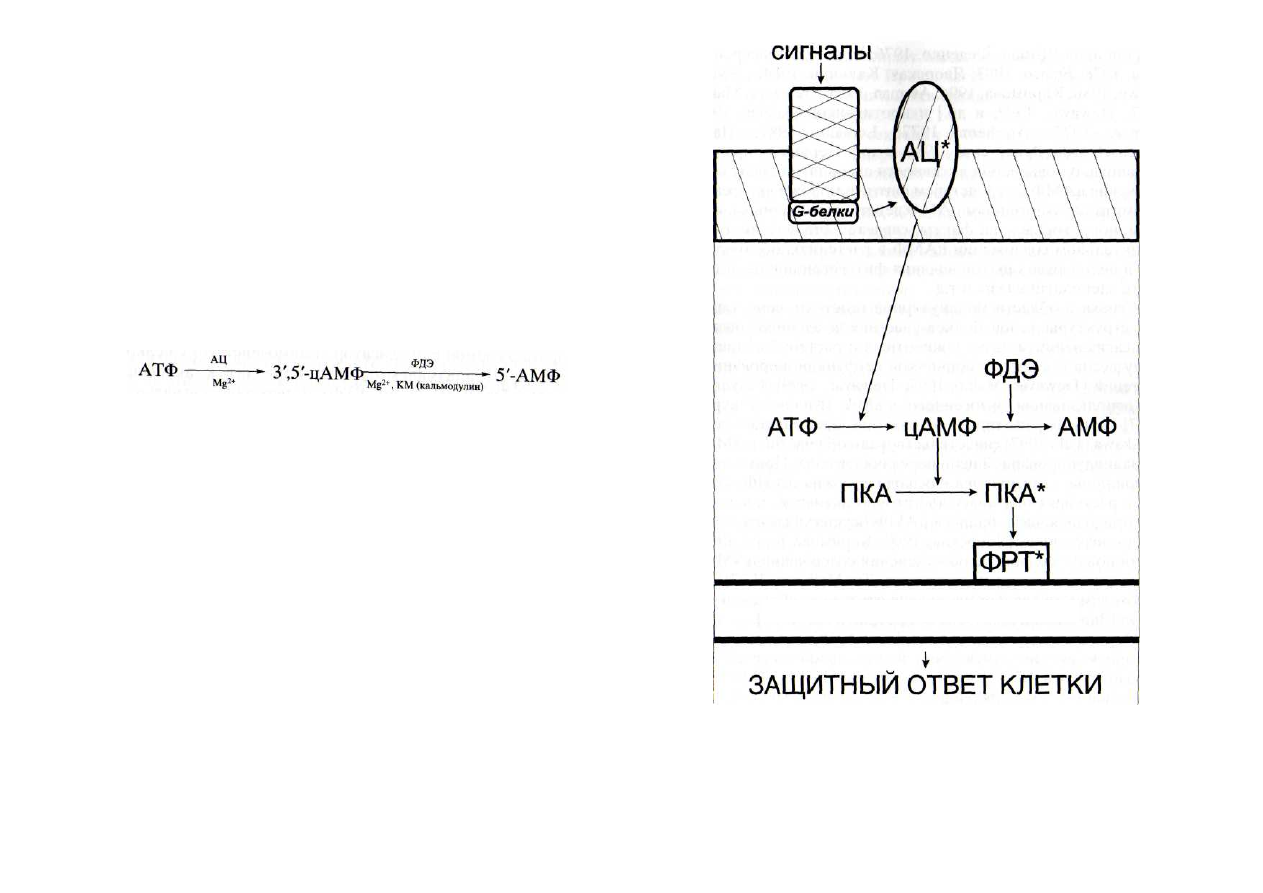
Рис. 6. Схема функционирования аденилатциклазной сигнальной
системы
АЦ* - активная форма аденилатциклазы; ПКА и ПКА* - неактив-
ная и активная формы протеинкиназы А; ПЛ - плазмалемма; ФДЭ -
фосфодиэстераза; ФРТ* - активная форма фактора регуляции транс-
крипции
ЭКСПРЕССИЯ ГЕНОВ
сторонников [Доман, Феденко, 1976; Королев, Выскребен-
цева, 1978; Franco, 1983; Яворская, Калинин, 1984; Newton,
Brown,
1986; Каримова, 1994, Assman, 1995; Trewavas, Malho,
1997; Trewavas,
1999; и др.] и противников [Keates, 1973;
Varner, 1975; Amrhein, 1977; Letham, 1987; Hahn,
Grisebach,1983; Spiteri et al.,
1989; и др.]. Первые опирались
на данные о повышении активности аденилатциклазы и со-
держания цАМФ под действием фитогормонов и патогенов,
об имитации экзогенным цАМФ действия различных фито-
гормонов, вторые - на факты, свидетельствовавшие о не-
значительном содержании цАМФ в растениях, об отсутст-
вии в целом ряде опытов влияния фитогормонов на актив-
ность аденилатциклазы и т.д.
Успехи в области молекулярной генетики, сопоставле-
ние структуры генов белков-участников аденилатциклаз-
ной сигнальной системы у животных и растений склонили
чашу весов в пользу сторонников ее функционирования у
растений [Trewavas, Malho, 1997; Trewavas, 1999]. Результа-
ты использования экзогенного цАМФ [Килев, Чекуров,
1977] или форсколина (активатора аденилатциклазы)
[Ichikawa et al.,
1997] свидетельствовали об участии цАМФ в
сигналиндуцированнои цепи передачи сигнала. Применение
теофиллина - ингибитора фосфодиэстеразы цАМФ, кото-
рая в растениях оказалась достаточно активной, показало,
что приходная часть баланса цАМФ осуществляется доста-
точно интенсивно [Яворская, 1990; Каримова и др., 1990].
Были получены данные об изменении содержания цАМФ в
растениях под влиянием патогенов [Tu, Malhotra, 1977], его
необходимости для формирования ответа на действие пато-
генов [Зарубина и др., 1979; Очеретина и др., 1990].
Обращает на себя внимание факт АТФ-зависимого вы-
деления во внеклеточную среду значительной части цАМФ,
образованного в клетках животных [Makman,
Sutherland,1965;
Федоров и др., 1990; Fehr et al., 1990; Орлов,
Максимова, 1999], прокариот [Goldenbaum, Hall, 1979; Ши-
ян, Лазарева, 1988], водорослей [Franco, 1983] и высших рас-
тений [Ashton, Polya, 1977; 1978; Каримова и др., 1993]. По-
казательно, что у растений, так же как у животных, можно
было снизить накопление цАМФ в клетках и выход его во
внеклеточную среду с помощью простагландина [Ehsan et
al.,
1998; 1999], не обнаруживаемого в растениях. Возмож-
но, что эту роль выполняет аналогичный простагландину
оксилипин - жасмонат. Предполагается возможность уча-
стия в выносе цАМФ из клетки специальных АТФ-связыва-
ющих белков [Fehr et al., 1990].
Целесообразность секреции цАМФ из клеток растений
в среду объясняют, в первую очередь, необходимостью до-
статочно быстрого снижения концентрации этого вторич-
ного посредника для того, чтобы не происходило перевоз-
буждения клеток [Franco, 1983; Каримова и др., 1993]. Отно-
сительно быстрое снижение концентраций вторичных по-
средников после достижения максимального уровня являет-
ся непременнной неспецифической чертой функционирова-
ния всех сигнальных систем.
Вероятно, выводимый за пределы плазмалеммы цАМФ
принимает участие в регуляции внеклеточных процессов
[Шиян, Лазарева, 1988]. Это мнение может основываться на
обнаружении экто-цАМФ-зависимых протеинкиназ [Kang
et al.,
1979], использующих секрецию цАМФ из клеток для
активирования фосфорилирования белков за пределами
плазмалеммы. Полагают также, что цАМФ вне клетки мо-
жет выполнять роль первого посредника [Федоров и др.,
1990], индуцируя запуск каскада реакций сигнальных сис-
тем в соседних клетках, что было показано на примере мно-
гоклеточных слизевых грибов [Sucgang et al., 1997].
Привлекают внимание данные, полученные на животных
объектах, об ингибировании экзогенным аденозином (кото-
рый может рассматриваться в качестве продукта деградации
цАМФ) кальциевых каналов клеток [Меерсон, 1986] и акти-
вировании - калиевых каналов [Орлов, Максимова, 1999].
Большой интерес вызывает информация о возможности
регуляции секретируемым цАМФ развития патогенных гри-
бов [Knogge, 1998], в частности ржавчины ячменя [Kinane et
al., 2000], Magnaporthe grisea,
поражающего растения риса [Xu,
Hamer, 1996; Choi, Dean, 1997; Adachi, Hamer,
1998], пыльной
головни Ustilago maydis [Gold et al., 1997; Kahmann et al., 1999],
Erysiphe graminis [A.A. Hall et al., 1999], Colletotrichum trifolii
[Yang, Dickman,
1999], пигментирования Ustilago hordei
[Lichter, Mills,
1998]. В зависимости от концентрации цАМФ
происходила стимуляция или подавление развития грибов.
Полагают, что у них в трансдукции цАМФ-сигнала принима-
ют участие гетеротримерные G-белки [Bolker, 1998].
Накапливается все больше данных о влиянии различных
сигнальных молекул на секрецию цАМФ растительными
клетками. Было показано, что роль АБК в адаптации
растений к стрессу может заключаться в ее способности ре-
гулировать содержание и выход цАМФ из клеток. Предпо-
лагается, что уменьшение содержания цАМФ при действии
АБК вызвана АБК-индуцированным повышением содер-
жания Са
2+
в цитозоле [Iagoucheva et al., 2000] и ингибирова-
нием аденилатциклазы. Известно, что Са
2+
в высокой кон-
центрации ингибирует активность аденилатциклазы у эука-
риот [Taussig, Gilman, 1995]. В то же время Са
2+
может
уменьшить содержание цАМФ, индуцируя повышение ак-
тивности фосфодиэстеразы, гидролизующей цАМФ. Дейст-
вительно, активация фосфодиэстеразы цАМФ комплексом
Са
2+
-
кальмодулин была обнаружена у растительных объек-
тов [Феденко, 1983].
Показана зависимость профиля фосфорилированности
полипептидов от экзогенного цАМФ. Число полипептидов,
фосфорилирование которых стимулировалось цАМФ, бы-
ло наибольшим при микромолярной концентрации цАМФ.
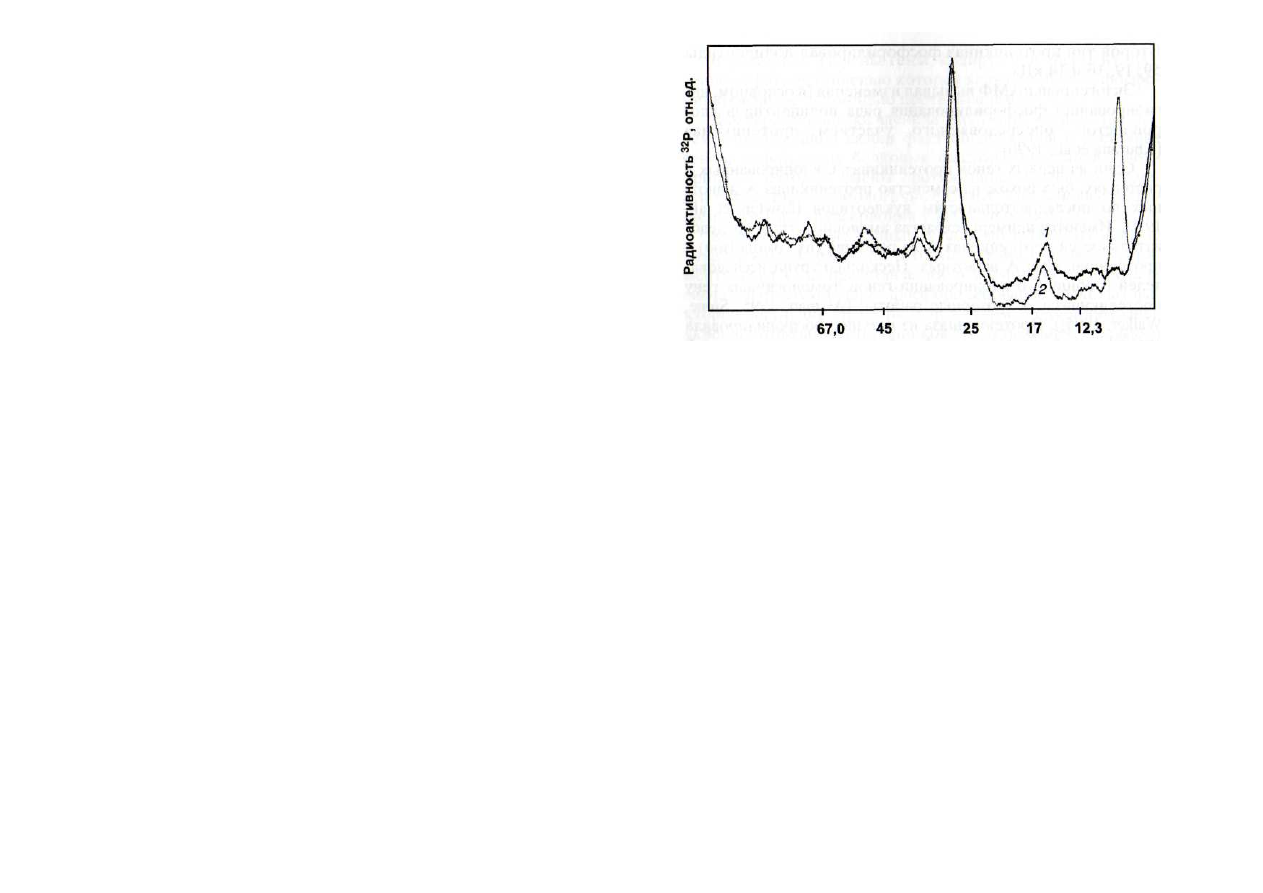
Привлекает внимание факт сильного цАМФ-индуцирован-
ного повышения фосфорилированности полипептида
1
0 кДа при низкой температуре (рис. 7) [Каримова, Жуков,
1991; Ягушева, 2000]. Интересно, что полипептид с такой
молекулярной массой является белковым регулятором фо-
сфодиэстеразы цАМФ, который активируется абсцизовой
кислотой и Са
2+
[Junker,
1977] и снижает содержание цАМФ
за счет его гидролиза фосфодиэстеразой.
Изучение особенностей активации цАМФ-зависимых
протеинкиназ и фосфорилирования ими различных бел-
ков - одно из важнейших направлений исследований аде-
нилатциклазной сигнальной системы. цАМФ-зависимые
протеинкиназы (ПКА) - это ферменты, активирующиеся
при взаимодействии с цАМФ и катализирующие перенос
концевого остатка фосфорной кислоты с АТФ на гидро-
ксильные группы сериновых или треониновых остатков
белков-акцепторов. Ковалентная модификация белков,
осуществляемая при фосфорилировании, приводит к из-
менению их конформации и каталитической активности,
вызывая ассоциацию или диссоциацию их субъединиц
и т.д.
Молекулярная масса белков, кДа
Рис. 7. Влияние цАМФ на фосфорилирование белков трехднев-
ных проростков гороха [Каримова, Жуков, 1991]
1 -
контроль: срезанные побеги переносили на 2 ч черешками в во-
ду, затем еще на 2 ч - в раствор меченного по
32
Р ортофосфата; 2 - сре-
занные растения переносили на 2 ч в раствор 1 мкМ цАМФ, затем еще
на 2 ч - в раствор меченного по
32
Р ортофосфата
Субстратами в протеинкиназной реакции являются Mg-
АТФ и фосфорилируемый белок. Белковые субстраты мо-
гут быть одновременно субстратами для цГМФ- и цАМФ-
зависимых протеинкиназ по одним и тем же остаткам сери-
на (треонина), но скорость цАМФ-зависимого фосфорили-
рования в 10-15 раз больше, чем у цГМФ-зависимых протеин-
киназ [Cohen, 1980]. Субстраты цАМФ-зависимых протеин-
киназ располагаются во всех частях клетки: цитозоле, эндо-
плазматическом ретикулуме (ЭПР), аппарате Гольджи, сек-
реторных гранулах, цитоскелете и ядре.
Из клеток растений были выделены протеинкиназы,
активируемые экзогенным цАМФ, например, из колеоп-
тилей кукурузы - протеинкиназа 36 кДа [Janistyn, 1986;
1988]. Като и соавт. [Kato et al., 1983] выделили из ряски
Lemna paucicostata
три типа протеинкиназ: 165, 85 и
145 кДа, одна из которых ингибировалась цАМФ, другая ак-
тивировалась цАМФ и третья была цАМФ-независимой.
Второй тип протеинкиназ фосфорилировал полипептиды
59, 19, 16 и 14 кДа.
Экзогенный цАМФ вызывал изменения (в основном, ин-
гибирование) фосфорилирования ряда полипептидов хло-
ропластов, опосредованного участием протеинкиназ
[Khurana et al, 1996].
Один из первых генов протеинкиназы, клонированных в
растениях, был похож на семейство протеинкиназ А живот-
ных по последовательностям нуклеотидов [Lowton et al.,
1989]. Имеются примеры сходства аминокислотных последо-
вательностей протеинкиназ А из растений (их гомологию) с
протеинкиназами А животных. Несколько групп исследова-
телей сообщили о клонировании генов, гомологичных гену
протеинкиназы А (обзорные работы: [Assman, 1995; Stone,
Walker,
1995]). Протеинкиназа из петунии фосфорилировала
специфичный синтетический субстрат протеинкиназы А
[Polya, Bovman,
1991]. Сообщалось о том, что добавление
цАМФ к экстрактам растений стимулирует фосфорилирова-
ние специфичных белков [Assman, 1995]. Исследование мест
фосфорилирования в фенилаланин-аммиак-лиазе (ФАЛ) -
ключевом ферменте биосинтеза фитоалексинов, обнаружило
сайты, специфичные для протеинкиназы A [Bolwell, 1995].
Использование высокоспецифичного белкового инги-
битора (БИ) цАМФ-зависимых протеинкиназ [Walsh et al.,
1971] позволило подтвердить предположение [Newton,
Brown,
1986], что цАМФ-зависимые протеинкиназы могут
быть активированы эндогенным цАМФ еще в процессе
приготовления образца: БИ подавлял базальную протеин-
киназную активность экстрактов из листьев в разных опы-
тах на 30-50% [Каримова, 1994]. Интермедиаты липоксиге-
назной сигнальной системы ГДК и МеЖК активировали в
присутствии цАМФ протеинкиназную активность на 33-
^8% [Каримова и др., 19996]. Салициловая кислота инду-
цировала повышение уровня цАМФ-зависимой фосфори-
лированности полипептидов 74, 61 и 22 кДа в листьях горо-
ха [Мухаметчина, 2000]. цАМФ-стимулируемая протеинки-
назная активность растворимых белков листьев гороха за-
висела от концентрации Са
2+
[Каримова и др., 1989; Тар-
чевская, 1990; Каримова, Жуков, 1991], причем фермента-
тивная активность обнаруживалась также в изолированных
клеточных стенках, ядрах, плазматических мембранах.
В растениях найдены гены, кодирующие фермент про-
теинфосфатазу, мишенью которой являются белки, фосфо-
рилированные с помощью протеинкиназы А.
Для характеристики аденилатциклазной сигнальной сис-
темы чрезвычайно важен факт обнаружения в растениях
генов, кодирующих белковые факторы регуляции транс-
крипции, которые имеют протяженные последовательно-
сти нуклеотидов, гомологичные CREB
S
-
цАМФ-связываю-
щему фактору транскрипции у животных [Bolwell, 1995].
Многочисленные данные о влиянии цАМФ на ионные
каналы клеток растений и относительно слабая экспери-
ментальная база представлений о возможности передачи
сигналов от цАМФ через фосфорилирование белковых фа-
кторов регуляции транскрипции в геном, с одной стороны,
укрепляют позиции сторонников существования непрямого
(через активацию ионных каналов) сигнального аденилат-
циклазного пути и, с другой, заставляют усилить попытки
получения доказательств функционирования прямого
цАМФ-сигнального пути.
МАР-КИНАЗНАЯ СИГНАЛЬНАЯ СИСТЕМА
Митогенактивируемые серин-треонинового типа про-
теинкиназы (МАРК) и МАР-киназный сигнальный каскад
(сигнал —> рецептор —> G-белки —> МАРККК —»
—
> МАРКК —> МАРК —> ФРТ —> геном), достаточно полно
изученные в животных объектах, функционируют и в
клетках растений (рис. 8). Им посвящены обзорные статьи
[Kultz, 1998; Jonak et al., 1999; Jouannic et al., 1999b;
Meskiene, Hirt,
2000] и работы экспериментального харак-
тера, в которых сообщаются сведения об индивидуальных
представителях этой сигнальной системы [Ichimura et al.,
1998; Nishihama et al., 1997; Jouannic et al., 1999b]
и особен-
ностях их регуляции.
МАР-киназный каскад "включается" при митозе (чем и
объясняется название этих протеинкиназ), при обезвожива-
нии [Mizoguchi et al., 1996; Тепа, Renaudin, 1998], гипоосмо-
тическом стрессе [Cazale et al., 1998], низкой температуре
[Jouannic et al., 1999b],
механическом раздражении растений
[Mizoguchi et al.,
1996], повреждении тканей [Seo et al., 1995;
Bogre et al., 1997; Morris et al.,
1997], окислительном стрессе
[Kovtun et al.,
2000], действии патогенов [Zhang, Klessig,
1998a; Meskiene, Hirt,
2000], элиситоров [Suzuki, Shinshi,
1995; Ligterink et al., 1997; Kultz, 1998; Zhang et al.,1998]
(в
том числе харпинов [Adam et al., 1997], криптогеина [Lebrun-
Garcia,
1998], олигосахаридов [Zhang et al., 1998]), стрессо-
вых фитогормонов жасмоната [Seo et al., 1995; 1999], сали-
цилата [Zang, Klessig, 1997; 1998], системина [Meindl et al.,
1998], этилена [Meskiene, Hirt, 2000]).
Зависимость функционирования МАР-киназного каска-
да от различных воздействий нашла отражение в названиях
некоторых МАР-киназ, например WIPK и SIPK (соответст-
венно wound-induced protein kinases и salicylate-induced protein
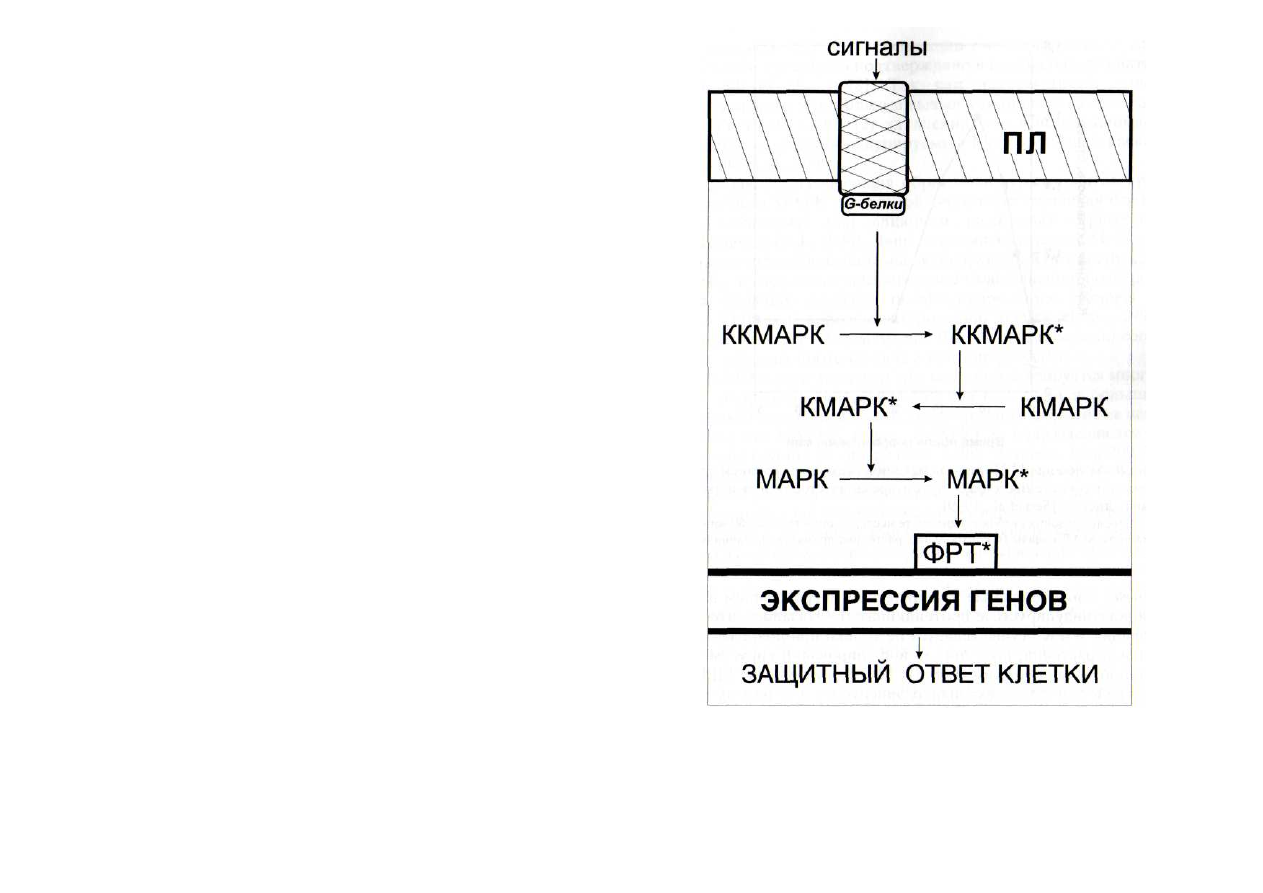
Рис. 8. Схема функционирования МАР-киназной сигнальной си-
стемы
ККМАРК - киназа киназы МАР-киназы; КМАРК - киназа МАР-
киназы; МАРК - митогенактивируемая протеинкиназа. Остальные
обозначения - см. рис. 6